出现患者死亡,自体CAR-NKT疗法临床试验被FDA暂停
来源:bioSeedin柏思荟 2023-03-24 17:48
KUR-503靶向GPC3,是一款同种异体的TCR-NKT细胞疗法,用于治疗肝细胞癌(HCC)。Athenex表示将于2023年上半年启动IND。
CAR-NKT细胞疗法临床暂停
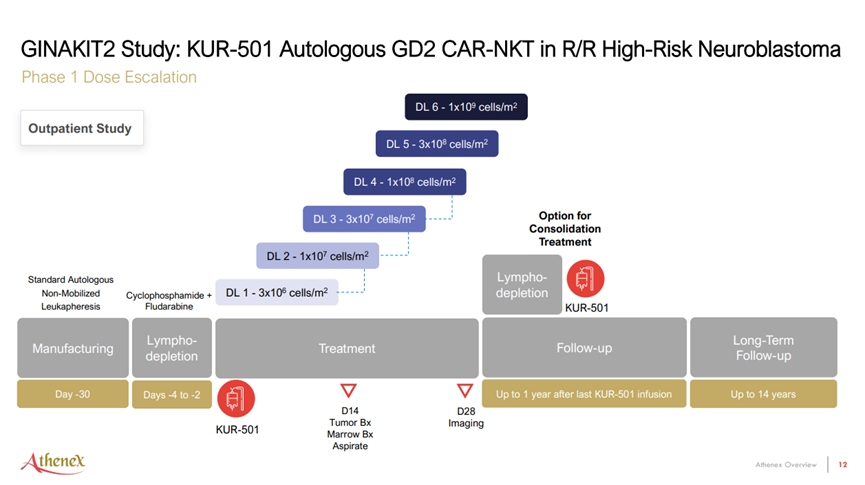
来源:Athenex官网
Athenex表示,死者是一名年轻男性患者,在接受KUR-501注射三周后死亡,第五剂量水平为300亿个细胞/m2。受试者被发现患有人偏肺病毒感染(human metapneumovirus infection),随后出现1级细胞因子风暴(CRS),随后接受免疫抑制剂治疗。受试者后来出现多克隆高白细胞增多症并伴有多器官功能障碍,但暂无败血症的迹象。
该公司表示,正在制定一项安全风险缓解计划,以支持重新开放临床试验,其中可能包括排除伴有病毒感染的患者,但不能保证临床搁置是否取消或何时取消。
这项资产是Athenex通过收购Kuur Therapeutics公司得到的。
2021年1月Kuur公司公布的临床研究结果显示:10例可评估患者中,出现1例完全缓解(CR)和1例部分缓解(PR),3例患者疾病稳定。肿瘤活检显示所有剂量组的CAR-NKT细胞均有迁移至肿瘤位置。安全性总体良好,有1例2级细胞因子综合症风暴(CRS),未出现免疫效应器细胞相关神经毒性综合征(ICANS)。
裁员、卖厂、与细胞疗法
Athenex成立于2003年,主要技术平台为Orascovery,基于该平台研发了其紫杉醇(paclitaxel)与encequidar结合的口服配方。Encequidar是一种新型P-糖蛋白抑制剂,它能将紫杉醇通过口服的形式给药。
然而,2021年2月,该药物用于治疗转移性乳腺癌的上市申请遭到FDA拒绝,当年10月,Athenex决定停止在美国寻求上市批准。
随着上市申请遭拒,Athenex的股价随之下跌,公司也展开了裁员活动。在经过战略审查和调整后,Athenex决定将发展重点转移到细胞疗法上来。
2021年5月初,Athenex以1.85亿美元收购Kuur Therapeutics,获得该公司旗下一系列细胞疗法在研项目。
为了增加资金储备以及偿还债务,Athenex还出售了自己的原料药工厂。2022年7月11日,Athenex将其位于中国的API原料药工厂以1900万美元的价格,出售给TiHe Capital。
目前,Athenex的细胞治疗管道一共有4款在研资产,其中2项资产进入临床。
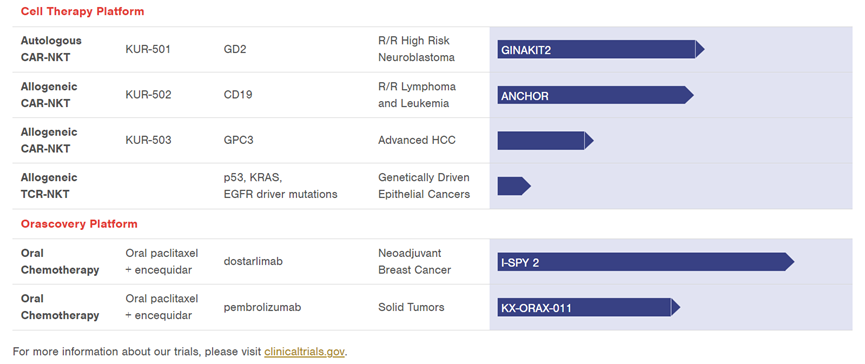
KUR-502 靶向CD19,是一款同种异体CAR-NKT疗法,针对复发/难治性淋巴瘤和白血病。2022年4月25日,Athenex公布Ⅰ期临床数据:KUR-502六个月的完全缓解(CR)为29%,其中一个在8.5个月时仍在CR。在低剂量组中,KUR-502达到57%的总响应率(ORR),71%疾病控制率(DCR)。
安全性方面,无免疫效应细胞相关神经毒性综合征(ICANS)和移植物抗宿主病 (GvHD)。2名ALL患者中出现1级细胞因子风暴(CRS)。
KUR-503
KUR-503靶向GPC3,是一款同种异体的TCR-NKT细胞疗法,用于治疗肝细胞癌(HCC)。Athenex表示将于2023年上半年启动IND。
自然杀伤T(Natural Killer T,NKT)细胞是一群细胞表面既有T细胞受体TCR,又有NK细胞受体的特殊T细胞亚群。NKT细胞能分泌大量细胞因子,发挥抗肿瘤免疫作用。全球范围内,CAR-NKT疗法都处于比较早期的研发阶段,还存在许多探索空间。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


