《自然》:太神奇了!复旦院士团队揭秘孕前糖尿病传给后代的奥秘,原因竟是糖尿病卵子无法“重启”精子表观遗传
来源:奇点糕 2022-05-22 08:44
糖尿病是最常见的慢性疾病之一,截至2021年,全球有5.37亿成年糖尿病患者[1]。在育龄女性中,糖尿病也很常见,通常,我们更多关注妊娠期糖尿病对后代的影响,而怀孕前患糖尿病对后代的影响和其中的机制尚
糖尿病是最常见的慢性疾病之一,截至2021年,全球有5.37亿成年糖尿病患者[1]。在育龄女性中,糖尿病也很常见,通常,我们更多关注妊娠期糖尿病对后代的影响,而怀孕前患糖尿病对后代的影响和其中的机制尚未得到充分的研究。
昨天,我国教育部生殖遗传重点实验室/复旦大学黄荷凤院士和中科院/复旦大学徐国良院士团队合作在《自然》杂志上发表了最新的研究成果[2]。
他们发现,妊娠前患糖尿病会在卵母细胞中留下代谢印记——DNA去甲基化酶Tet3水平显著下降,这使得它在修饰父亲来源的葡萄糖激酶基因时去甲基化不足,导致这个重要的胰岛素分泌基因呈高甲基化状态,因此,后代更容易出现胰岛素分泌缺陷。这一研究首次揭示了卵子源性糖尿病代际传递中表观遗传甲基化的精确调控机制。

本研究中,研究人员首先获取了糖尿病鼠妈的卵母细胞,与健康鼠爸的精子一起体外受精,然后将早期胚胎植入健康代孕鼠妈的子宫中继续发育。虽然使用了体外受精和胚胎移植技术,但胚胎的发育能力和后代数量与鼠爸鼠妈均健康的对照组小鼠相比没有显著差异,发育速度和体重也是正常的。
然而,在雄性后代16周和雌性后代1岁时,研究人员开始观察到它们的糖耐量异常问题,在注射葡萄糖后,它们的血糖水平明显高于对照组。而在高脂饮食的诱导下,实验组后代小鼠都会在12周龄或更早时候就出现糖耐量异常。不过,这种影响不会延续到后代的后代中。进一步的实验显示,小鼠糖耐量异常主要是由胰岛素分泌不足导致的。
在胚胎发育过程中,正确的表观遗传重编程可以消除父母基因组携带的印记,但以往的研究已经发现,母亲来源的环境暴露因素会干扰配子和早期胚胎的重编程,增加后代相应的患病风险[3,4]。
因此,研究人员对糖尿病鼠妈的卵母细胞进行了RNA测序。他们发现,一个关键的表观遗传修饰因子——Tet3表达水平显著降低了近50%。Tet3是唯一一种在卵母细胞发育过程中表达的DNA 5甲基胞嘧啶修饰酶,在受精卵阶段的DNA去甲基化中发挥重要作用,尤其是针对雄原核(受精过程中精子的细胞核)[5]。
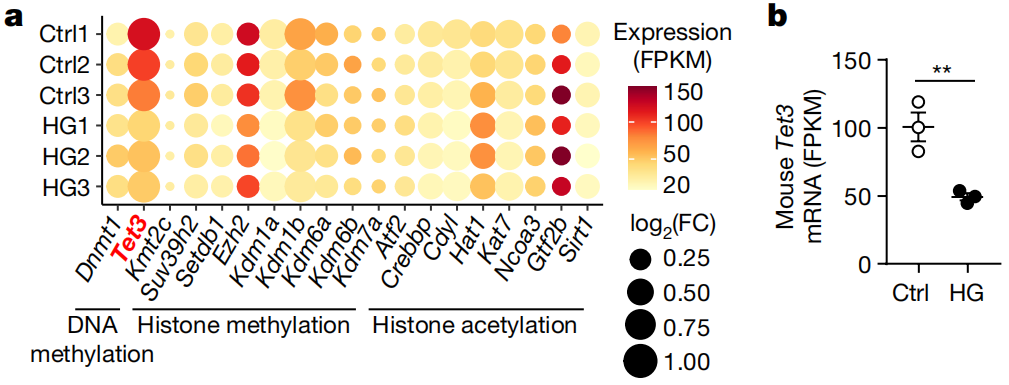
糖尿病(HG)和对照组(Ctrl)后代小鼠Tet3的表达水平和mRNA水平
Tet3的水平为什么降低了?问题还是出在高血糖上。无论是胚泡还是MII期的成熟卵细胞阶段,Tet3的转录水平均以葡萄糖浓度依赖的方式降低,而在血糖水平正常的小鼠中,即使用链脲佐菌素(STZ,诱导小鼠患糖尿病的化学物质)诱导,卵母细胞中的Tet3水平也不会变化。
在高血糖大鼠和人类糖尿病女性患者的卵泡液中,研究人员均检测到了葡萄糖水平显著升高,而且人类糖尿病女性患者的胚泡期卵母细胞也同样存在Tet3表达水平降低的现象。

c:小鼠胚泡和MII期Tet3的转录水平(由白至黑分别为对照组、STZ诱导的血糖正常、血糖中度偏高和重度偏高)
d:人类糖尿病女性(黑)和对照组(白)的Tet3转录水平
这样来看,Tet3的减少来源于高血糖,造成的结果也是高血糖。接下来,还要搞清楚,它作用于哪个基因,导致了后代糖耐量异常呢?
作为一个专业去甲基化的修饰因子,它的缺失想必会造成某些区域高水平的甲基化。按照这个思路,研究人员找到了后代小鼠胰岛中与胰岛素分泌有关的一个重要限速酶——葡萄糖激酶(Gck),它的启动子区域出现了高水平的甲基化。Gck是β细胞中葡萄糖感应机制的重要组成部分,Gck甲基化的增加也被认为是2型糖尿病的一个预测因子[6]。
敲除鼠妈卵母细胞的Tet3后,后代小鼠确实出现了Gck启动子区域高甲基化、表达水平下降和糖耐量异常的问题。
早在2011年,徐国良院士的团队就揭示过Tet3重编程中的作用,非常出人意料的是,母亲来源的Tet3的靶基因竟然不在自己的基因组中,而是对父亲基因组DNA胞嘧啶甲基进行氧化修饰,从而启动DNA去甲基化,也就是我们前面提到的,针对雄原核的DNA去甲基化[5]。
那么在糖尿病的代际遗传中,Tet3对Gck的影响也遵循这一机制吗?于是,研究人员追踪了后代小鼠的Gck启动子的甲基化模式。结合不同的表观遗传测序方法,研究人员发现,体外受精后PN3-4(受精后7-9小时)阶段受精卵的Line1转座子5'端存在高甲基化,而这一区域应该是在受精卵的雄原核中被Tet3主动去甲基化的。
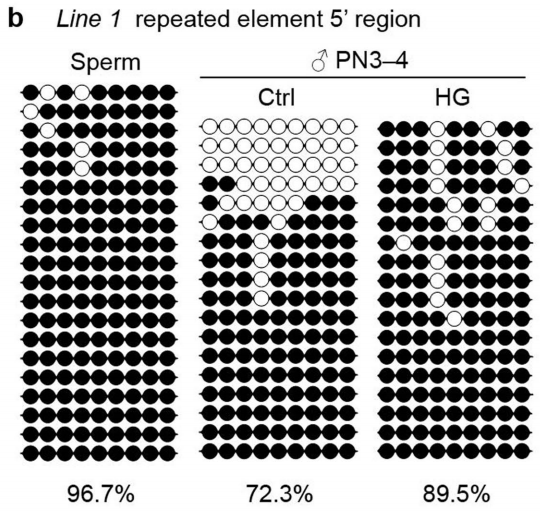
Line1转座子5'端的甲基化水平
研究人员还利用了在囊胚阶段启动子前存在的一个35-bp的缺失追踪了父本等位基因的遗传,焦磷酸测序结果显示,Gck启动子的高甲基化是囊胚中父本等位基因所特有的。基于这些实验结果,在糖尿病的代际遗传中,母亲来源的Tet3确实也是由于对父亲来源的Gck启动子去甲基化不足,从而导致后代出现了胰岛素分泌缺陷。
除了Gck外,研究人员还发现了另外三个基因Rapgef4、Gna11和Prkca的启动子也表现出父本等位基因特异性的高甲基化。因此,除了Gck外,可能还有更多的基因受到Tet3水平降低的影响。
研究人员还对比了一对儿妻子为糖尿病患者的夫妻和两对儿无糖尿病的夫妻体外受精的囊胚中,Gck启动子甲基化的水平,也同样发现了糖尿病组Gck启动子显著的高甲基化,印证了小鼠中的发现。
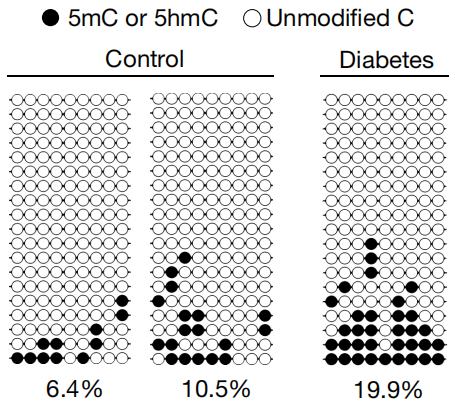
两个对照组和糖尿病组夫妻的Gck启动子的甲基化水平
总的来说,这项研究指出,怀孕前患糖尿病,未经干预或者干预不足,血糖水平高的母亲的卵母细胞中Tet3水平显著降低,导致对父亲来源的Gck基因启动子去甲基化不足,使得后代胰岛素分泌受损。这一发现加深了我们对发育源性疾病的理解。
黄荷凤院士表示,这项研究为生命早期干预的理念提供了关键理论基础,是接下来开展临床研究和实践的重要前提,为提前管理,从发育源头防控慢病,降低出生缺陷、提高我国人口健康提供了全新视角和策略[7]。
参考文献:
[1] International Diabetes Federation. IDF Diabetes Atlas, 10th edn. Brussels, Belgium: International Diabetes Federation, 2021.
[2] Chen, B., Du, YR., Zhu, H. et al. Maternal inheritance of glucose intolerance via oocyte TET3 insufficiency. Nature (2022). https://doi.org/10.1038/s41586-022-04756-4
[3] Sharma U, Rando O J. Metabolic inputs into the epigenome[J]. Cell metabolism, 2017, 25(3): 544-558.
[4] Cavalli G, Heard E. Advances in epigenetics link genetics to the environment and disease[J]. Nature, 2019, 571(7766): 489-499.
[5] Gu T P, Guo F, Yang H, et al. The role of Tet3 DNA dioxygenase in epigenetic reprogramming by oocytes[J]. Nature, 2011, 477(7366): 606-610.
[6] Tang L, Ye H, Hong Q, et al. Elevated CpG island methylation of GCK gene predicts the risk of type 2 diabetes in Chinese males[J]. Gene, 2014, 547(2): 329-333.
[7] https://www.fckyy.org.cn/news/content/id/368/pid/26530.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


