PNAS:北航常凌乾团队开发纳米细胞芯片,精准筛选肺癌免疫治疗获益人群
来源:生物世界 2024-05-08 09:24
北京航空航天大学常凌乾团队等开发了一种新型纳米医疗芯片,可以快速检测肺癌循环肿瘤细胞(CTC)内PD-L1基因表达、以及肿瘤细胞响应免疫细胞的行为表型。
以PD-1/PD-L1免疫检查点抑制剂(ICI)为代表的癌症免疫疗法是当前最具临床前景的肿瘤治疗方式之一,其通过重新激活癌症患者体的免疫细胞,从而提高对肿瘤细胞的识别和清除能力。但在临床中,仅有部分患者能从免疫治疗中获益。导致患者获益率差的主要原因之一是,临床常规组织活检,受限于取样位和检测的精准性,无法准确评估肿瘤的异质性。同时,仅依靠单一免疫标记物(如PD-L1),无法准确预测患者对ICI反馈。因此,如何精准预测免疫治疗的疗效,成为了个性化精准免疫治疗面临的首要问题。
针对该临床问题,北京航空航天大学常凌乾团队等开发了一种新型纳米医疗芯片,可以快速检测肺癌循环肿瘤细胞(CTC)内PD-L1基因表达、以及肿瘤细胞响应免疫细胞的行为表型;进一步对患者来源的CTC进行亚群划分,依此预测肺癌患者对免疫疗法的治疗效果。与传统组织活检技术相比,临床准确率(AUC值)由57%显著提高到90%以上。
该研究以:Genetic and phenotypic profiling of single living circulating tumor cells from patients with microfluidics 为题,发表在了《美国国家科学院院刊》(PNAS)上。

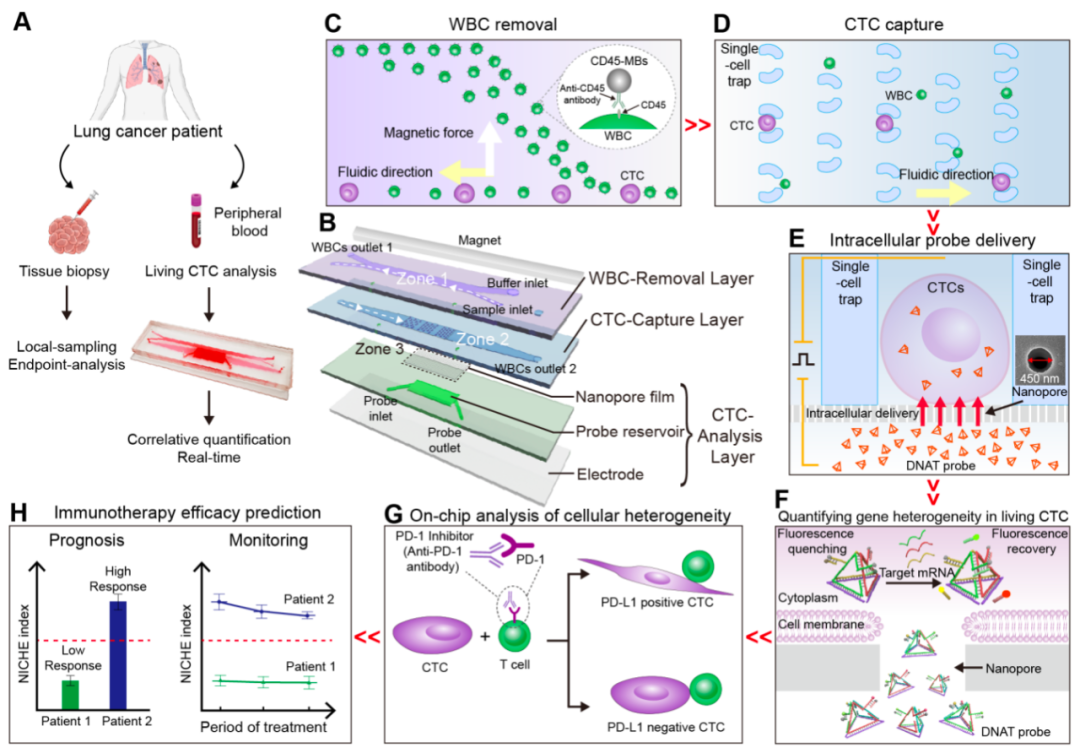
图1. 循环肿瘤细胞(CTC)捕获、原位培养和基因分析芯片系统NICHE,用于肺癌免疫治疗的精准预测与监测
该纳米芯片采用磁场和细胞尺寸,高效去除(>93%)血样中的白细胞,并捕获CTC使其形成单细胞阵列(>95%)。为了实现活CTCs内PD-L1基因的准确检测,研究者们设计了一种具有四面体结构的探针,实现对活细胞内PD-L1基因、内参GAPDH基因、以及CTC鉴定基因的同时检测。芯片采用实验室标签递送技术——纳米电穿孔,在2秒内将探针递送至95%细胞内,且保持良好的细胞安全性(90%),递送性能显著优于与其他常规方法(图2)。

图2. 在单个活细胞水平CTC内PD-L1 mRNA的精准量化
完成基因检测的CTC,保持了良好的活性。通过与免疫T细胞的共培养,研究团队发现,部分肿瘤细胞在免疫抑制剂存在时,细胞形态发生了明显的变长,且细胞增殖行为被显著抑制(图3)。根据肿瘤细胞PD-L1的表达情况,研究者们划分出了PD-L1高表达与低表达的阈值;另外,根据肿瘤细胞与免疫细胞共培养的结果,研究者们划分出了肿瘤细胞形态发生变化的阈值。综合CTC中PD-L1高表达(PD-L1high)且表型发生变化(PA+)的占比,该研究定义了一种新的指标,“NICHE指数”,用于预测癌症患者响应免疫疗法的疗效。

图3. CTC与免疫细胞共培养下发生形态改变
为了评估NICHE在临床上预测免疫疗效的性能,收集了80名非小细胞肺癌患者的外周血,通过在NICHE平台上的检测,证明了该平台捕获CTC并鉴定其基因和行为表型的能力(图4)。NICHE指数在预测临床预后方面,表现出高准确性(AUC=0.906),明显高于目前临床上基于肿瘤组织中PD-L1表达细胞占比的标准参考方法(AUC=0.578)。目前,该团队正在联合北大肿瘤医院吴楠主任,制定一项行业标准,用于肺癌免疫治疗获益人群筛选,以达到肺癌个性化医疗,有望降低临床癌症医疗负担。

图4. 采用NICHE系统对肺癌血样中的CTCs进行捕获与分析,并实现了患者免疫治疗的精准预测
北京航空航天大学常凌乾教授、北京大学肿瘤医院吴楠教授、格拉斯哥大学 Jonathan M. Cooper 教授、北京机械设备研究所杨明珠研究员为该论文共同通讯作者。北航医学科学与工程学院董再再(助理教授)、北航生物与医学工程学院汪于森硕士、北京大学肿瘤医院刘冰博士、上海市感染和免疫疾病科技创新中心徐高连教授为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


