Nature子刊:利用高通量液滴微流控技术对来自接受ART药物治疗的HIV感染者的HIV前病毒及其宿主整合位点进行测序
来源:生物谷原创 2022-04-18 09:16
人类免疫缺陷病毒(HIV)的感染是通过将它的基因组整合到受感染的宿主细胞中,进入可逆的潜伏状态,从而逃避抗逆转录病毒治疗(ART)。
人类免疫缺陷病毒(HIV)的感染是通过将它的基因组整合到受感染的宿主细胞中,进入可逆的潜伏状态,从而逃避抗逆转录病毒治疗(ART)。在单个细胞中对HIV前病毒(provirus,即病毒基因组整合进宿主细胞DNA的HIV)和相邻的宿主DNA连接(DNA junctions)进行测序的能力可以突出它的作用机制和在受感染细胞中的持久性。然而,由于背景人类DNA的数量高出1.5亿倍,这一实验很难进行。

在一项新的研究中,来自加州大学旧金山分校、华盛顿大学、美国国家卫生研究院和陈-扎克伯格生物中心的研究人员通过高通量微流控分析---对天然环境下的的HIV DNA进行基于液滴的全基因组扩增,展示了全长的HIV前病毒如何连接到HIV-宿主DNA连接。他们进行了PCR反应来标记含有HIV前病毒的液滴,对来自当时正在接受抑制性ART治疗的HIV感染者的受感染细胞进行测序和检测,以检测和测序成对的HIV前病毒基因组和整合位点。这项研究试图改善对持久受到HIV病毒感染的细胞库(下称HIV病毒库)的遗传分析。相关研究结果于2022年3月28日在线发表在Nature Biomedical Engineering期刊上,论文标题为“Droplet-microfluidics-assisted sequencing of HIV proviruses and their integration sites in cells from people on antiretroviral therapy”。
HIV治疗的现状和不断发展的治疗策略
虽然全世界大约有3700万人感染了HIV,但治愈方法仍然是未知的。这种病毒的感染机制构成了一个核心障碍,同时也是治愈该疾病的关键,因为HIV将它的基因组整合到受感染细胞的基因组中。虽然ART可以将病毒复制抑制到检测不到的水平,并防止获得性免疫缺陷综合征(AIDS,俗称艾滋病)的产生,但是它无法抵抗HIV病毒库。因此,ART必须无限期地持续下去,以防止病毒反弹和疾病进展。终生服用ART药物的费用高昂,很难解决与HIV有关的耻辱问题,而且有潜在的毒性。因此,根除或抑制HIV病毒库以获得功能性治愈非常重要。
为了研究HIV病毒库的持久性,科学家们必须对整合位点和全长的HIV前病毒序列进行配对分析。通过建立一种可靠的、具有成本效益的分离和测序稀有的HIV前病毒的方法,这些作者可以全面地描述HIV病毒库的特征。他们开发了这样一种方法,即利用同步整合位点和前病毒测序(simultaneous integration site and provirus sequencing, SIP-Seq)来描述HIV病毒库中的HIV前病毒及其细胞基因组背景。
战胜困难:一种获得单个HIV原病毒基因组的方法
通过使用全基因组测序扩增,这些作者在天然环境中扩增微流控液滴内的HIV基因组,然后对含有HIV前病毒的液滴进行标记以便进行测序。由此产生的方法提供了通过单个连续装配与它的宿主细胞DNA连接组装在一起的全长HIV病毒基因组。该方法的速度和效率允许在高出1.5亿倍的DNA背景中获得单个HIV前病毒基因组。他们使用SIP-Seq对多个ART相关个体的HIV前病毒群体进行分析,以了解潜伏的HIV病毒库。虽然他们专注于HIV,但是这种方法适用于入侵宿主基因组的多种病毒,以提供一种通用平台来描述多种感染的遗传学特征。
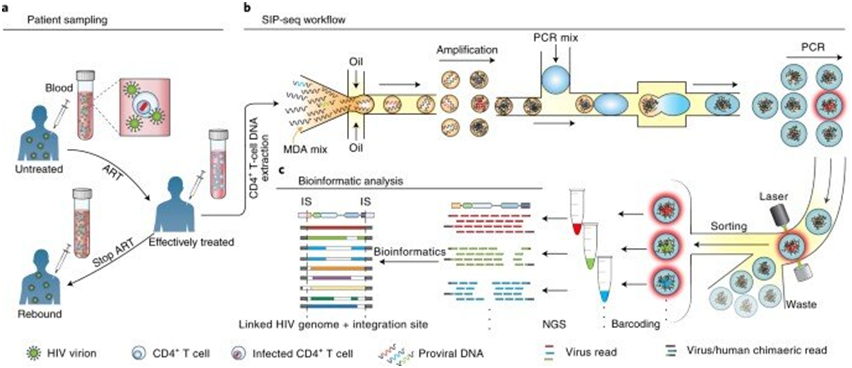
SIP-seq在接受ART药物治疗的感染者中的应用。图片来自Nature Biomedical Engineering, 2022, doi:10.1038/s41551-022-00864-8。
实验
这些作者旨在从数百万个CD4+T细胞中获得含有HIV基因组的所有DNA片段,对它们进行单独测序,并对它们相邻的宿主DNA连接进行测序。他们从封装在微液滴中的宿主细胞中提取了较大的DNA片段,以分离出整合到宿主细胞DNA中的HIV基因组。利用多重置换扩增(multiplexed displacement amplification, MDA),他们非特异性地扩增每个基因组片段,以获得足够多的HIV前病毒进行测序。他们随后分离出带有HIV前病毒的液滴,对每个液滴进行条码编码和测序。他们接着将每个液滴的读取片段映射到HIV参考基因组上以确定整合位点,从而获得对HIV基因组的复杂性及其整合位点的明确信息--这对评估HIV病毒库至关重要。
用SIP-Seq和调节微流控技术检测HIV前病毒
为了提高全长HIV前病毒的特异性并防止随机DNA裂解,这些作者采用了双特异性多重Taqman PCR来靶向HIV基因组上的区域。在实验过程中,他们产生了特定体积的DNA来进行测序并确认获得HIV前病毒。SIP-Seq装置的微流控技术包含三个设备,包括一个液滴封装器、一个合并器和一个分拣器。他们将多重置换扩增(MDA)试剂与人类基因组DNA片段装载在一起,在15分钟内将多达100亿个DNA片段(长度近似75kbp)封装在2000万个独立的液滴中。每个液滴包含500个不同的片段,在与Taqman PCR试剂合并在一起之前,他们将它们放在试管中在30℃下孵育,进行非特异性扩增。对所有检测到的HIV基因组重复这些步骤后,他们准备对这些试管进行测序。
分析接受ART治疗的感染者的HIV前病毒及其基因组蓝图
这些作者接下来在感染HIV的细胞系上验证了SIP-Seq,并分析了接受ART治疗的感染者体内的HIV。在实验中,他们先是利用平板培养来自接受ART治疗的感染者的静止性CD4+T细胞,在进行刺激和体外培养后通过三种方法进行增殖;鸟枪法、巢式PCR和使用Taqman探针的SIP-Seq。SIP-Seq和巢式PCR都产生了很好的结果,他们特别选择了SIP-Seq来描述体内受感染细胞的全部基因多样性。在此之后,他们表征了直接从感染者的CD4+T细胞中分离出HIV前病毒的基因组特征。这些结果显示,相对于以前对相同个体的研究,有三个克隆谱系支持克隆起源。
展望
这项新的研究表明,与现有的PCR方法相比,这些作者开发的方法使得他们能够更有效地研究HIV前病毒。他们通过表征潜伏的HIV病毒库的特征,对体内的HIV遗传图谱进行了全面的分析,突出了HIV病毒库在HIV持续存在中的作用。现有的方法是具有挑战性的,因为稀缺性和缺乏明确的表面标志物来识别遭受HIV潜伏感染的细胞。他们利用所描述的SIP-Seq方法,提供了一种快速、经济和可扩展的过程,他们将它应用于接受ART治疗的感染者,以突出潜伏的HIV病毒库中存在的克隆扩增细胞(clonally expanded cells)。这一策略适用于所有HIV感染,也适用于其他在生命周期中具有整合状态的病毒性疾病。(生物谷 Bioon.com)
参考资料:
1. Chen Sun et al. Droplet-microfluidics-assisted sequencing of HIV proviruses and their integration sites in cells from people on antiretroviral therapy. Nature Biomedical Engineering, 2022, doi:10.1038/s41551-022-00864-8.
2. Sequencing HIV proviruses from people on antiretroviral therapy using droplet-microfluidics
https://medicalxpress.com/news/2022-04-sequencing-hiv-proviruses-people-antiretroviral.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


