我国第一款CAR-T抗癌药物上市一周年,超200名患者使用,临床疗效如何?
来源:生物谷 2022-06-17 16:37
百尺竿头更进一步~
2021年6月22日,中国国家药品监督管理局(NMPA)宣布批准由复星凯特开发的CAR-T细胞治疗产品阿基仑赛注射液(商品名:奕凯达®),自此开启了中国CAR-T细胞治疗的元年。
同时,6月22日也成为复星凯特设立的一年一度“CAR-T日”。在奕凯达®上市一周年之际,复星医药携手复星凯特特邀淋巴瘤领域专家,就当下淋巴瘤诊疗现状,肿瘤免疫细胞治疗的创新发展,以及CAR-T细胞治疗产品的临床治疗案例。
CAR-T疗法带来治愈新希望
弥漫性大B细胞淋巴瘤(DLBCL)是一种最常见的发展迅速的侵袭性疾病,是非霍奇金淋巴瘤最常见形式,约占三分之二。73%的患者在二线治疗或更晚阶段无反应或复发。根据一项对603例复发/难治性DLBCL患者进行的汇总分析结果显示,患者的临床缓解率只有26%,中位总生存期仅6.3个月。临床上迫切需要可及性高的创新疗法的出现。CAR-T产品的到来,有望改变这些患者的治疗路径。
CAR-T细胞是指通过基因修饰技术,使用病毒等载体将带有特异性抗原识别结构域、铰链区、跨膜区、共刺激信号激活区等遗传物质转入自体或异体T细胞形成的。CAR-T回输到患者体内后,可与肿瘤细胞表面特异性抗原相结合而激活,通过释放穿孔素、颗粒酶等直接杀伤肿瘤细胞达到治疗肿瘤的目的。通过CAR-T细胞治疗产品的独特作用机制,可为患者带来可预见的治愈效果。
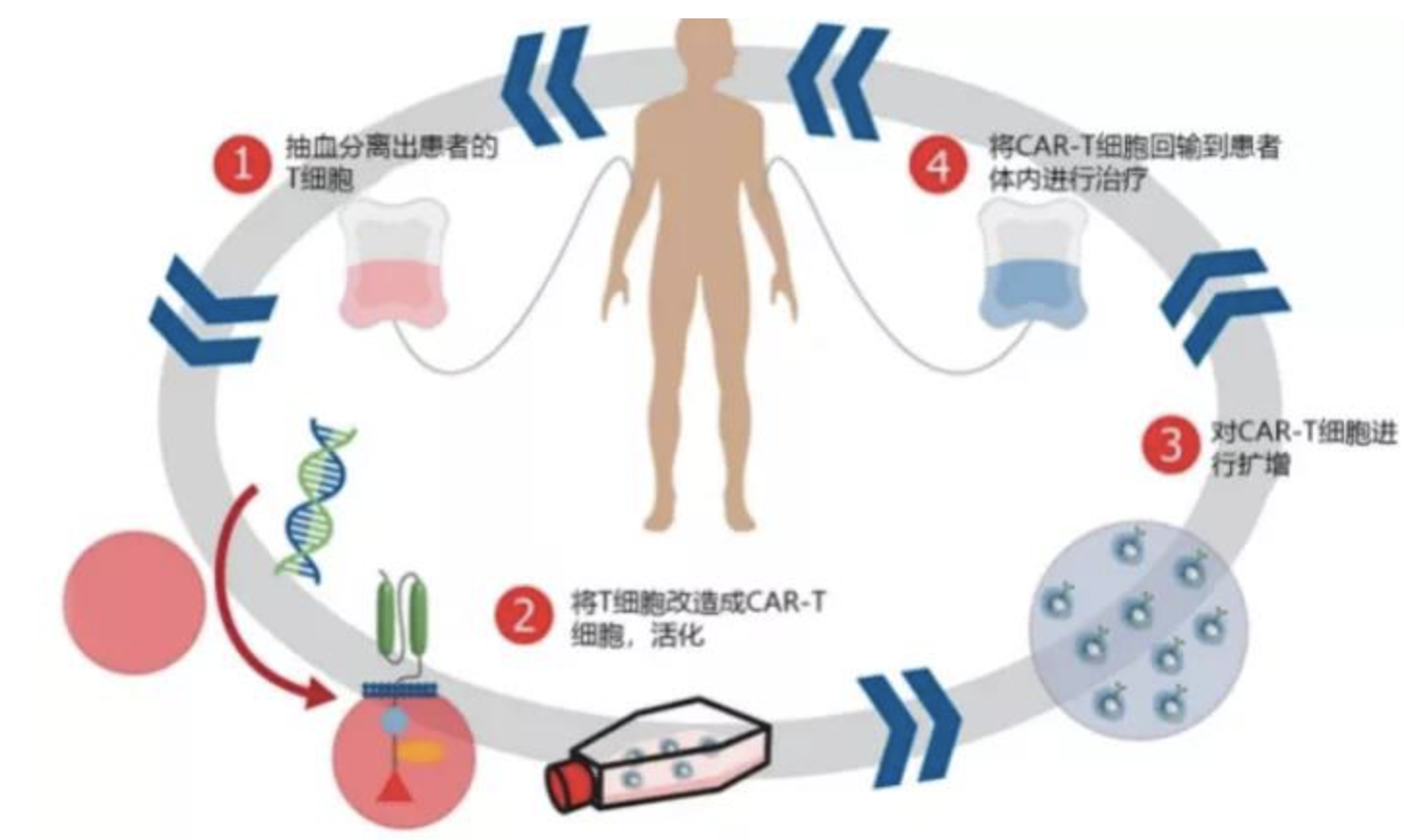
去年6月,奕凯达®成为国内首个获批上市的CAR-T细胞治疗产品,适用于治疗二线或以上系统性治疗后复发/难治性大B细胞淋巴瘤(LBCL)成人患者。该产品是复星凯特引进美国Kite(吉利德科学旗下公司)的CAR-T产品Yescarta®,并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品。
Yescarta®通过靶向B细胞表面的CD19抗原,引导并激活T细胞杀伤癌变的B细胞。Yescarta®于2017年10月获FDA首次批准,成为第二款CAR-T疗法,同时也是首个获批治疗复发/难治性大B细胞淋巴瘤(LBLC)成人患者的CAR-T疗法(作为三线疗法)。
目前,CAR-T已经在血液肿瘤领域显示出确切的临床疗效。根据一项在101例复发/难治性大B细胞淋巴瘤患者中进行的单臂、多中心、开放性注册临床研究(ZUMA-1)的结果,接受Yescarta®治疗患者的5年总生存率达42.6%,且5年生存患者中,92%不再需要额外抗癌治疗。经过CAR-T细胞疗法,这些患者可能已经临床治愈。
据悉,Yescarta®全球惠及超过7500位复发/难治性大B细胞淋巴瘤患者,而奕凯达®在中国上市一周年,也已惠及超过200位LBCL中国患者。
对此,来自上海交通大学医学院附属瑞金医院血液科主任医师王黎教授表示:“去年,中国首个CAR-T细胞治疗产品的获批上市,不仅为我们临床治疗提供了更多选择,更让原本’无药可治’的患者看到了治愈的可能,重获回归正常生活的机会。截至目前,我院已通过商业化CAR-T产品治疗了超过30名患者,在治疗阶段可评估的患者有19个,客观缓解率(ORR)高达94.7%,完全缓解率(CR)高达63.1%。其中,在奕凯达®刚上市不久,有一位老年女性弥漫大B细胞淋巴瘤患者,在经过两次的复发后,采用了CAR-T细胞疗法。经过24天的住院治疗后,首次评价就已获得完全缓解,6个月评估仍保持CR,让我们看到了CAR-T细胞治疗产品给患者带来的实际获益。作为医生,我们期待能有更多更好的产品早日进入临床,帮助更多的患者实现治愈的希望。”
王黎教授补充道:“CAR-T细胞治疗产品是个人定制药品,受患者基因型、免疫功能和疾病状态等因素影响,治疗效果会因人而异。但是以目前临床治疗情况而言,CAR-T疗法显著提高了血液肿瘤患者缓解率及总生存期,为患者带来治愈的可能。”
CAR-T疗法可及性逐步提高
奕凯达®的上市,为我国肿瘤治疗打开了一扇新门,具有重要的临床价值。然而,在CAR-T生产流程过程中,面临成本居高不下,生产周期长,植被流程复杂,质控环节众多,这些都对生产提出了较高要求。
复星凯特CEO黄海表示,“CAR-T细胞治疗产品拥有个性化定制、一次性疗法、可预见治愈效果的特点,为患者带来了全新希望。在过去一年中,复星凯特在CAR-T细胞治疗产品商业化进程中已经取得了里程碑式的进展,进一步提升CAR-T细胞治疗产品的可及性。”
为了能让更多患者早日回归正常生活,实现自我社会价值,复星凯特不断加速奕凯达®产品商业化的进程。一方面,复星凯特积极推动创新支付模式的落地,减轻患者经济负担,截至5月25日,奕凯达®已被纳入30多个省市的惠民保;另一方面,复星凯特积极拓展CAR-T治疗中心的覆盖,截至5月末,奕凯达®备案的治疗中心已达80多家,满足不同省市复发/难治性大B细胞淋巴瘤患者就近医治的治疗需求。
复星凯特CEO黄海还表示,“未来将把握重要先机,积极扩展奕凯达®的更多适应症、发展新靶点新技术并加速实体瘤领域研发进程,希望能够惠及更多肿瘤患者。除了更多适应症的拓展外,复星凯特第二款CAR-T细胞治疗产品FKC889(用于治疗既往接受过二线及以上治疗后复发/难治性套细胞淋巴瘤(r/r MCL)成人患者,已于2022年3月获批于中国境内开展临床试验。此外,复星凯特积极布局研发管线和加强自主研发实力,正在加速推进针对实体瘤的5个临床前项目,致力于弥补实体瘤应用上存在的巨大空白。
需要指出的是,近年来,CAR-T细胞疗法已成为全球研发热点,临床试验数量呈井喷之势,这无疑会加剧同质化竞争。在所有的CAR-T项目中,CD19是最常见的研究靶点。尽管CAR-T细胞疗法的好处多多,但也存在不少问题和挑战,比如毒副反应,细胞因子释放综合征,神经毒性和脱靶效应,过敏反应等等。相信未来,随着技术不断的发展,终究能克服。
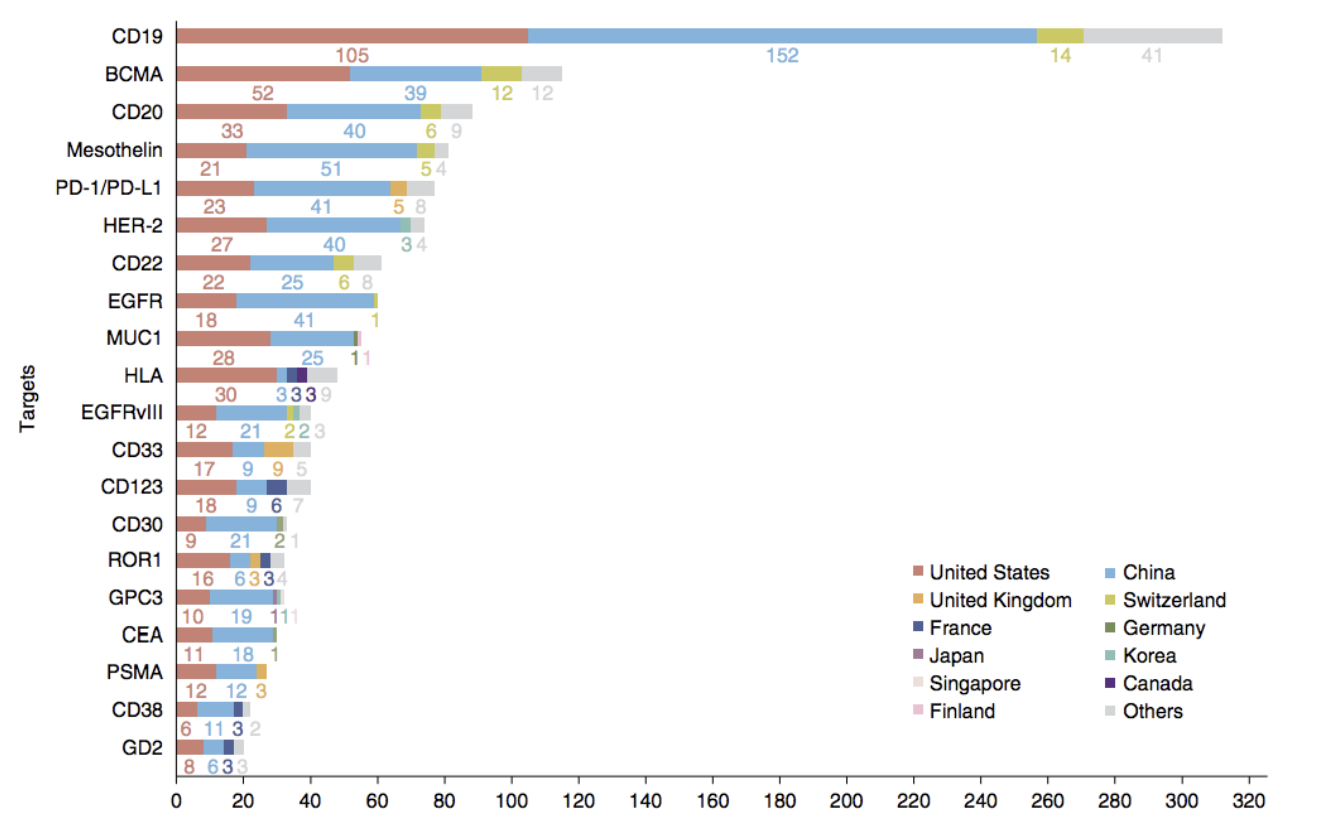
CAR-T治疗TOP20靶点
作为复星医药的创新平台之一,复星凯特的CAR-T细胞治疗产品在中国上市只是一个起点,经过超十余年的持续投入,复星医药已在肿瘤治疗领域迎来多款行业“首个”产品获批上市,通过自主研发、合作开发、许可引进、深度孵化等多元化、多层次的合作模式对接全球优秀科学人才,推动创新技术和产品的开发和落地。
“肿瘤领域一直是复星医药关注的重点领域,近年来,从诊断到治疗,全产业链深度布局肿瘤生态,以期为肿瘤患者提供更可及的治疗方案和全方位的健康保障。未来,围绕未满足需求的治疗领域,复星医药将继续积极布局新技术和产品,为患者带来更多治愈的希望,让每个家庭乐享健康。”最后,复星医药董事长吴以芳说道。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


