Nature子刊:利用患者来源的iPS细胞重现强直性肌营养不良1型的骨骼肌病理
来源:生物谷原创 2023-01-27 14:24
在一项新的研究中,Hidetoshi Sakurai实验室利用由患者衍生的诱导性多能干细胞(iPS)产生的骨骼肌细胞成功地再现了强直性肌营养不良1型的病理,并展示了它们用于药物疗效的定量评估。
在一项新的研究中,来自日本京都大学iPS细胞研究与应用中心的Hidetoshi Sakurai实验室利用由患者衍生的诱导性多能干细胞(iPS)产生的骨骼肌细胞成功地再现了强直性肌营养不良1型(Myotonic Dystrophy type 1, DM1)的病理,并展示了它们用于药物疗效的定量评估。相关研究结果于2023年1月11日发表在Scientific Reports期刊上,论文标题为“Establishment of quantitative and consistent in vitro skeletal muscle pathological models of myotonic dystrophy type 1 using patient-derived iPSCs”。

DM1被认为是成人中最常见的肌肉萎缩症,但目前还没有治疗方法。为了发现和开发新的治疗性药物,迫切需要设计一种使用人类细胞的评估系统,以便能够忠实地再现DM1患者的病理。
DM1是一种遗传性疾病,由DMPK(dystrophia myotonica-protein kinase)基因中CTG重复序列的异常扩增引起。由发生CTG扩增的DMPK基因产生的异常RNA诱导聚集,从而导致剪接因子MBNL1(muscleblind-like splicing regulator 1)在细胞核中的功能丧失。由此导致的MBNL1介导的基因剪接的破坏被认为是DM1发病的主要机制。
利用他们之前设计的直接和间接分化方案(分别在有或没有诱导MYOD表达的情况下),这些作者能够利用DM1患者衍生的iPS细胞产生骨骼肌细胞(下称DM1骨骼肌细胞),并再现了DM1中的多种细胞病理变化,如MBNL1蛋白聚集物的形成和DMD、BIN1和ATP2A1等基因的剪接缺陷。
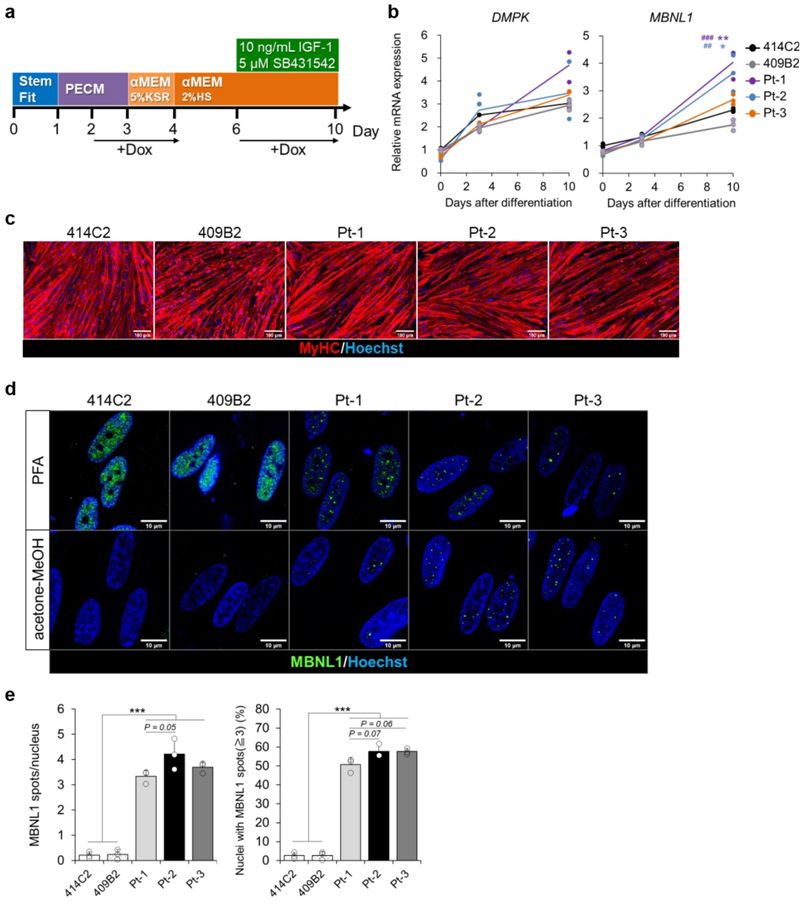
在MyoD-DM1-hiPSC分化而来的肌管中,MBNL1在细胞核内聚集。图片来自Scientific Reports, 2023, doi:10.1038/s41598-022-26614-z。
这些作者接下来使用这些分化的细胞来评估候选药物,看它们是否有能力逆转所观察到的细胞病变。他们用CAG25处理分化的DM1骨骼肌细胞,其中CAG25是一种反义寡核苷酸,以前在临床前研究中已被证明对DM1病理有治疗作用。一致的是,分化的DM1骨骼肌细胞中的MBNL1聚集和剪接缺陷都被CAG25处理所拯救,这表明这些分化的骨骼肌细胞可以作为一种平台,根据已知的DM1病理学定量地评估药物疗效。
这种新构建的基于DM1患者衍生的iPS细胞产生的分化骨骼肌细胞的药物评估系统有望为未来发现和开发针对DM1的有效治疗药物做出贡献。(生物谷 Bioon.com)
参考资料:
Ryu Kawada et al. Establishment of quantitative and consistent in vitro skeletal muscle pathological models of myotonic dystrophy type 1 using patient-derived iPSCs. Scientific Reports, 2023, doi:10.1038/s41598-022-26614-z.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


