AI辅助药物设计,开发出超级抗菌药 Drug X,有望解决抗生素耐药难题
来源:生物世界 2022-09-23 10:10
人类和其他哺乳动物一样,身体被包括细菌在内的数万亿微生物占据,它们与人类组成了一个共生系统。
人类和其他哺乳动物一样,身体被包括细菌在内的数万亿微生物占据,它们与人类组成了一个共生系统。这些细菌对人体健康发挥着重要作用,例如肠道菌群,影响着人类的代谢、肠道健康、自身免疫疾病、对治疗药物的反应,甚至还会影响人类寿命。
然而,也有不少细菌的感染会导致人类疾病,甚至危及生命,例如臭名昭著的结核杆菌(导致肺结核)、霍乱弧菌(导致霍乱)等等。在人类历史上,感染这些致病细菌,除了依赖人体自身的免疫系统,几乎无解。直到100年前,青霉素的发现和应用开启了抗生素时代,让人类第一次有了战胜致病细菌的能力,更是直接提升了人类的寿命。
解决抗生素耐药性迫在眉睫
100年来,抗生素的广泛应用也带来了一个巨大的危机——抗生素耐药性(AMR),据世界卫生组织(WHO)统计,2019年全球约有120万人死于抗生素耐药性(AMR)所加剧的细菌感染,这已经高于艾滋病导致的死亡人数。更重要的是,照此发展,到2050年,抗生素耐药性(AMR)将可能导致超过1000万人死亡,这将超过癌症导致的死亡人数。
目前,已知的抗生素主要有四种不同的杀菌机制——抑制细菌细胞壁的合成;与细菌细胞膜相互作用;干扰细菌蛋白质的合成;抑制细菌的核酸复制和转录。例如,最经典的抗生素青霉素就是通过抑制细菌细胞壁合成来达到杀菌的效果。但如果细菌对其中一种机制产生耐药性,那么同机制的其他抗生素往往也将失效。
因此,发现全新靶点的新类别抗生素来消灭超级耐药菌迫在眉睫。然而,开发新型抗生素远非易事,我们都知道新药研发的“双十定律”(一款创新药从研发到上市,平均成本超过10亿美元、研发周期大于10年),而抗生素的研发平均需要16亿美元。更关键的是,漫长的开发过程导致一些抗生素获批后,还没开始大规模的临床应用,就已经有细菌出现了抗药性【1】。
刘冰教授团队的突破性发现
西安交通大学第一附属医院刘冰教授团队在国际著名学术期刊《美国国家科学院院刊》(PNAS)上发表了一篇题为:Bacteriophage protein Gp46 is a cross-species inhibitor of nucleoid-associated HU proteins 的研究论文。

刘冰教授团队从细菌的天敌噬菌体出发,在世界上首次发现了噬菌体编码靶向细菌类组蛋白 HU 的抑菌基因,并详细阐述了噬菌体 Gp46 蛋白通过与 HU 结合而抑制细菌的详细机制,Gp46 在模式菌种的表达会引起菌体变长,拟核区消失,最终导致细菌死亡。
Gp46 虽然功能强大,但作为一种来自噬菌体的蛋白,并不很适合直接作为抗菌药物使用。因此,刘冰教授希望通过小分子药物来模拟 Gp46 蛋白的抑菌作用,从而开发出一类全新的超级抗菌药。
刘冰教授在研发工作中采用了基于华为云盘古药物分子大模型打造的 AI 辅助药物设计服务,突破性地找到能够替代 Gp46 蛋白的小分子化合物, 研发出一款超级抗菌药——Drug X,并打破了医药界的“双十定律”。刘冰教授表示,华为云盘古药物分子大模型让先导化合物的研发周期从数年缩短至一个月,而且研发成本降低了70%。
Drug X 有望解决抗生素耐药难题
如前文所述,目前已知的抗生素有四种不同的杀菌机制,细菌一旦对其中一种机制产生耐药性,那么同机制的其他抗生素往往也将失效。因此,发现全新靶点的新类别抗生素将是抗菌药领域的重大突破。
而超级抗菌药 Drug X 有望成为全球近40年来首个新靶点、新类别的抗生素。Drug X通过靶向微生物类组蛋白 HU,抑制细菌的DNA复制,以达到抗菌效果,是世界上首次发现噬菌体编码靶向细菌类组蛋白HU的抑菌抑制剂。在新的抗菌机制下,细菌将很难产生耐药性。
此外,刘冰教授团队的实验证明,超级抗菌药 Drug X 是广谱抗生素,可广泛抑制大部分细菌:包括金黄色葡萄球菌、鲍曼不动杆菌、肺炎克雷伯菌等大部分临床重要耐药细菌,以及顶复门类寄生虫(包括疟原虫、弓形虫),这为以后耐药菌、疟原虫的防治奠定了重要基础,未来可用于治疗结核病、淋病等疾病。
华为云AI助力超级抗菌药研发
药物研发平均周期超过10年,其中先导药物的设计就需要3-5年之久,科研人员需要反复对不同小分子化合物进行结合实验、结构修改及效果验证,以找到最理想的小分子化合物。在数以亿计的小分子化合物面前,传统人工筛选的方式不仅试错成本高,而且高度依赖药物学专家的经验。
研发 Drug X 时,刘冰教授刚回国不久,实验室还在建设中,在进行 AI 辅助药物设计的过程中,很快就遇到了算力不足等问题。此时,华为云团队伸出了援手。
刘冰教授表示,华为云盘古药物分子大模型在“药物分子筛选”和“药物分子优化”这两大环节对 Drug X 的研发提供了重要帮助。
华为云盘古药物分子大模型预先学习了17亿个药物分子的化学结构,生成了包含超过1亿种可用于虚拟筛选的新分子结构的药物数据库 DrugSpaceX,为开展虚拟筛选和药物分子设计提供了高质量的资源。
在这个全新的亿级小分子库中,华为云通过AI对药物分子的80多种理化性质(包括水溶性、代谢活性、排泄速率、毒性等)进行属性预测和打分,筛选出成药性好,且结构新颖性为100%的药物分子。
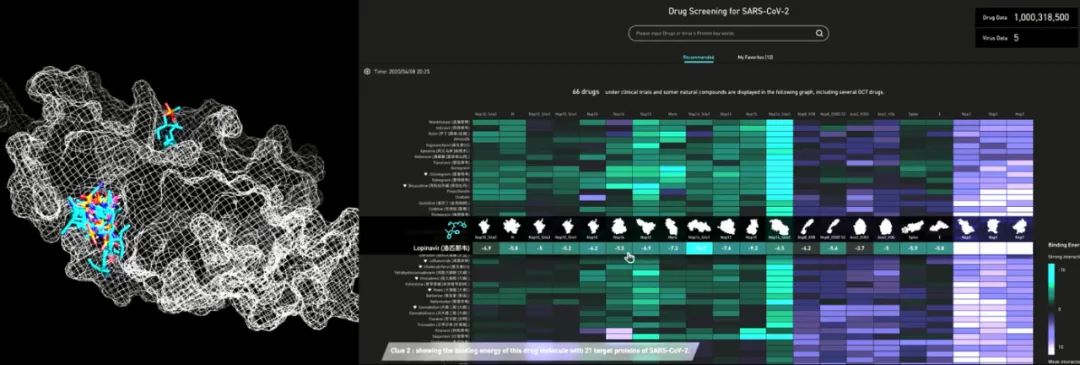
通过华为云AI辅助药物设计服务平台进行药物分子筛选
在 AI 优先推荐的药物分子基础上,刘冰教授团队再进一步进行人工实验验证。实验结果表明,华为云盘古药物分子大模型的成药性预测准确率比传统方式高20%,进而提升研发效率,让先导化合物的研发周期从数年缩短至一个月,同时降低70%的研发成本。
筛选出一个较为理想的可成药小分子化合物后,刘冰教授团队需要进一步对小分子化合物的结构进行定向优化。他们通过华为云盘古药物分子大模型的结构优化器成功提高了发现的小分子化合物与目标抗菌靶点蛋白的结合,降低了与人体蛋白的结合,通过更科学的药物结构设计,降低新药可能对人体产生的毒副作用。
总的来说,除了缩短研发时间、降低研发成本,华为云盘古药物分子大模型还能够对筛选后的先导化合物进行定向优化,帮助降低候选新药的毒副作用。
最后,刘冰教授介绍道,超级抗菌药研发已取得重要突破,于近期在国际范围内申请专利,目前正在进行支持 IND(新药临床研究审批)申报的临床前研究阶段。
2020年,AlphaFold2 凭借对蛋白质结构的精准预测一战成名,成功入选了《自然》以及《科学》杂志各自评选的年度十大科学突破之首。如今,人工智能(AI)已成为医药行业的核心技术新助力,凭借机器学习、图像识别等独特优势,AI 具有缩短新药发现时间、节省研发成本、提高净收入的巨大潜力。
超级抗菌药 Drug X 的研发,正体现了 AI 辅助药物设计的强大威力,正如刘冰教授所说:AI 辅助药物设计,不仅提高了药物研发的效率,降低了成本,还大大降低了药物研发的门槛,激发了更多人参与到药物研发中来。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


