《自然》双重磅:首次全面破解精神分裂症的遗传起源
来源: 奇点糕 2022-04-29 11:50
基因,是世界上最神秘、最重要、最难以破解的代码(起码是在地球上吧应该),是解锁生命奥秘、攻克顽疾的钥匙。
基因,是世界上最神秘、最重要、最难以破解的代码(起码是在地球上吧应该),是解锁生命奥秘、攻克顽疾的钥匙。
而愚人节那天一觉醒来,好家伙,人类基因组竟然几乎全部解码!人类基因组测序计划被誉为生命科学领域的“登月计划”,科学家们历经近20年的努力,终于将人类基因组图谱完整补齐,让人们得以从“上帝视角”看全DNA草图。
不过,在这个春暖花开、风大到蹬不动自行车的四月份里,由人类基因组学带来的惊喜还不止如此。
4月初时,两篇关于精神分裂症的重磅文章以背靠背的形式发表于顶刊《自然》上,首次为我们详细分析了精神分裂症的遗传因素。
这两项研究分别由精神疾病基因组学协会(Psychiatric Genomics Consortium,PGC)、精神分裂症外显子组测序元分析协会(Schizophrenia Exome Sequencing Meta-Analysis,SCHEMA)完成,汇集来自于40多个国家、数百个机构的研究人员。
基于不同的研究侧重点以及鼎力合作,他们寻找到与精神分裂症相关的常见或罕见遗传变异,并对其分子机制提出突破性的见解——精神分裂症是由神经突触的通讯中断所引起,为精神分裂症提供了新的治疗靶点。
接下来,奇点糕将简单展示PGC、SCHEMA成员此次的研究结果,来跟大家一同追溯精神分裂症的遗传起源,揭秘其遗传分子机制。

在此之前,人们对驱动精神分裂症发生的遗传变异及其分子机制的了解,在很大程度上仍是一大片空白,直白点儿说就是连“开荒”阶段都还没完全渡过。
因此,现有的精神分裂症治疗策略,主要是针对患者的幻觉、妄想等症状进行治疗,且大约有30%的患者存在耐药性[1]。如何“治标还治本”、有效针对性地治疗,并在人群中预测精神分裂症的患病风险,成了令人头秃的问题。
自2009年以来,PGC已开展越来越大规模的全基因组关联研究(GWAS),以寻找与精神分裂症显著相关的单核苷酸多态性位点(SNP)。
此次,由来自德国柏林Charité医学院的Vassily Trubetskoy及其他PGC的研究人员,对来自全球320404人的常见遗传变异进行分析,最终确定287个关联基因座。在这32万人中,包括76755名精神分裂症患者,以及243649名非精神分裂症的参与者[2]。

论文首页截图
Trubetskoy等人进一步通过精细定位(fine-mapping)以及功能研究,鉴定出120个关联基因,其中106个为编码基因,例如谷氨酸受体亚基GRIN2A、转录因子SP4等。
这些常见遗传变异与精神分裂症显著关联,但每种变异的影响都较微弱,与精神分裂症风险增加不到5%相关。
不仅如此,他们还发现,与精神分裂症关联的基因富集表达于大脑神经元细胞中,且大多参与突触的组织、分化、传递等生理过程,编码的蛋白包括离子通道型受体、代谢受体、细胞粘附分子等。在各种神经元细胞中,与精神分裂症的发生最为密切相关的三种亚型为锥体神经元(pyramidal)、中等多棘神经元(medium spiny)和颗粒神经元(granule)。
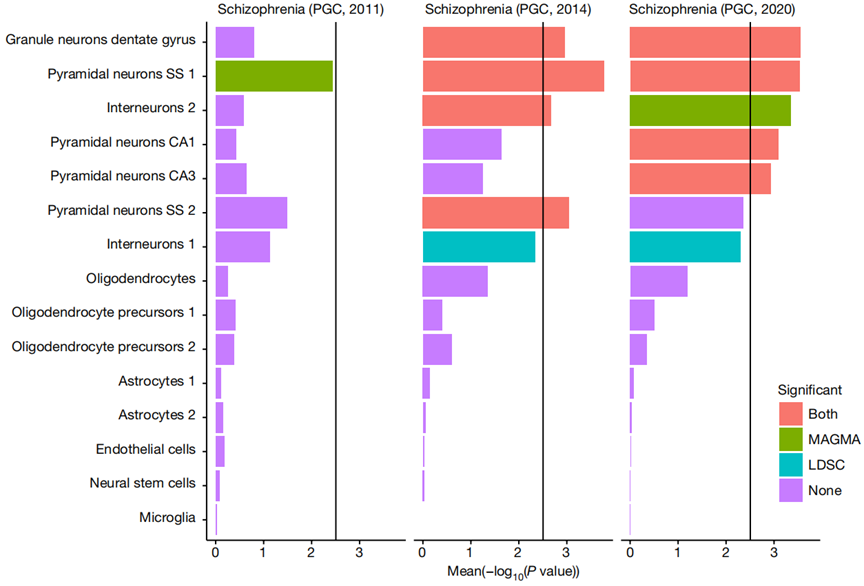
与精神分裂症相关的常见遗传变异,基因富集在神经元细胞中表达
有趣的是,PGC、SCHEMA两边儿的研究人员一通气发现,GRIN2A、SP4、STAG1和FAM120A这几个基因,不仅其常见遗传变异与精神分裂症的发病有关,其罕见遗传变异也和患病风险脱不了干系。
相比于PGC研究,于2019年启动的SCHEMA研究更专注于外显子组,也就是负责编码蛋白质的那部分基因(大约占人类基因组2%),以寻找对精神分裂症风险有很大影响且极其罕见的遗传突变(URV)。
在这项研究中,由来自美国麻省理工学院和哈佛大学布罗德研究所的Tarjinder Singh及其他SCHEMA的研究人员,对121570人的外显子组测序并进行比对,结果发现有10个基因的罕见遗传变异与患病风险显著相关,分别为GRIN2A、GRIA3、SP4、SETD1A、RB1CC1、CACNA1G、CUL1、HERC1、XPO7、TRIO[1]。
他们还提出,包括STAG1、FAM120A、AKAP11在内的22个基因的罕见遗传变异也与精神分裂症的发病有关,但在此次研究中未做深入探讨。

论文首页截图
与常见遗传变异不同的是,这10个基因一旦发生罕见遗传变异,如蛋白质截断变异(PTV),都与重大患病风险相关(OR 3-50,P<2.14×10−6)。
不过,与PGC研究人员的成果达成一致的是,Singh等人也强调,神经元之间相互连接和交流的地方——也就是大脑神经突触,其功能调节在精神分裂症发病过程中扮演着极其重要的角色。另外,蛋白质降解、核转位等细胞生理活动也有潜在的病理影响。
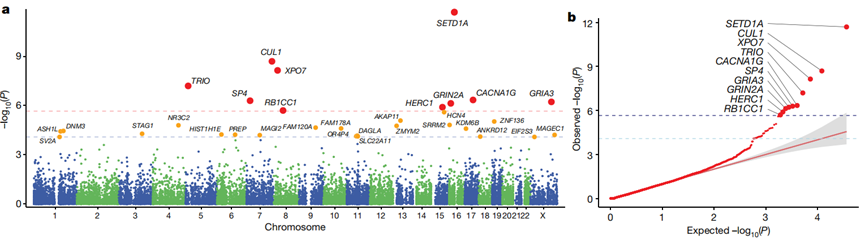
10+22(FDR<5%)个基因
值得注意的是,Singh等人还探索了这10个基因与发育迟缓/智力障碍(DD/ID)、自闭症(ASD)等其他神经发育障碍之间的关联。
结果发现,SETD1A、TRIO、GRIN2A、CACNA1G的罕见遗传变异与DD/ID的发病也相关。
其中,TRIO、GRIN2A、CACNA1G这3个基因有点特别,如果发生错义突变(危害程度较小),那么与精神分裂症、DD/ID的发病都相关。如果是发生蛋白质截断变异(危害程度较高),便只与精神分裂症的发病有关。
也就是说,不同的神经发育障碍疾病之间或共享相同的分子机制。但是,具体是哪种类型的神经发育障碍,可能是由同一基因的不同类型遗传变异所驱动。

左、中:10个基因中,每个基因和精神分裂症、DD/ID的关联不同
右:扩展的22个基因中,与精神分裂症、DD/ID的关联
另一项紧随其后,发表在Nature Genetics期刊上的文章也支持这一观点[3]。
咱刚才讲到,有22个基因的罕见遗传突变并没有SCHEMA研究中做深入探索。而其中的AKAP11,正是另一大精神疾病——双相情感障碍最强的遗传风险因素。
由同样来自美国麻省理工学院和哈佛大学布罗德研究所的Duncan S. Palmer及其同事,完成2.8万人的外显子组测序。基于SCHEMA的数据,发现AKAP11的蛋白质截断变异会使得双相情感障碍的患病风险增加6倍(OR 7.06,P=2.83×10−9),并确定其作用靶点GSK3B。
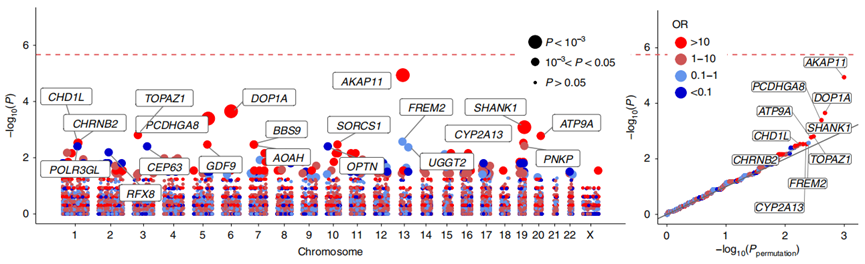
图:这几种基因发生蛋白质截断变异与双相情感障碍患病风险之间的关联
总体来说,PGC和SCHEMA的研究成员分别灵活运用GWAS和外显子测序技术完成各自的研究,并通过合作实现了两种技术的完美融合。
由众多PGC研究成员完成的这项研究,是迄今最大规模的精神分裂症基因组学研究,共纳入约32万人,发现大量可能在精神分裂症中发挥重要作用的特定基因,其常见遗传变异对患病风险的贡献较小。
另一项由SCHEMA研究人员完成的研究具有里程碑的意义,在对12万人的外显子组数据进行分析后,首次发现与精神分裂症高患病风险相关的罕见遗传突变。
参与这两项研究的研究人员强调,神经突触的功能异常是精神分裂症的重要分子机制。而GRIN2A等基因的常见、罕见遗传变异与不同的患病风险相关,说明基因功能的损伤程度或可体现疾病严重程度。这些研究成果,或能为精神分裂症及其他神经发育障碍疾病的研究指出一些新的方向,并提供有力证据。
精神分裂症诊治的春天,即将来临吗?
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


