Nat Commun│华中科技大学方超团队发现调节血栓形成的新机制
来源:生物探索 2024-04-17 09:27
本研究为PDI抑制剂在不促进出血的情况下减少血栓形成的临床效果提供了机制见解。
华中科技大学方超团队在Nature Communications发表题为“Protein disulfide isomerase cleaves allosteric disulfides in histidine-rich glycoprotein to regulate thrombosis”的研究论文,该研究表明富含组氨酸的糖蛋白(HRG)是PDI的底物。PDI降低HRG分别通过中和内皮硫酸乙酰肝素(HS)和抑制因子XII(FXIIa)活性来增强HRG的促凝血和抗凝活性。
与野生型相比,小鼠HRG缺陷(HRG-/-)导致血栓发生延迟,但血栓形成增强。然而,在联合FXII缺陷(F12-/-)和HRG缺陷(通过siRNA或HRG-/-)中,与单独F12-/-相比,血栓形成进一步减少,证实了HRG独立于FXIIa的促凝活性。PDI的靶二硫化物突变导致HRG的功能获得性突变,从而促进其在凝血过程中的活性。因此,PDI-HRG通路通过中和HS促进其快速启动,并通过抑制FXIIa防止过度增殖来微调血栓形成。

大多数抗血栓药物与出血风险有关,尽管程度不同。其本质是,止血反应是一个高度动态的过程,由多种正负调节机制进行微调。作为正常防御过程的一部分,凝血系统在血管损伤后的止血过程中迅速启动,以密封缺口并维持封闭的高压循环系统的完整性。伴随着活化的血小板作为发育中的血栓的主要成分被募集到损伤部位,由外源通路的组织因子(TF)触发的血液凝固被激活以产生凝血酶,从而产生纤维蛋白。
内源性途径进一步促进凝块形成,激活的血小板以及微囊泡、外泌体、DNA和RNA等其他实体释放的带负电荷表面的因子XII (FXII) ,从而最终导致血栓形成。在生理条件下,存在多种机制来维持凝血系统处于静止状态。在病理条件下开始血栓形成需要快速压倒调节性抗凝机制。然而,这些事件背后的生物学在很大程度上仍然未知。了解微调血栓形成的分子机制对于设计更精确的治疗策略非常重要。
血管损伤后蛋白二硫键异构酶(PDI)的分泌最近被认为是诱导血栓形成的关键起始信号。PDI是硫醇异构酶家族的原型成员,负责催化二硫键重排。PDI最初在内质网(ER)中发现,由活化的血管细胞分泌,并提议作为“主开关”修饰变构二硫键,这些键控制着血栓形成相关蛋白的功能。这已被公认为调节血小板活化和纤维蛋白生成的重要机制。此外,一项针对晚期癌症患者的临床试验表明,通过异槲皮素靶向细胞外 PDI 可减少凝血标志物,而不会引起重大出血事件。
然而,PDI调节血栓形成动力学的确切途径仍然未知。研究使用 PDI 变体进行了基于机制的动力学捕获,其中催化 CGHC 基序中的C末端半胱氨酸被Ala取代,与底物形成稳定的二硫键连接复合物,以便通过质谱法对其进行鉴定。HRG被鉴定为使用富血小板血浆的PDI氧化还原活性的底物。HRG 在凝血过程中表现出两种潜在功能:一方面,HRG 通过与FXIIa结合来抑制凝血的内在途径;另一方面,HRG 通过竞争与内皮HS的结合来减弱抗凝血酶的抗凝活性。该研究确定了PDI介导的二硫化物修饰对HRG功能的影响及其对血栓形成的影响。
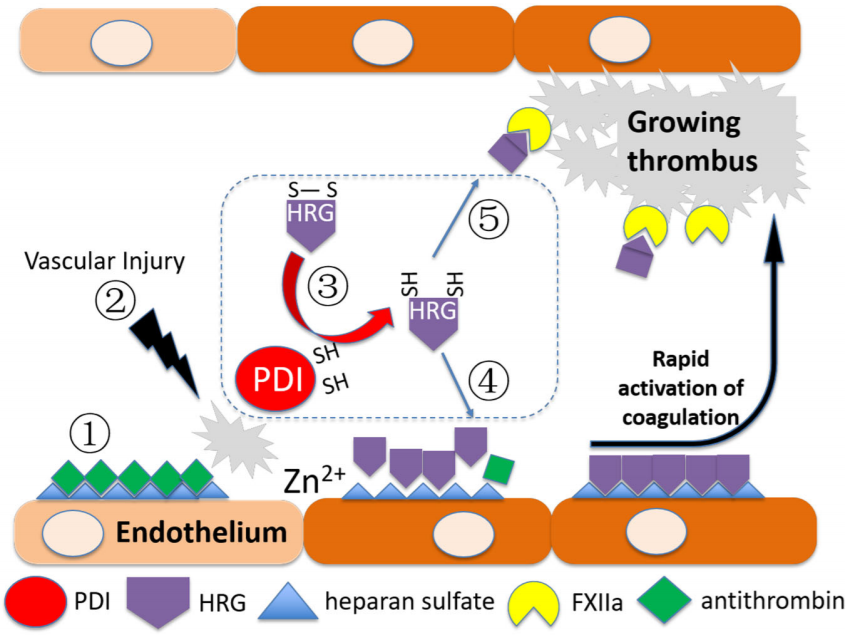
模式图(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


