Nature Biotechnology:基因快递车再升级!研究人员破解精准投递超大包裹的秘密
来源:生物探索 2025-03-23 10:07
当多个AAV进入同一细胞,它们的基因组会自发拼接成"分子拼图",让不同病毒携带的增强子(Enhancer)和启动子(Promoter)重新组合。
治疗基因的"快递车"竟然自带"拼单"功能?研究人员发现了一个颠覆认知的现象:当两种携带不同"导航系统"的腺相关病毒(AAV)进入大脑,它们竟会像拼图般组合基因片段,将原本4.7kb的运载极限瞬间突破——这种被命名为"转录串扰"(Transcriptional crosstalk)的机制,让AAV如同获得超能力的快递员,成功将CRISPR基因剪刀等"大件包裹"精准送达目标细胞。
过去三十年,基因治疗始终被"快递车太小"的魔咒困扰。即便最先进的工程化AAV,也只能运送相当于一本薄册子的基因片段,而治疗遗传性失明、渐冻症等疾病所需的"工具书"常常超重。研究人员尝试过各种"扩容方案",从压缩基因序列到拆分工具组件,但就像给火箭装自行车轮胎——要么动力不足,要么导航失灵。
直到3月20日这项登上《Nature Biotechnology》的研究“Spatial genomics of AAV vectors reveals mechanism of transcriptional crosstalk that enables targeted delivery of large genetic cargo”,揭示了病毒深藏的生存智慧:当多个AAV进入同一细胞,它们的基因组会自发拼接成"分子拼图",让不同病毒携带的增强子(Enhancer)和启动子(Promoter)重新组合。在实验中,这种天然机制使基因编辑效率飙升177倍,非目标组织的脱靶效应却暴跌97%。更惊人的是,普通小鼠仅需静脉注射就能实现特定脑细胞的精准编辑,这在过去需要耗时数月的转基因动物才能完成。
这项发现将起医学界的风暴。它不仅是实验室里的技术突破,更预示着未来单次注射治疗阿尔茨海默病、帕金森病的可能。当病毒教给人类"分装运输"的智慧,基因治疗的新纪元,或许就从这场微观世界的"拼单革命"开始。

基因治疗的"快递小哥"遇瓶颈
腺相关病毒(Adeno-associated virus, AAV)堪称最受欢迎的"基因快递员"。这种直径仅20纳米的病毒载体(Viral vector)既能穿越血脑屏障(Blood-brain barrier, BBB),又能长期稳定表达外源基因,目前已有多个AAV基因疗法获得FDA批准。但这位"快递小哥"有个致命弱点——它的"包裹容量"仅有4.7千碱基对(kb),这相当于只能运送一本薄薄的小册子,而像CRISPR-Cas9系统这样的"工具书"往往超过5kb。
传统解决方案就像给快递车装导航:在AAV基因组中加入特定增强子(Enhancer)来靶向特定细胞。比如小脑浦肯野细胞(Purkinje cells, PCs)专用的Ple155增强子,或是前脑中间神经元(Interneurons)专属的mDLX增强子。但问题在于,这些"导航系统"本身就要占据1-2kb的空间,留给治疗基因的位置更加捉襟见肘。
意外发现的"隔空对话"现象
研究团队在实验中观察到神奇现象:当携带Ple155增强子的绿色荧光病毒(EGFP)与携带mDLX增强子的红色荧光病毒(mRuby2)共同注射时,原本只在前脑活跃的红色荧光竟意外点亮了小脑浦肯野细胞!这种跨越不同病毒基因组的"对话"被命名为转录串扰(Transcriptional crosstalk)。
通过系统筛选11种不同脑区增强子,研究人员发现这种"隔空对话"具有普遍性:所有测试的增强子都能激活其他病毒上的最小启动子(minBG promoter)。例如皮质增强子mscRE4单独使用仅在前脑表达,但与Ple155病毒共注射时,其荧光强度在小脑提升了8.7倍。这种"借力使力"的机制,为突破AAV运载限制提供了全新思路。
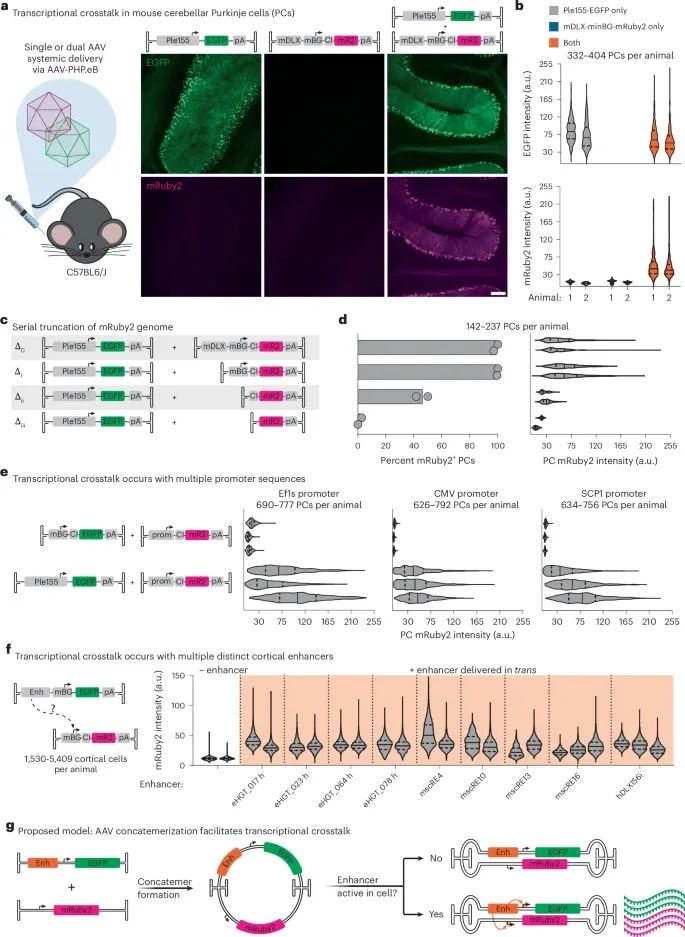
增强子和启动子在不同的AAV基因组中存在广泛的转录串扰(Credit: Nature Biotechnology)
破解"病毒拼图"的分子密码
要解开转录串扰之谜,传统检测手段力有不逮。研究团队创新开发了两种空间基因组学技术:AAV-Zombie能像"病毒CT"般在完整组织中定位单个AAV基因组;SpECTr技术则专门捕捉病毒基因的串联体(Concatemer)。
在神经元培养实验中,SpECTr首次动态展示了病毒基因组在细胞内的命运:注射后24小时内,超过60%的病毒DNA在细胞核内形成多聚体。这些串联体就像分子"拼图",将不同病毒上的增强子和启动子物理连接,重现了天然染色体上"增强子-启动子"互作的空间构象。当使用DNA修复缺陷的SCID小鼠(Prkdcscid/scid)时,串联体形成减少78%,转录串扰效率随之暴跌,直接验证了分子拼图假说。
改写基因的"细胞狙击枪"
利用这种天然机制,研究人员设计了分体式基因编辑系统:一个病毒携带Cas9核酸酶(3.2kb),另一个装载Ple155增强子。在小鼠实验中,这种"分体快递"成功实现了浦肯野细胞的精准编辑。相比传统方法,靶向细胞编辑效率提升177倍,而非目标组织(如肝脏)的脱靶效应降低97%。
更令人振奋的是,这种策略无需转基因动物配合。在野生型小鼠中,仅通过系统性注射(Systemic administration)就重现了Cacna1a基因敲除的经典表型:接受编辑的小鼠出现运动失调(Ataxia),在狭窄横梁测试中失误率增加3倍,步态分析显示四肢协调性下降62%。而通过EEG监测发现,传统全身编辑会引发癫痫样放电,但分体式系统将异常放电控制在基线水平,展现出卓越的安全性。
从实验室到临床的"破壁"意义
这项发现正在改写基因治疗的规则手册:
超大基因装载:将CRISPR激活系统(CRISPRa)、碱基编辑(Base editing)等"大块头"工具送入特定细胞
精准调控:通过组合不同增强子,实现器官-细胞层级的精细调控
非人灵长类突破:已有实验室用工程化AAV(AAV.CAP-B10)在猕猴脑内实现跨脑区编辑
临床转化捷径:避免繁琐的转基因动物制备,直接使用普通实验动物
更令人期待的是,配合新开发的BBB穿透型AAV(如PHP.eB),未来或可实现单次注射治疗多脑区疾病。
改写生命密码的"安全锁"
任何基因治疗都需警惕脱靶风险。该研究通过多重保障提升安全性:
分子隔离:将核酸酶与调控元件分装不同病毒,降低意外激活
时空控制:结合光控元件(如PhyB-PIF系统),实现光开关调控
双重靶向:同时利用组织特异性衣壳(Capsid)和增强子
动态监测:AAV-Zombie技术可实时追踪病毒在器官间的分布
在肝脏这一常见脱靶器官中,分体式系统的Cas9活性仅为传统方法的3%。这种"细胞类型双因子认证"机制,为临床转化筑起安全防线。
未来:基因治疗的星辰大海
站在这个突破的节点回望,从1995年首例AAV临床试验到如今,基因治疗已走过近30年历程。该研究揭示的转录串扰机制,不仅解开了AAV生物学的关键谜题,更打开了精准医学的新维度:
神经系统疾病:渐冻症(ALS)的运动神经元靶向修复
代谢疾病:肝细胞特异性纠正苯丙酮尿症
癌症治疗:在肿瘤微环境特异性激活免疫调节基因
衰老干预:选择性清除衰老细胞
我们正在见证基因治疗从“地毯式轰炸”转向“激光制导”的范式变革。当研究人员的智慧与病毒的天然智慧相遇,改写生命密码的钥匙,正在开启无限可能。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


