干细胞治疗糖尿病新突破:邓宏魁团队首次实现利用人iPSC制备内分泌细胞类型完备具有低血糖防护功能的胰岛
来源:生物世界 2025-08-10 09:49
该研究首次利用人多能干细胞(iPSC)成功分化构建了内分泌细胞类型完备的胰岛。
多能干细胞来源的胰岛(PSC-胰岛)移植,其中包含有功能的生成胰岛素的 β 细胞,为糖尿病患者恢复血糖控制提供了有前景的细胞疗法。
2024 年 9 月,北京大学邓宏魁团队等在 Cell 期刊发表论文,通过移植化学重编程多能干细胞分化来源的胰岛(CiPSC-胰岛)成功治疗了一名1型糖尿病(T1D)患者,该患者在 1 年随访中不再需要外源胰岛素治疗,且恢复了血糖控制。
然而,PSC-胰岛中完整内分泌成分的再生成仍具挑战性,其对抗危险低血糖的能力(这对体内代谢安全至关重要)也尚未得到探索。

在这项最新研究中,研究团队报告了在体外生成非 β 细胞的可靠方法,通过将非 β 细胞和 β 细胞整合,实现了由所有五种(α、β、δ、ε 和 γ)内分泌亚型组成的多能干细胞来源的胰岛(PSC-胰岛)的重建。
在糖尿病小鼠模型中逆转高血糖后,这些内分泌细胞类型完备的胰岛对低血糖表现出强大的保护作用,仅有 3% 的测量值低于 54 毫克/分升,而对照组则有 59%。值得注意的是,低血糖钳夹试验表明,在接受内分泌细胞类型完备的胰岛移植的受体中,先前有缺陷的反向调节反应得到了恢复。
该研究的亮点:
-
由多能干细胞重建的胰岛包含所有五种内分泌亚型;
-
这些胰岛的移植重现了双向血糖调节;
-
通过平衡 β 细胞和非 β 细胞的内分泌成分增强了低血糖保护作用;
-
糖尿病小鼠受体的缺陷性反向调节反应得以恢复。
这些发现确立了一种控制 PSC-胰岛中内分泌亚型相对丰度的策略,为胰岛移植后血糖稳态的校准以及明确的低血糖防护提供了基础。
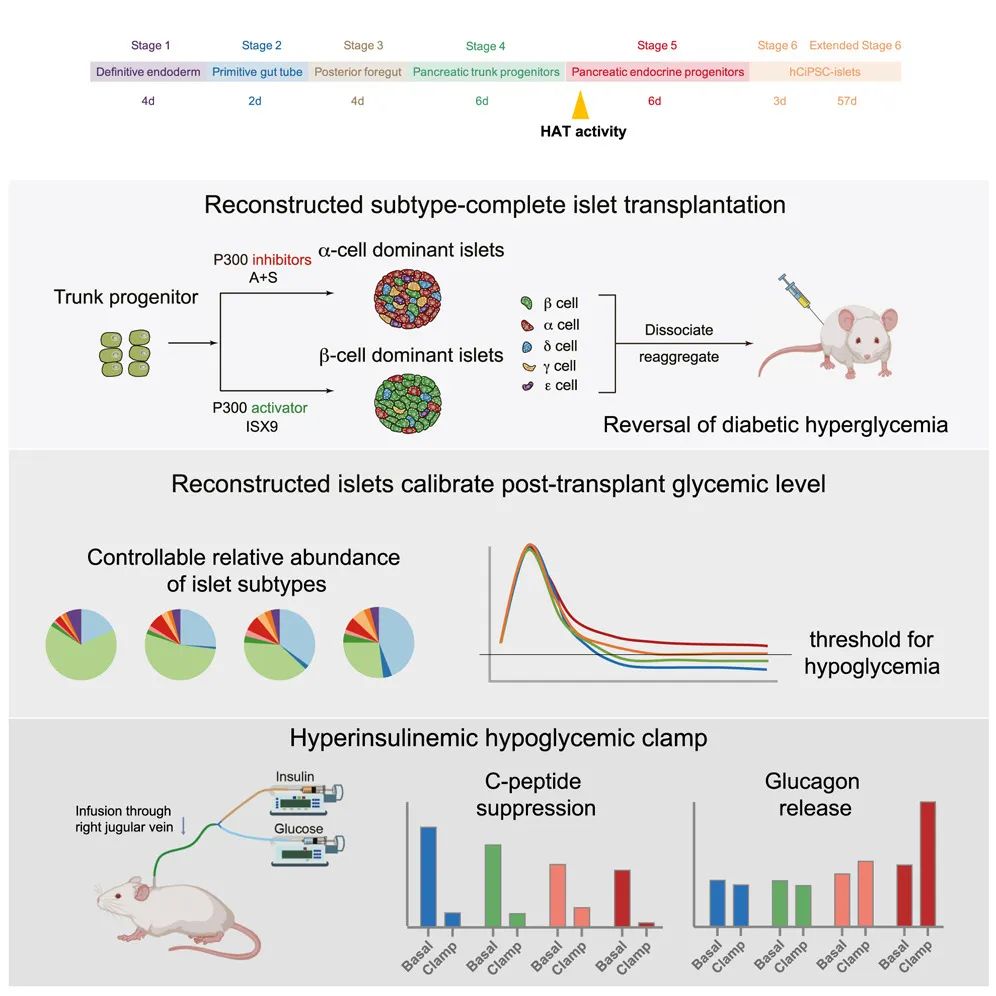
总的来说,该研究基于人多能干细胞建立了首个可精确调控五种内分泌细胞比例的胰岛制备体系,实现了通过工程化定制胰岛细胞组成,重现天然胰岛的双向血糖调控功能,为移植后实现精准血糖稳态调控、避免低血糖风险奠定了基础。这一进展为干细胞来源胰岛的临床转化提供了进一步的安全保障,有助于加速糖尿病细胞治疗的临床应用进程。
北京大学/杭州瑞普晨创孟高帆、顾佳斌、廖顺意和曹靖宵为该论文共同第一作者;北京大学邓宏魁教授、孟高帆博士为论文共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


