巨细胞病毒(CMV)新药!武田maribavir获美国FDA优先审查:将重新定义移植受者CMV感染/疾病治疗!
maribavir疗效优于常规疗法,安全性更高。在中国,maribavir已获批启动临床试验,治疗CMV感染或疾病。
Nat Commun: 研究揭示分歧杆菌感染过程中多核巨细胞的形成机制
由分枝杆菌(mycobacteria)感染引发的免疫反应其特征是肉芽肿的形成,其中包含一种独特的巨噬细胞类型——“多核巨细胞(multinucleated giant cells)”。此前研究发现,多核巨细胞(MGC)的形成依赖于Toll样受体激活引发的DNA损伤以及细胞周期的调整。然而,这类特殊巨噬细胞的形成来源,或者说其前体细胞的身份目前扔不清除。在最近
巨细胞病毒(CMV)新药!武田maribavir 3期临床成功:将重新定义移植受者CMV感染/疾病治疗!
maribavir疗效优于常规疗法,安全性更高。在中国,maribavir已获批启动临床试验,治疗CMV感染或疾病。
JCI:让免疫细胞发现病毒!科学家开发出一种靶向狙杀人类巨细胞病毒的新疗法!
2021年2月20日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Journal of Clinical Investigation上的研究报告中,来自卡迪夫大学等机构的科学家们通过研究发现了一种靶向作用常见病毒(人类巨细胞病毒)的特殊方法,这种病毒在英国影响着1/200新生儿的健康,但目前仅有非常有限的治疗手段。人类巨细胞病毒(HCMV,Huma
武田maribavir 3期临床成功:将重新定义移植受者巨细胞病毒(CMV)感染/疾病治疗!
maribavir疗效优于常规疗法,安全性更高。在中国,maribavir于2020年4月获得临床试验默示许可,用于治疗CMV感染或疾病。
首个腱鞘巨细胞瘤药物!第一三共新型口服CSF1R抑制剂pexidartinib遭欧盟CHMP否决!
在美国,pexidartinib正在接受FDA优先审查,该药有潜力成为第一个治疗存在严重的发病率或功能限制且不适合手术改善的有症状腱鞘巨细胞瘤(TGCT)的药物。
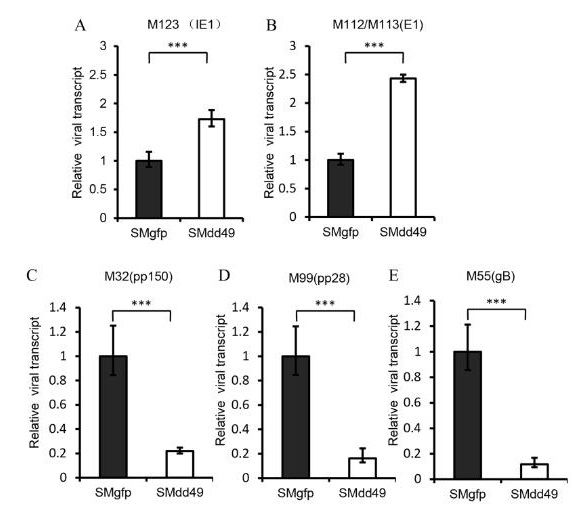
研究揭示新小鼠巨细胞病毒转录激活因子在病毒晚期蛋白表达中的作用机制
2020年1月2日,病毒学期刊Journal of Virology 在线发表了中国科学院上海巴斯德研究所钱志康课题组的最新研究“Murine Cytomegalovirus Protein pM49 Interacts with pM95 and Is Critical for Viral Late Gene Expression”
首款腱鞘巨细胞瘤药物批准上市 且看靶点CSF1R竞争格局
2019年8月2日获美国食品药品监督管理局(FDA)批准Pexidartinib上市,用于治疗功能受限且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者。Pexidartinib是该疾病的首款获批药物。Pexidartinib是一种集落刺激因子1受体(CSF1R)抑制剂,开发该靶点的领头企业有辉瑞、诺华等,代表药物有苹果酸舒尼替尼等,CSF1R药物2018年的销售额接近两亿美元.
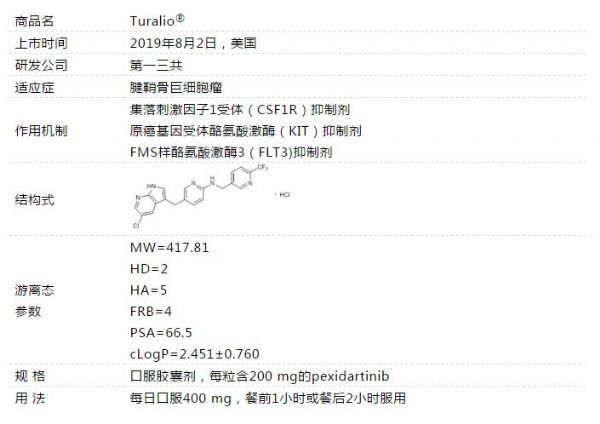
美国FDA批准第一三共新型CSF1R抑制剂Turalio,治疗腱鞘巨细胞瘤!
2019年08月03日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)靶向抗癌药Turalio(pexidartinib胶囊剂)近日喜获美国食品和药物管理局(FDA)批准,用于存在严重的发病率或功能限制且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者的治疗。TGCT是一种罕见的肿瘤,影响滑膜和肌腱鞘,该肿瘤很少有恶性的,但会导致滑膜和肌腱鞘增厚或过度生长,对周
首个腱鞘巨细胞瘤药物!第一三共新型口服CSF1R抑制剂pexidartinib在美欧进入审查
2019年4月08日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,欧洲药品管理局(EMA)已受理pexidartinib的上市许可申请(MAA)。该MAA申请批准pexidartinib用于存在严重的发病率或功能限制且不适合手术改善的有症状腱鞘巨细胞瘤(TGCT)成人患者的治疗。之前,EMA已授予pexidartinib治疗TGCT的孤儿药资格。在美国,F