巨细胞病毒(CMV)新药!武田maribavir获美国FDA优先审查:将重新定义移植受者CMV感染/疾病治疗!
来源:本站原创 2021-05-22 19:15
maribavir疗效优于常规疗法,安全性更高。在中国,maribavir已获批启动临床试验,治疗CMV感染或疾病。

2021年05月22日讯 /生物谷BIOON/ --武田制药(Takeda)近日宣布,美国食品和药物管理局(FDA)已受理抗病毒药物maribavir(TAK-620)的新药申请(NDA)并授予了优先审查,该药用于实体器官移植(SOT)或造血细胞移植(HCT)受者,治疗难治性、有或无耐药性(R/R)巨细胞病毒(CMV)感染。如果获得批准,maribavir将成为第一个也是唯一一个用于移植受者治疗移植后R/R CMV感染的药物。
CMV是β疱疹病毒亚科的DNA病毒,具有高度的种属特异性,人类是人巨细胞病毒(HCMV)的唯一宿主。CMV是一种常见的病毒,可感染所有年龄段的人群。到40岁时,超过一半的成年人已经感染CMV,大多数没有相关症状和体征。然而,在免疫力低下(包括器官或干细胞移植受者)的人群中,CMV感染是一种严重的临床并发症,可导致组织侵入性疾病,并最终致命。现有的抗病毒疗法可用于治疗CMV,但这些疗法可能因副作用和/或耐药性而应用受限。
maribavir是一种口服生物可利用的抗巨细胞病毒(CMV)化合物,是目前唯一一种处于3期临床开发、在实体器官移植(SOT)或造血细胞移植(HCT)中用于治疗移植后患者CMV感染/疾病的抗病毒药物。maribavir是唯一一种针对和抑制UL97蛋白激酶及其天然底物的CMV抗病毒药物。目前的CMV管理与艰难的权衡有关,包括毒性和病毒血症清除的管理。如果获得批准,maribavir将有潜力重新定义移植后难治性CMV的治疗方法,不管有无耐药性。
maribavir NDA基于关键3期TAK-620-303(SOLSTICE,NCT02931539)试验,其主要结果于今年2月在2021年移植与细胞治疗(TCT)会议上公布,亚组分析结果于今年3月在2021年欧洲血液和骨髓移植学会(EBMT)第47届年会上公布。主要结果显示,maribavir与常规抗病毒治疗(IAT)相比疗效具有优越性,达到了研究的主要终点和关键次要终点。此外,maribavir与常规抗病毒治疗相比,治疗相关毒性更低。亚组分析结果,支持了在整个随机人群中的疗效结果。
武田副总裁兼maribavir全球项目负责人Obi Umeh医学博士表示:“CMV是移植受者最常见的病毒感染之一,目前抗病毒治疗的选择有限,医生必须在病毒清除和副作用管理之间保持谨慎的平衡,这可能会影响患者护理和移植结果。此次FDA受理NDA,是maribavir项目向前推进的一个重要里程碑。如果获得批准,maribavir有潜力改变移植后CMV的治疗格局。”
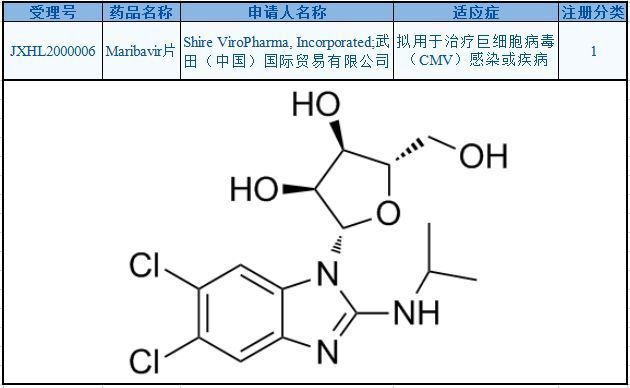
maribavir分子结构式
TAK-620-303研究在难治性、有或无耐药性(R/R)的巨细胞病毒(CMV)感染/疾病的移植受者中开展,将在研抗病毒药物TAK-620(maribavir)与常规抗病毒药物(研究人员指定的治疗[IAT],以下一种或多种药物的组合:更昔洛韦[ganciclovir]、缬更昔洛韦[valganciclovir]、膦甲酸[foscarnet]、西多福韦[cidofovir])进行了对比。该研究的主要终点是治疗第8周(治疗期结束)确认的CMV病毒血症清除率,关键次要终点是CMV清除率和症状控制维持至第16周。
来自整个试验人群的研究结果表明:maribavir在研究第8周时在CMV病毒血症清除率方面优于常规抗病毒疗法。具体而言:在研究第8周,接受抗病毒治疗、有或无耐药性(R/R)、CMV疾病/感染的移植受者中,实现确认的CMV病毒血症清除的患者比例方面,maribavir治疗组(55.7%,n=131/235)是常规治疗组(23.9%,n=28/117)的2倍以上(调整后的差异[95%CI]:32.8%[22.8-42.7];p<0.001)。
亚组分析的数据显示:在基线检查时确认为基因型耐药CMV感染的移植受者中,研究第8周时(治疗期结束时)实现确认的CMV病毒血症清除的患者比例,maribavir治疗组(62.8%,76/121)是IAT治疗组(20.3%,14/69)的3倍以上(调整后的差异[95%CI]:44.1%[31.3,56.9])。
该研究中,接受maribavir治疗的移植受者表现出较低的治疗相关毒性发生率,而这些毒性在常规抗病毒治疗中很常见。具体而言,接受maribavir治疗的移植受者,与缬更昔洛韦/更昔洛韦治疗的移植受者相比治疗相关中性粒细胞减少症的发生率更低(1.7%[4/234] vs 25%[14/56])、与膦甲酸治疗的移植受者相比治疗相关急性肾损伤的发生率更低(1.7%[4/234] vs 19.1[9/47])。maribavir组和常规治疗组中任何级别治疗期间出现的不良事件(TEAE)发生率分别为97.4%(228/234)和91.4%(106/116)。maribavir组最常见的TEAE为味觉障碍(35.9%,84/234)、恶心(8.5%,20/234)和呕吐(7.7%),maribavir组和常规治疗组导致研究药物停药的TEAE发生率分别为13.2%(31/234)和31.9%(37/116)。发生2例治疗相关严重TEAE导致的死亡(每个治疗组1例)。
CMV(图片来源:std-gov.org)
巨细胞病毒(CMV)是一种β疱疹病毒,通常感染人类;40%-100%的成年人群中有先前感染的血清学证据。CMV通常在体内潜伏且无症状,但在免疫抑制期间可能重新激活。免疫系统受损的个体可能会发生严重疾病,其中包括接受与造血细胞移植(HCT)或实体器官移植(SOT)等各种移植相关的免疫抑制剂的患者。在每年估计的20万例成人移植中,CMV是移植受者最常见的病毒感染之一,估计SOT移植受者中的发生率为16-56%,HCT移植受者中的发生率为30-70%。在移植受者中,CMV的重新激活可能导致严重后果,包括移植器官的丧失,在极端情况下,可能是致命的。治疗移植后CMV感染的现有疗法可能显示出严重的副作用,需要调整剂量或不能充分抑制病毒复制。此外,现有疗法可能需要或延长因给药而住院的时间。
maribavir属于名为苯并咪唑核苷的一类药物,可靶向抑制CMV的UL97蛋白激酶,从而潜在影响CMV复制的几个关键过程,包括病毒DNA复制、病毒基因表达、衣壳化以及成熟衣壳从受感染细胞的细胞核中逃逸。
maribavir是一种口服可生物利用的抗病毒疗法,目前正处于III期临床开发,评估在伴有CMV感染且对当前标准的CMV治疗药物耐药或难治的造血干细胞移植(HSCT)或实体器官移植(SOT)受者中的治疗潜力。目前,maribavir尚未获得任何国家批准。在美国和欧盟,maribavir均已被授予用于高危患者群体治疗临床严重CMV病毒血症以及用于免疫受损患者治疗CMV疾病的孤儿药资格(ODD)。在美国,maribavir还被授予了突破性药物资格(BTD),用于移植受者治疗对先前疗法有抵抗力或难治性的CMV感染。在中国,maribavir于2020年4月获得临床试验默示许可,开发适应症为:用于治疗CMV感染或疾病。(生物谷Bioon.com)
原文出处:US Food & Drug Administration Grants Priority Review of Maribavir for the Treatment of Post-Transplant Recipients With Cytomegalovirus Infection in Those Resistant and/or Refractory to Prior Anti-CMV Treatment
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


