艾尔建Vraylar(卡利拉嗪)治疗双相I型障碍抑郁发作在美国进入正式审查
2018年09月27日讯 /生物谷BIOON/ --艾尔建(Allergan)近日宣布,美国FDA已受理新型抗精神病药物Vraylar(cariprazine,卡利拉嗪)的一份补充新药申请(sNDA),该申请寻求批准扩大Vraylar的适应症,用于成人患者治疗双相I型障碍(双相抑郁症)相关的抑郁发作。该sNDA的提交,是基于3项关键性临床研究(RGH-MD-53、RGH-MD-54、RGH-MD-
Eylea治疗糖尿病视网膜病变在美正式审查
再生元(Regeneron)近日宣布,美国食品和药物管理局(FDA)已受理眼科药物Eylea(aflibercept,阿柏西普注射液)治疗糖尿病视网膜病变(DR)的补充生物制品许可(sBLA),并已指定处方药用户收费法(PDUFA)日期为2019年5月13日。此次sBLA的提交是基于III期临床研究PANORAMA的结果。该研究是一项正在进行的关键性、双盲、随机、两年期研究,纳入了402例中度至重
默沙东Keytruda单药一线治疗PD-L1阳性肺癌斩获美国FDA优先审查资格,患者池将扩张3倍
2018年09月13日讯 /生物谷BIOON/ --肿瘤免疫治疗巨头默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理PD-1肿瘤免疫疗法Keytruda(pembrolizumab,帕博利珠单抗)的一份新的生物制品许可申请(sBLA)并授予了优先审查资格。该sBLA旨在寻求批准Keytruda作为一种单药疗法一线治疗肿瘤表达PD-L1(TPS≥1%)且无EGFR
Soliris升级版产品ALXN1210在美国进入优先审查,将成首个长效补体抑制剂
2018年08月21日讯 /生物谷BIOON/ --Alexion是一家致力于罕见病新药研发的美国制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已受理ALXN1210治疗阵发性睡眠性血红蛋白尿(PNH)的生物制品许可申请(BLA),并将进行优先审查。今年6月,Alexion向FDA递交BLA的同时,也递交了一张优先审评券,该券可加速ALXN1210的审查周期,由标准的12个月审查时间缩
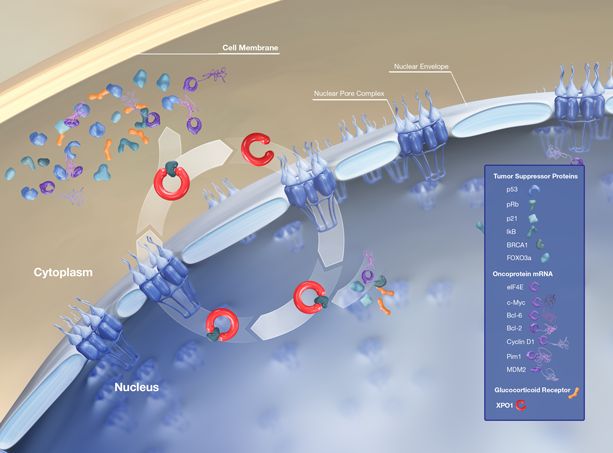
全球首个XPO1抑制剂selinexor进入监管审查
2018年7月24日讯 /生物谷BIOON/ --Karyopharm Therapeutics是一家临床阶段的制药公司,专注于发现和开发针对核转运及相关靶标的首创新型疗法,用于治疗癌症及其他重大疾病。近日,该公司宣布,已启动向美国FDA滚动提交selinexor的新药申请(NDA),这是一种新型口服SINE化合物,用于对5种现有疗法耐药的高度难治性多发性骨髓瘤(MM)患者的治疗。Karyopha
美国FDA授予默沙东免疫疗法Keytruda优先审查资格
2018年7月3日讯 /生物谷BIOON/ --肿瘤免疫治疗巨头默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理PD-1免疫疗法Keytruda(pembrolizumab)的一份补充生物制品许可(sBLA)并授予了优先审查资格,其处方药用户收费法(PDUFA)目标日期为2018年10月30日。该sBLA旨在申请加速批准Keytruda联合化疗(卡铂与紫杉醇或白
黑色素生成药Scenesse在美国进入审查,治疗光敏性皮肤病
2018年6月27日讯 /生物谷BIOON/ --澳大利亚制药公司Clinuvel近日宣布,已向美国FDA提交了Scenesse(afamelanotide,16mg)一线治疗红细胞生成性原卟啉症(EPP)患者提供系统性光保护作用以预防光毒性的新药申请(NDA)。EPP是一种罕见的血液疾病,因血液中存在过量原卟啉产生光敏性皮肤损害。EPP是一种皮肤惧光症,患者不能见光,在暴露于太阳光或人工光照后会
默沙东肿瘤免疫疗法Keytruda辅助治疗晚期黑色素瘤在美进入正式审查
2018年6月26日讯 /生物谷BIOON/ --肿瘤免疫治疗巨头默沙东(Merck & Co)近日宣布,美国FDA已受理PD-1免疫疗法Keytruda(pembrolizumab)的一份补充生物制品许可(sBLA),并指定处方药用户收费法(PDUFA)日期为2019年2月16日。此次sBLA,寻求批准Keytruda作为一种辅助疗法,用于已手术切除的、高风险3期黑色素瘤患者的治疗。此次
辉瑞glasdegib被美国FDA授予优先审查,一线治疗急性髓性白血病(AML)
2018年6月27日讯 /生物谷BIOON/ --制药巨头辉瑞(Pfizer)近日宣布,美国FDA已受理靶向药物glasdegib的新药申请(NDA)并授予了优先审查资格,其处方药用户收费法(PDUFA)目标日期为2018年12月。该药是一种实验性口服Smoothened蛋白(SMO)抑制剂,目前正被评估联合低剂量阿糖胞苷(LDAC)化疗,用于既往未接受治疗的(初治)急性髓性白血病(AML)成人患
艾伯维重磅血癌药Imbruvica联合美罗华治疗华氏巨球蛋白血症(WM)在美进入审查
2018年6月26日讯 /生物谷BIOON/ --美国生物技术巨头艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已受理了靶向抗癌药Imbruvica(ibrutinib,依鲁替尼)的一份补充新药申请(sNDA)并授予了优先审查资格。该sNDA寻求批准Imbruvica联合罗氏抗癌药美罗华(Rituxan,通用名:rituximab,利妥昔单抗)治疗华氏巨球蛋白血症(WM)。如果获批