首款复发性心包炎药物获FDA批准上市
Kiniksa公司宣布,美国食品和药物管理局(FDA)已批准该公司开发的重组融合蛋白ARCALYST (rilonacept) 上市,每周皮下注射1次,用于治疗12岁及以上儿童和成人患者复发性心包炎和降低心包炎复发风险。rilonacept是FDA批准的首个治疗复发性心包炎的药物。复发性心包炎是一种疼痛性自身炎症性心血管疾病,典型表现为胸痛,通常与心电传导改
FDA批准Zegalogue注射剂治疗严重低血糖症的糖尿病患者
日前,Zealand Pharma宣布,美国FDA已批准Zegalogue(dasiglucagon)注射剂用于治疗6岁及以上的小儿和成年糖尿病患者的严重低血糖症。FDA批准Zegalogue主要是基于在6至17岁儿童和成人1型糖尿病患者中进行的3项随机、双盲、安慰剂对照的多中心3期研究的功效结果。所有研究的主要疗效终点是血糖水平恢复
泰诺麦博TNM002单抗成功获美国FDA批准IND
3月16日,珠海泰诺麦博生物技术有限公司(Trinomab Biotechnology Co., Ltd.,简称“泰诺麦博”及“Trinomab”)宣布,其自主研发的重组抗破伤风毒素单抗药物TNM002的临床试验申请(IND)正式获得美国食品药品管理局(FDA)批准,这是继2020年11月获得澳洲HREC/TGA批准后的又一次临床申请
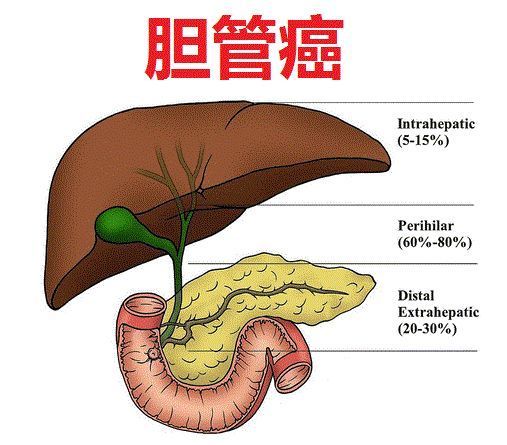
强效FGFR激酶抑制剂Pemazyre(pemigatinib)获日本批准,信达生物引进中国!
信达生物拥有大中华区权利,Pemazyre是第一个获批治疗胆管癌的靶向药物,通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散
百时美施贵宝Abecma(ide-cel)获美国FDA批准:治疗多发性骨髓瘤!
Abecma是全球第一个获得监管批准的BCMA导向CAR-T细胞疗法。葛兰素史克Blenrep于2020年8月获批,是全球第一个BCMA靶向疗法。
恩华药业的1类化学药品NH102盐酸盐片获批临床
3月15日,恩华药业发公告称,于近日收到NMPA核准签发的1类化学药品NH102盐酸盐片3个规格的《药物临床试验批准通知书》,并将于近期开展临床试验。NH102盐酸盐是5-羟色胺及去甲肾上腺素双重再摄取抑制剂(SNRIs),同时对多巴胺转运体(DAT)及5-HT2A受体具有中等程度的抑制活性,是一个多靶点的新型抗抑郁药。临床前试验结果