安进单克隆抗体Xgeva扩大适应症获批
安进公司近日宣布,美国食品和药物监督管理局(FDA)已批准XGEVA(denosumab)的补充生物制剂许可证申请(sBLA),扩大当前Xgeva预防实体瘤患者骨骼相关事件(SREs)的适应症,纳入多发性骨髓瘤(MM)患者。这2份申请文件中纳入的新数据来自于关键性头对头III期临床研究Study 482的积极数据,该研究是迄今为止在MM患者群体中开展的最大规模的国际性临床研究。据估计,超过95%的
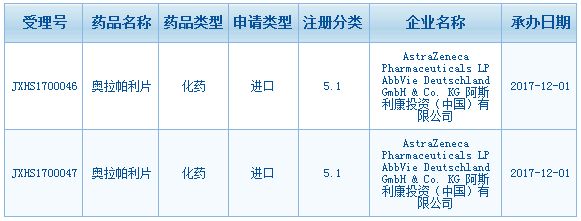
FDA批准奥拉帕利乳腺癌新适应症
阿斯利康1月12日宣布,FDA批准了Lynparza(olaparib)的新适应症,用于治疗携带BRCA突变的HER2-转移性乳腺癌。这是PARP抑制剂首次获批用于治疗乳腺癌。FDA同时批准了Lynparza的伴随诊断检测——BRACAnalysis CDx,包括检测乳腺癌患者血液样本中的BRCA突变,用于筛选适合采用Lynparza治疗的患者。该产品来自Myriad Genetic Labora
亚盛医药原创新靶点IAP抑制剂乙型肝炎适应症获CFDA临床批件
1月8日,原创新药研发公司亚盛医药今日宣布,公司已收到中国食品药品监督管理局核发的新型小分子IAP抑制剂APG-1387针对乙型肝炎适应症的新药临床批件。APG-1387将是中国首个、全球领先进入临床的用于治疗乙肝的IAP抑制剂。APG-1387是亚盛医药自主设计开发的、具有全球知识产权的新一代凋亡蛋白抑制因子(IAP)高效特异性抑制剂,主要通过模拟内源性Smac分子降解IAPs来诱导和加速细胞凋
辰欣药业盐酸右美托咪定注射液增加适应症临床获批
1月3日,辰欣药业股份有限公司(以下简称“辰欣药业”)发布公告称,收到国家食品药品监督管理总局(CFDA)核准签发的《药物临床试验批件》(批件号:2017L05115、2017L05116)。药物具体情况如下:药品名称:盐酸右美托咪定注射液药品批准文号:国药准字H20130027;国药准字H20163388;剂型:注射剂规格:(1)2ml:0.2mg(按右美托咪定计);(2)1ml:0.1mg(按
金城医药注射用头孢西丁钠适应症扩展获批
12月20日,山东金城医药集团股份有限公司(简称“金城医药”)发布公告称,其控股子公司广东金城金素制药有限公司(金城金素)于近日收到国家食品药品监督管理总局(CFDA)签发的《药品补充申请批件》。根据《中华人民共和国药品管理法》及有关规定,经CFDA审批,金城金素申请的注射用头孢西丁钠符合药品注册的有关要求,批准说明书修订的补充申请。在原适应症的基础上,注射用头孢西丁钠参照美国 FDA 橙皮书原研
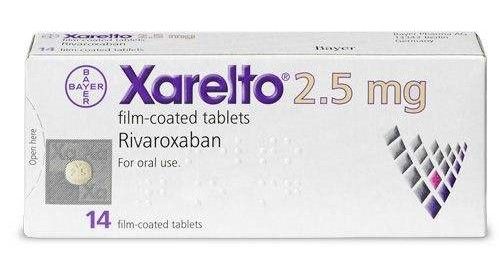
拜耳和强生提交利伐沙班CAD/PAD新适应症
德国拜耳与合作伙伴美国强生近日联合宣布,双方已向美国食品和药物管理局(FDA)提交了口服抗凝血剂Xarelto(品牌名:拜瑞妥,通用名:rivaroxaban,利伐沙班)的一份补充新药申请(sNDA)。该sNDA寻求FDA批准利伐沙班(2.5mg,每日2次)联合低剂量阿司匹林(100mg,每日一次),用于2个新的适应症:(1)用于冠状动脉和/或外周动脉疾病(CAD/PAD)患者,降低主要不良心血管
GSK肺病新药递交补充申请 扩大适应症范围
葛兰素史克(GSK)与其合作伙伴Innoviva近日宣布,向美国FDA提交了补充性新药申请(sNDA),扩大Trelegy Ellipta(fluticasone furoate/umeclidinium/vilanterol,FF / UMEC / VI)的适应症范围,用于维持治疗慢性阻塞性肺疾病(COPD)患者的气流阻塞和减轻恶化。对sNDA的批准将意味着医生可以使用FF / UM
第5个适应症!强生向美国FDA提交靶向抗癌药Darzalex一线治疗多发性骨髓瘤(MM)申请
2017年11月22日/生物谷BIOON/--美国医药巨头强生(JNJ)旗下杨森生物科技公司近日宣布,已向美国食品和药物管理局(FDA)提交了靶向抗癌药Darzalex(daratumumab)的一份补充生物制品许可(sBLA)。该sBLA目的是寻求扩大Darzalex现有的适应症,将Darzalex联合硼替佐米(bortezomib,一种蛋白酶体抑制剂[PI])、马法兰(melpha
异体CAR-T疗法UCART123拓展AML和BPDCN治疗适应症临床研究获FDA支持
2017年11月13日讯 /生物谷BIOON/ --11月6日,致力于异体CAR-T疗法开发的Cellectis公司宣布,FDA允许在研CAR-T疗法UCART123的临床试验继续开展,同时还扩展了该疗法治疗急性骨髓性白血病(AML)以及母细胞性浆细胞样树突细胞肿瘤(BPDCN)的临床试验。UCART123是一款区别于传统自体CAR-T疗法的通用型CAR-T疗法。在传统CAR-T疗法中,研发人员首
诺华提交自家CAR-T疗法第二个适应症上市申请
10月31日,瑞士诺华制药称,公司已经向美国FDA提交了CAR-T疗法Kymriah (tisagenlecleucel)(前代号为CTL019)用于不适于接受自体干细胞移植的复发/难治弥漫性大B细胞淋巴瘤(DLBCL)成人患者治疗的补充新药申请(sBLA)。在今年4月,诺华该药物用于复发/难治DLBCL已经获得FDA突破性疗法认定,该适应症获批后将是Kymriah的第二个获得批准的适