国家药监局药审中心发布皮肤外用化学仿制药研究技术指导原则
3月16日,国家药品监督管理局药审中心为指导我国皮肤外用化学仿制药研发,提供可参考的技术标准,组织制定了《皮肤外用化学仿制药研究技术指导原则(试行)》。经国家药品监督管理局审查同意,现予发布,自发布之日起施行。原文如下:国家药监局药审中心关于发布《皮肤外用化学仿制药研究技术指导原则(试行)》的通告(2021年第23号)发布日期:202
用中国医保惠民价,享国际品质抗癌药 ——新版国家医保目录正式启用
2021年3月1日,备受瞩目的2020年国家医保目录正式启用,此次共有119种药品通过谈判成功进入目录,其中包括三款国产PD-1单抗。据悉,由百济神州自主研发的PD-1单抗百泽安(替雷利珠单抗注射液)医保报销前的新价格低至2,180元/支(100mg),价格降幅高达80%,年治疗费用仅不到7.5万元,符合医保报销适应症的患者年治疗负担更低。此次国
抗真菌药!Basilea/辉瑞Cresemba(艾沙康唑)获国家药监局受理,治疗侵袭性曲霉菌病!
isavuconazole是一种静脉和口服唑类抗真菌药物,用于治疗毛霉菌病和曲霉菌病。
国家药监局发文 化药注射剂一致性评价正式启动
5月14日,国家药监局发布《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》。相关解读如下:一、《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》出台的背景是什么?答:为贯彻落实国务院关于加快推进仿制药一致性评价的工作部署,国家药监局仿制药一致性评价办公室组织专家委员会制定了《化学药品注射剂仿制药质量和疗效一致性评
国家药品监督管理局(NMPA)受理同类首创胃肠道间质瘤精准靶向药avapritinib的两个适应症上市申请
2020年4月23日,基石药业(苏州)有限公司(以下简称“基石药业”,香港联交所代码:2616)宣布,国家药品监督管理局(NMPA)已受理胃肠道间质瘤(GIST)精准靶向药物avapritinib的新药上市申请,涵盖两个适应症,分别为用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性G
绿叶制药抗肿瘤生物药-贝伐珠单抗注射液LY01008上市申请获国家药监局受理!
2020年04月19日讯 /生物谷BIOON/ --绿叶制药集团(luye Pharma)近日宣布,其抗肿瘤生物药LY01008(通用名:贝伐珠单抗注射液)的上市申请已获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理。LY01008是罗氏王牌生物制剂安维汀®(Avastin®,通用名:bevacizumab,贝伐珠单抗注射
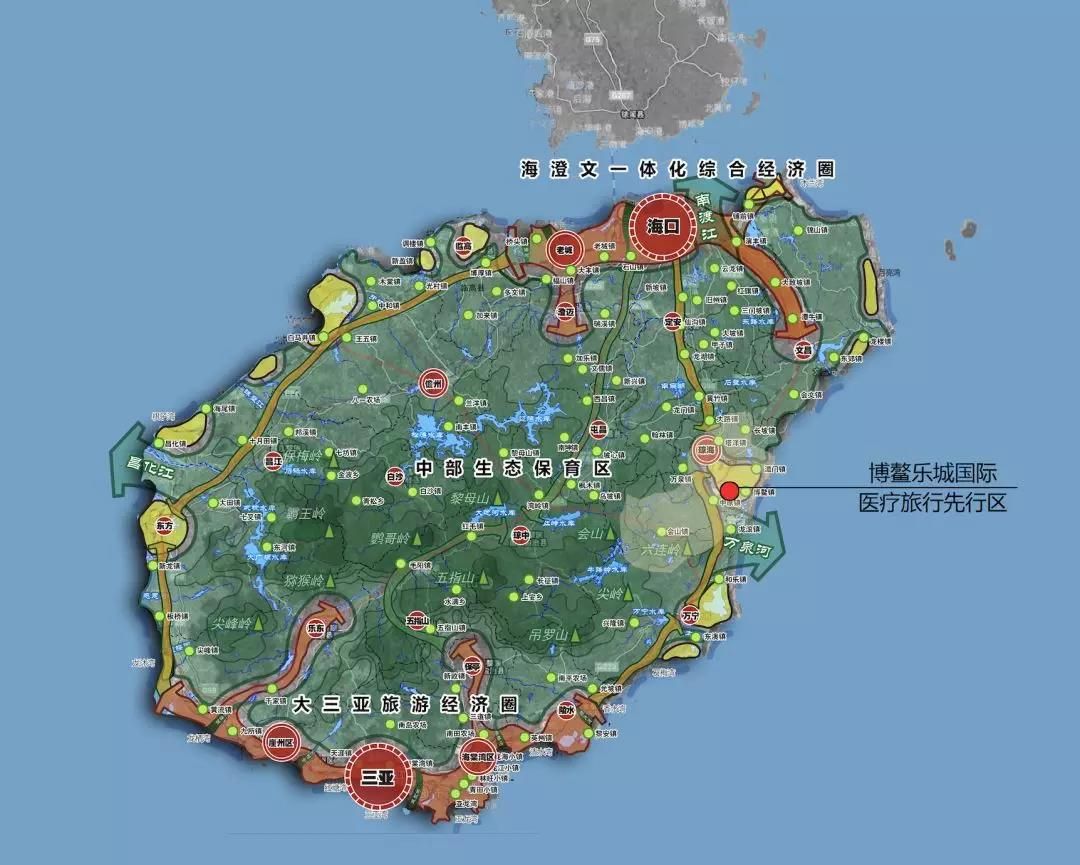
博鳌乐城公布最新运营数据 将卫健、药监机构合并
2019年,博鳌乐城预计接待医疗旅游人数约7.5万人次,同比增长134%;医疗机构营业收入约6.4亿元,同比增长75%。一家县医院都有几十万病人,先行区怎么才几万?先行区进展一度有些缓慢,但2019年8月,新的马达开动了。2019年7月底前,两年时间创造14个“全国首例”新药新械的使用,8月开始,5个月新增37个。1月11日,先行区医疗药品监督管
国家卫健委发文 这些药被点名重点监测
国家卫健委发文,这些药被点名重点监测……▍一批药,重点监测1月15日,国家卫健委药政司发布文件——关于《国家短缺药品清单管理办法(试行)(征求意见稿)》公开征求意见的公告。公告显示,未来,国家卫生健康委会同短缺药品供应保障工作会商联动机制成员单位制定国家短缺药品清单和临床必需易短缺药品重点监测清单,并建立动态调整机制。为加强药品短缺风险预警,国家