新版PROTAC技术,成功降解PD-L1
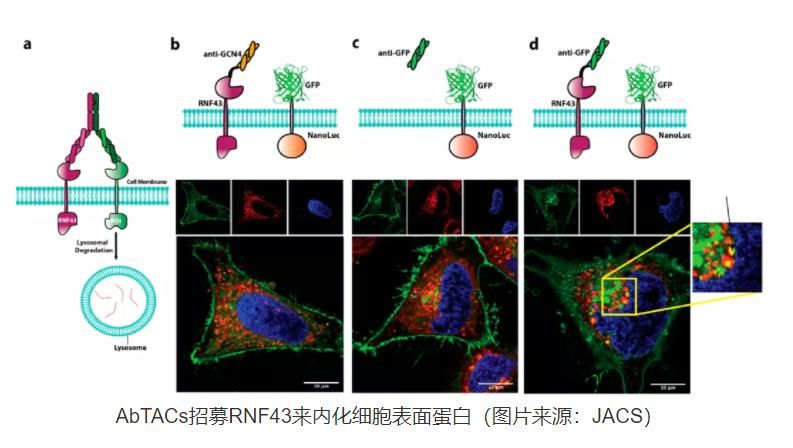
PROTACs及其相关的靶向降解技术(如LYTACs、dTAGs、Trim-Away和SNIPERs)已经成为靶向传统上被认为不可成药的蛋白的新型治疗方式。PROTACs全称为Proteolysis-Targeting Chimeras,即蛋白水解靶向嵌合体,是一种由E3连接酶结合物(binder)、Linker以及靶蛋白结合物(binder)组成的异双功能
李氏大药厂抗PD-L1单抗获批3期临床
近日,李氏大药厂发公告称, 附属公司中国肿瘤医疗获NMPA批准临床试验申请,以对结合化疗一线治疗扩散期小细胞肺癌的Socazolimab进行多中心、随机、双盲、并行组别的第三期临床试验。根据公告,此前socazolimab已经完成3项1期单药临床试验:(1)复发性或转移性宫颈癌;(2)晚期泌尿上皮癌;及(3)高级别骨肉瘤关于SOCAZ
默克 TGF-β/PD-L1治疗胆道癌 II 期研究失败
德国默克公布了代号为 INTR@PID BTC 047的II期研究顶线数据,该研究评估了TGF-β/PD-L1双靶点药物bintrafusp alfa单药二线治疗局部晚期或转移性胆道癌(BTC)患者的疗效,这些患者此前接受铂类一线化疗失败或不耐受铂类化疗。 此项研究包含有159例患者,在9个月的随访后,经独立审查委员会(IRC)评估的
首个Claudin18.2/PD-L1双抗获批临床
3月4日,国家药监局药品审评中心(CDE)官网公示,启愈生物的“Q-1802冻干粉针”新药临床试验申请获得临床默示许可,适应症为晚期实体瘤。Q-1802是中国首个申报临床的Claudin18.2/PD-L1双特异性抗体。Q-1802是启愈生物利用其抗体工程技术平台自主开发并具有自主知识产权的可以同时靶向PD-L1及Claudin18.
PD-(L)1领域,GSK即将闪亮登场!dostarlimab即将获批:首个治疗子宫内膜癌的抗PD-1疗法!
dostarlimab将成为首个被批准用于子宫内膜癌的抗PD-1疗法。
默克TGF-β/PD-L1双靶向疗法bintrafusp alfa治疗胆管癌展现治疗潜力!
bintrafusp alfa将一种转化生长因子-β(TGF-β)陷阱和抗PF-L1机制结合在一个融合蛋白中,旨在同时阻断肿瘤微环境中的2条免疫抑制途径TGF-β和PD-L1。
康宁杰瑞PD-L1/CTLA-4双抗KN046美国Ⅱ期注册临床IND获FDA批准
3月9日,康宁杰瑞生物制药宣布,PD-L1/CTLA-4双特异性抗体KN046的关键临床IND获得美国食品药品监督管理局(FDA)批准,同意在美国开展一项开放、多中心的Ⅱ期注册临床研究(研究编号:KN046-205, ENREACH-Thymic),旨在评估KN046(PD-L1/CTLA-4双特异性抗体)治疗胸腺癌的有效