美国FDA批准Dojolvi:第一个治疗长链脂肪酸氧化代谢病(LC-FAOD)的药物!
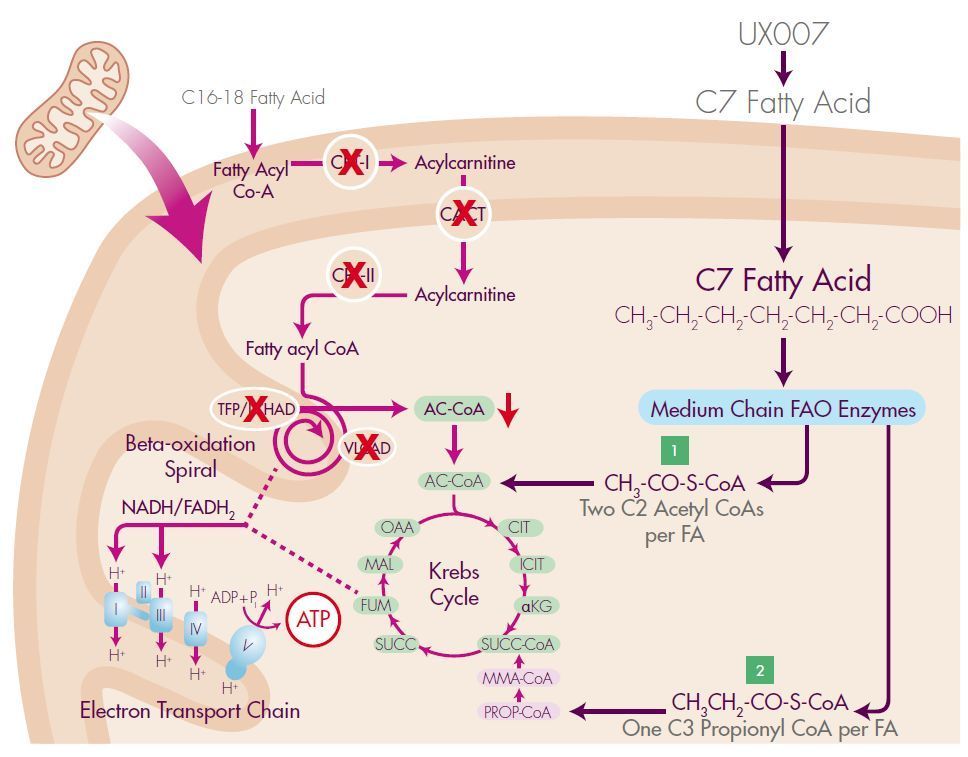
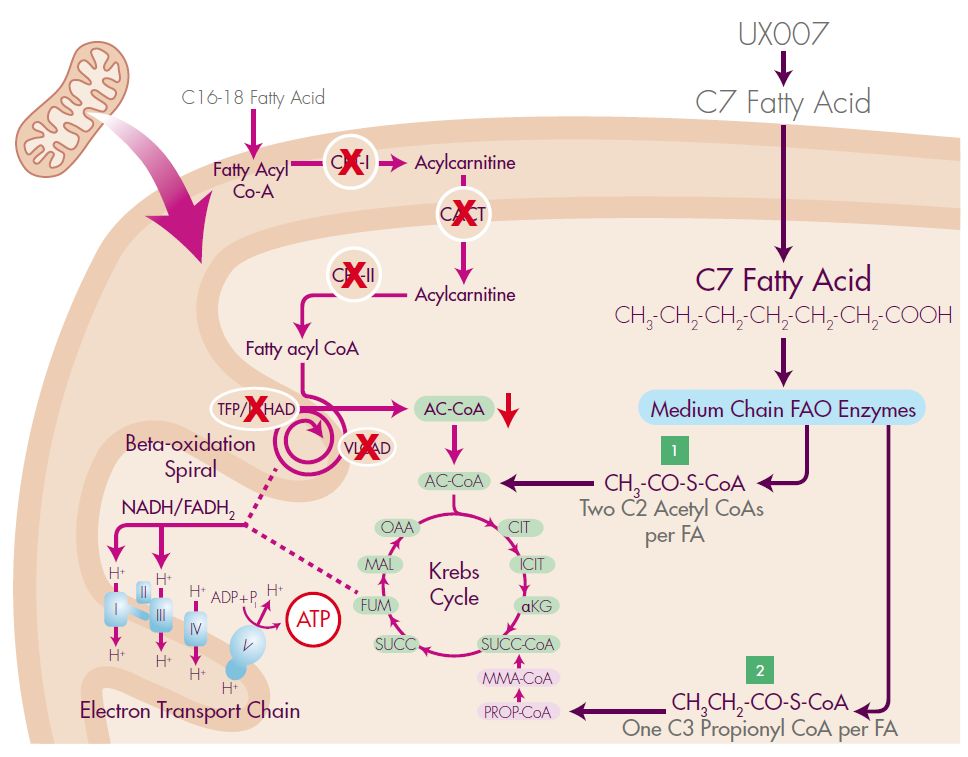
LC-FAOD是一种罕见的遗传病,患者机体无法将长链脂肪酸转化为能量,Dojolvi是一种高度纯化的、合成的七碳脂肪酸甘油三酯。
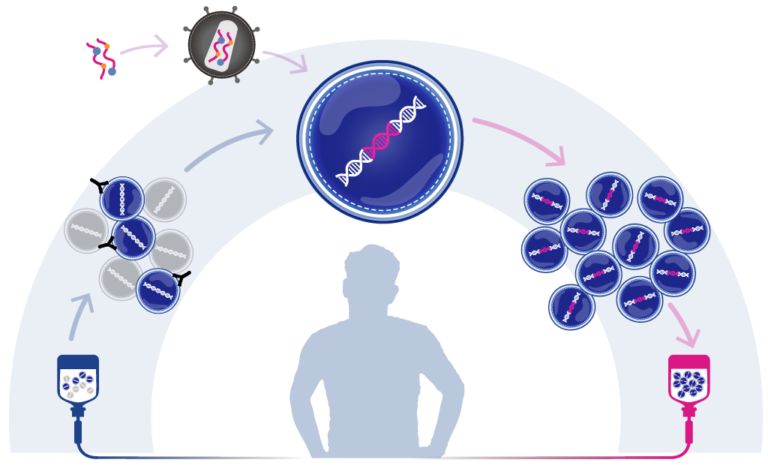
戈谢病基因疗法!美国FDA授予腺病毒基因疗法AVR-RD-02孤儿药资格和罕见儿科疾病资格!
2020年02月16日讯 /生物谷BIOON/ --Prevail Therapeutics是一家致力于为神经退行性疾病患者开发潜在疾病修饰AAV基因疗法的生物技术公司。近日,该公司宣布,美国食品和药物管理局(FDA)已授予其基因疗法PR001治疗戈谢病(Gaucher disease,GD)患者的孤儿药资格认定(ODD)。此外,FDA还授予了PR001治疗
戈谢病基因疗法!AVROBIO公司基于慢病毒的体外基因疗法AVR-RD-02获美国FDA孤儿药资格
2019年10月25日讯 /生物谷BIOON/ --AVROBIO是一家临床阶段的基因治疗公司。近日,该公司宣布,美国食品和药物管理局(FDA)已授予其基因疗法AVR-RD-02治疗戈谢病(Gaucher disease)的孤儿药资格(ODD)。AVR-RD-02是由患者自身的造血干细胞组成,这些干细胞经过基因改造可表达葡萄糖脑苷脂酶(GCase),这种酶在戈谢病患者体内缺乏。目前,AVROBIO
UX007(七碳脂肪酸甘油三酯)进入审查,治疗长链脂肪酸氧化代谢病(LC-FAOD)
2019年10月17日讯 /生物谷BIOON/ --Ultragenyx是一家专注于开发新型疗法治疗严重的罕见和超罕见遗传病的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已受理UX007(triheptanoin,三庚酸甘油酯,即七碳脂肪酸甘油三酯)的新药申请(NDA),该药用于治疗长链脂肪酸氧化代谢病(LC-FAOD),这是一组身体无法将长链脂肪酸转化为能量的遗传性疾病。之前,
罕见脂类代谢病新药!Ionis反义药物Waylivra治疗家族性部分脂肪营养不良(FPL)获得成功!
2019年08月08日讯 /生物谷BIOON/ --Ionis公司是反义RNA疗法方面的行业领导者,已利用其专有的反义RNA技术,创建了一个庞大的首创或同类最佳的药物管线,在研药物超过40种,并与多个行业巨头达成了战略合作。近日,该公司与旗下公司Akcea Therapeutics联合宣布了反义RNA药物Waylivra(volanesorsen)治疗家族性部分脂肪营养不良(FPL)临床研究BRO
UX007(七碳脂肪酸甘油三酯)申请上市,治疗长链脂肪酸氧化代谢病(LC-FAOD)
2019年08月02日讯 /生物谷BIOON/ --Ultragenyx是一家专注于开发新型疗法治疗严重的罕见和超罕见遗传病的生物制药公司。近日,该公司宣布,已向美国食品和药物管理局(FDA)提交了UX007(triheptanoin,三庚酸甘油酯,即七碳脂肪酸甘油三酯)的新药申请(NDA),用于治疗长链脂肪酸氧化代谢病(LC-FAOD),这是一组身体无法将长链脂肪酸转化为能量的遗传性疾病。之前,
UX007(七碳脂肪酸甘油三酯)2019年中申请上市,治疗长链脂肪酸氧化代谢病(LC-FAOD)
2019年4月22日讯 /生物谷BIOON/ --Ultragenyx是一家专注于开发新型疗法治疗严重的罕见和超罕见遗传病的生物制药公司。近日,该公司宣布,美国FDA已授予UX007治疗长链脂肪酸氧化代谢病(LC-FAOD)的快速通道资格和罕见儿科疾病资格。LC-FAOD是一组身体无法将长链脂肪酸转化为能量的遗传性疾病。Ultragenyx首席医疗官Camille L. Bedrosian表示,“
国际罕见病日 我国首部《戈谢病患者长期生存状况调查》出炉
在第11个国际罕见病日即将到来之际,中国首个罕见病慈善援助项目:中华慈善总会与赛诺菲中国合作开展的中华慈善总会思而赞慈善援助项目迎来了10周年庆典。会上我国首部《戈谢病患者长期生存状况调查(2019)》(以下简称:《生存调查》)正式发布。《生存调查》首次聚焦于我国戈谢病领域患者生活状况,依据思而赞慈善援助项目10年以来积累的戈谢病诊疗的真实世界数据,客观地反映了130余位戈谢病患者目前的生活状况。
栾佐:干细胞技术在遗传代谢病治疗中的应用与挑战
北京2018年11月12日讯 /生物谷BIOON/ -- 2018年11月9日-10日,由生物谷主办的2018(第十届)干细胞国际研讨会在北京隆重召开。北京海军总医院儿科主任医师、中华医学会医学工程学分会干细胞工程学组副主委、中华医学会组织修复与再生医学分会委员、中国生物医药协会再生医学会常委、中国医师国协会神经修复学分会副主委、儿科神经修复学学组主委、军儿科专业委员会副主委、北京市儿科学会副主委