2021年终盘点:Cell杂志重磅级突破性研究成果
来源:本站原创 2021-01-02 21:49
2021年12月26日讯/生物谷BIOON/---时至岁末,2021年已经接近尾声,迎接我们的将是崭新的2022年,2021年三大国际著名杂志Cell、Nature和Science(CNS)依旧刊登了很多重磅级的研究进展,本文中小编就对2021年Cell杂志发表的亮点研究进行整理,分享给大家!
2021年12月26日讯/生物谷BIOON/---时至岁末,2021年已经接近尾声,迎接我们的将是崭新的2022年,2021年三大国际著名杂志Cell、Nature和Science(CNS)依旧刊登了很多重磅级的研究进展,本文中小编就对2021年Cell杂志发表的亮点研究进行整理,分享给大家!
1.Cell:癌细胞存在三种状态!检测它们的状态可以揭示药物敏感性
doi:10.1016/j.cell.2021.11.017
在一项新的研究中,来自美国麻省理工学院和丹娜-法伯癌症研究所等研究机构的研究人员分析了来自胰腺导管腺癌(PDAC)的细胞。目前很少有治疗胰腺肿瘤的靶向药物,因此大多数患者接受的化疗药物最初可能有效,但往往随着肿瘤的耐药性出现而停止发挥作用。他们利用单细胞RNA测序技术,分析了来自胰腺癌患者的大约25例转移性肿瘤样本。
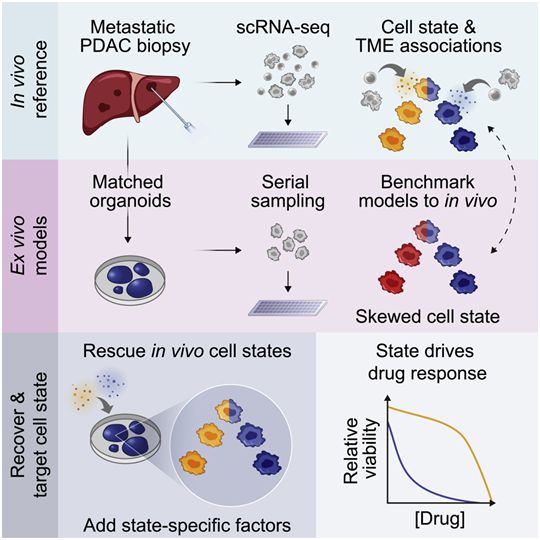
图片来自Cell, 2021, doi:10.1016/j.cell.2021.11.017。
这些作者还发现,癌细胞的生长环境在决定它的细胞状态方面起着关键作用。在这项新的研究中,他们利用每名患者的活组织样本培育出相匹配的“类器官”,即微小的癌症聚集体。这类类器官通常被用于精准医疗管道,为个性化患者的肿瘤进行建模,以帮助确定可能对这些人有用的药物。他们指出,改变肿瘤微环境可以促使肿瘤细胞从一种状态转变为另一种状态,这可能提供了一种使它们更易受某种特定药物影响的方法。
2.Cell:重大进展!抗体阻止病毒感染新策略---让病毒扭曲变形
doi:10.1016/j.cell.2021.11.009
人们普遍认为,抗体通过抓住病毒的表面并阻止它们感染宿主细胞来中和它们。但是,在一项新的研究中,来自新加坡国立大学、杜克-新加坡国立大学医学院、美国宾夕法尼亚州立大学和英国牛津大学的研究人员发现这种中和方式并不是抗体让病毒失效的唯一方式。他们发现抗体还能让病毒变形,从而阻止它们正确地附着到细胞上并进入其中。相关研究结果于2021年11月30日在线发表在Cell期刊上,论文标题为“The epitope arrangement on flavivirus particles contributes to Mab C10’s extraordinary neutralization breadth across Zika and dengue viruses”。
论文共同通讯作者、宾夕法尼亚州立大学化学副教授Ganesh Anand博士说,“每个人都认为抗体与病毒结合并阻止它们进入细胞---基本上是将它们锁定。但是我们的研究首次揭示,抗体也可能在物理上让病毒变形,因此它们无法正确地附着和感染宿主细胞。”
3.Cell:重大进展!抑制ID3或SOX4可逆转T细胞衰竭,有望让CAR-T细胞更高效地对抗实体瘤
doi:10.1016/j.cell.2021.11.016
称为CAR-T细胞的特殊工程化免疫细胞已被证明是对付血癌的有力武器,但它们对付实体瘤的效果要差得多,部分原因在于一种称为T细胞衰竭的过程。如今,在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员阐明了T细胞衰竭的关键分子细节,指出了克服这一过程的具体策略。相关研究结果于2021年12月2日在线发表在Cell期刊上,论文标题为“An NK-like CAR T cell transition in CAR T cell dysfunction”。
这些作者开发出一种T细胞衰竭的实验室培养皿模型,以更密切地研究它,并希望能发现逆转它的方法。他们设计出靶向一种称为间皮素(mesothelin)的细胞标志物的CAR-T细胞,并让这些T细胞暴露于表达间皮素的胰腺肿瘤细胞四周,其中间皮素在胰腺和其他一些肿瘤的表面上发现。在4周后,CAR-T细胞的反应是表现出典型的衰竭迹象,但也出现了先前研究中没有出现的迹象。这些新的衰竭现象包括一些T细胞的身份变化,如它们部分恢复为一种免疫细胞类型,即自然杀伤细胞(NK细胞),这被认为是T细胞的一个远亲。这些作者在来自癌症患者的处于衰竭状态的CAR-T细胞中发现了这种相同的T细胞向NK细胞转变的迹象。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.11.016。
4.Cell:揭示哺乳动物自噬体形成机制,新冠病毒可以破坏这种机制
doi:10.1016/j.cell.2021.10.017
一种称为自噬的错综复杂的生物过程通过清除和回收碎片和入侵的微生物,在保持我们的细胞健康和功能方面发挥着重要作用。在此之前,人们对对自噬的了解大多是基于对酵母细胞的研究。
如今,在一项新的研究中,美国新墨西哥大学自噬、炎症与代谢卓越生物医学研究中心主任Vojo Deretic教授领导的一个研究团队绘制出了自噬在哺乳动物---包括人类---中如何发挥作用的关键细节。在一项令人惊人的发现中,这些作者提供的证据显示,SARS-CoV-2感染可以破坏这一过程。相关研究结果近期发表在Cell期刊上,论文标题为“Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes”。
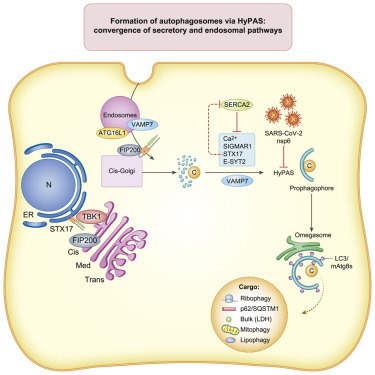
图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.017。
Deretic说,他们惊讶地发现SARS-CoV-2冠状病毒会干扰自噬过程。Deretic说,细胞有强大的先天免疫机制来识别试图在其内部细胞质中复制的病毒,但是这种冠状病毒已经找到了一种偷偷摸摸的方式进行增殖。
5.Cell:揭示X染色体失活新机制!100个Xist分子足以实现整条X染色体失活
doi:10.1016/j.cell.2021.10.022
在哺乳动物发育的一个奥秘中,早期雌性胚胎中的每个细胞都会关闭其两条X染色体中的一条,只留下一条功能性的X染色体。多年来,这种X染色体失活背后的机制一直很模糊,但是来自美国加州大学洛杉矶分校的研究人员如今在一项新的研究中在理解这一过程方面迈出了重要一步。相关研究结果于2021年11月4日在线发表在Cell期刊上,论文标题为“Xist nucleates local protein gradients to propagate silencing across the X chromosome”。
近三十年来,科学家们已经知道,在胚胎发育早期,X染色体失活需要一种称为Xist的RNA分子。他们还知道,有数百种其他蛋白与Xist相互作用。但在缺乏明确证据的情况下,该领域的大多数人错误地认为,许多Xist拷贝包裹着靶X染色体,或在X染色体上的不同位置不断移动,直接与该染色体上1000多个基因中的每一个相互作用,以诱导它们沉默。
在这项新的研究中,Plath和她的同事们用荧光标记蛋白分子,并使用超分辨率显微镜来观察它们在X染色体上的精确位置。然后,当X染色体在雌性小鼠的胚胎干细胞中发生失活时,该团队能够观察Xist和几十个相互作用的蛋白的运动。他们发现,成对的Xist仅位于X染色体上的50个点,总共有100个Xist分子。
6.Cell:肠道病原体诱导组织耐受性,防止肠道神经元在后续感染时死亡
doi:10.1016/j.cell.2021.10.004
简单的胃肠道感染可能造成很大的损害。有1亿个神经元散布在胃肠道上,可能被肠道感染所消灭,从而潜在导致长期的胃肠道疾病。但是肠道感染可能有一个好处。一项新的研究发现肠道感染了细菌或寄生虫的小鼠产生了一种独特的耐受性,与教科书上的免疫反应完全不同。该研究描述了肠道巨噬细胞如何通过保护肠道神经元来应对先前的肠道病原体攻击,防止它们在未来的病原体袭击时死亡。这些发现最终可能对与肠道神经元的失控死亡有关的疾病(比如肠易激综合征)产生临床影响。相关研究结果于2021年10月29日在线发表在Cell期刊上,论文标题为“Enteric pathogens induce tissue tolerance and prevent neuronal loss from subsequent infections”。
论文共同通讯作者兼论文第一作者、洛克菲勒大学博士后研究员Tomasz Ahrends和Mucida实验室的其他成员首先用一种非致命的沙门氏菌菌株感染了小鼠,其中沙门氏菌是一种标准的食物中毒的细菌来源。
小鼠在大约一周的时间内清除了这种细菌感染,在此过程中失去了一些肠道神经元。然后他们用另一种类似的食源性细菌感染这些相同的小鼠。这一次,小鼠的肠道神经元没有进一步丧失,这表明第一次感染形成了一种防止了神经元丧失的耐受性机制。
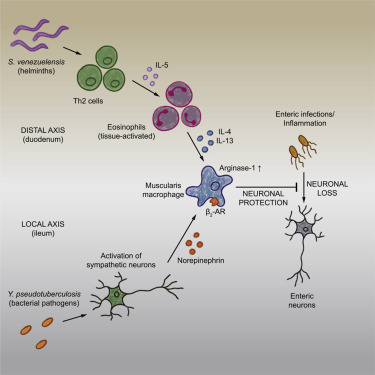
图片来自Cell (2021). DOI: 10.1016/j.cell.2021.10.004。
Mucida发现,在原发性细菌感染期间,肠道神经元会召唤肠道巨噬细胞,后者会赶到受感染区域,保护这些脆弱的肠道神经元免受未来的攻击。然而,当蠕虫侵入肠道时,是T细胞招募了肠道巨噬细胞,将它们送到甚至是肠道的远处,以确保全部肠道神经元免受未来的伤害。最后,通过不同的途径,细菌和蠕虫感染都导致了对肠道神经元的保护。
7.Cell:在猴子、老鼠身上发现的RetroCHMP3基因有望作为一种新型抗病毒药物来阻断HIV、埃博拉和其他人类致命病毒
doi:10.1016/j.cell.2021.09.008
在一项新的研究中,来自美国犹他大学、洛克菲勒大学和宾夕法尼亚州立大学的研究人员确定了在小鼠和猴子身上发现的CHMP3基因变体(即RetroCHMP3)如何干扰HIV病毒和埃博拉病毒等有包膜病毒复制。这种变体导致CHMP3基因编码的蛋白发生改变,破坏了有包膜病毒离开受感染细胞的能力,并阻止它们继续感染其他细胞。这一发现最终可能导致人们开发出新的医学干预措施来自阻止有包膜病毒感染。相关研究结果于2021年9月30日在线发表在Cell期刊上,论文标题为“RetroCHMP3 blocks budding of enveloped viruses without blocking cytokinesis”。
通常情况下,一些病毒将自己包裹在细胞膜中,然后通过从宿主细胞中出芽来实现退出。RetroCHMP3基因将这一过程延迟了足够长的时间,以至于病毒无法利用ESCRT途径从宿主细胞中逃出。
论文共同通讯作者、犹他大学医学院人类遗传学系进化遗传学家Nels Elde博士说,“这是一个意想不到的发现。我们感到惊讶的是,只要稍微放慢我们的细胞生物学,就会使病毒复制失去作用。”
8.Cell:重大进展!鉴定出裂谷热病毒利用Lrp1蛋白进入宿主细胞
doi:10.1016/j.cell.2021.09.001
裂谷热病毒(rift valley fever virus, RVFV)导致绵羊、山羊和牛等牲畜爆发具有经济破坏性的出血热,即裂谷热。这种由蚊子传播的疾病爆发导致与死亡或濒临死亡的动物打交道的人受到感染,有时会造成数百人的病例和数十人的死亡。裂谷热没有特定的治疗方法,一直局限于非洲和阿拉伯半岛。但是能够传播该病毒的蚊子在世界各地都能找到,因此有必要了解和控制RVFV。在一项新的研究中,来自美国华盛顿大学圣路易斯医学院和匹兹堡大学的研究人员发现RVFV通过利用一种通常参与从血液中摄取低密度脂蛋白(LDL,所谓坏胆固醇的载体)的蛋白质进入细胞内部。这一发现可能会导致预防裂谷热的疗法,或通过干扰这种病毒进入细胞的能力减少它的影响。相关研究结果于2021年9月23日在线发表在Cell期刊上,论文标题为“Lrp1 is a host entry factor for Rift Valley fever virus”。
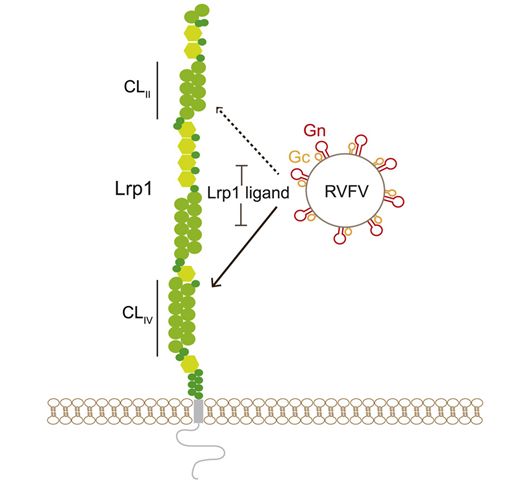
图片来自Cell, 2021, doi:10.1016/j.cell.2021.09.001。
这一发现提供了一个机会。如果这种病毒需要LRP1来感染宿主细胞,那么暂时让LRP1失去作用可能会限制它在体内的传播能力,从而减少疾病。这些作者使用了一种能有效做到这一点的蛋白质。这种称为RAP的蛋白质附着在LRP1上,并阻挡其他试图附着上来的东西。
这些作者让这种病毒感染了一组小鼠,同时用RAP治疗它们。第二组小鼠也被这种病毒感染了,但没有进行RAP治疗以进行比较。大多数接受RAP治疗的小鼠存活下来,而所有未接受RAP治疗的小鼠都死亡。此外,与未经RAP治疗的小鼠相比,经过RAP治疗的小鼠在感染后第三天全身的病毒水平较低。
9.Cell:开发出一种新的基因递送载体---MyoAAV,有潜力使基因疗法更安全和更有效地肌肉疾病
doi:10.1016/j.cell.2021.08.028
遗传性肌肉疾病导致渐进性肌肉萎缩,经常导致早期死亡,治疗选择很少,也无法治愈。一些基因疗法使用无害的病毒载体将致病基因的功能性拷贝递送给细胞,在临床试验中显示出对一部分肌肉营养不良症的治疗前景,但也面临挑战。携带功能性基因拷贝的病毒载体需要高剂量才能到达整个身体的肌肉,而这些临床试验中使用的病毒载体往往最终地更多地进入肝脏而不是肌肉。这导致肝脏中的病毒载体含量过高,出现严重的不良副作用,甚至导致一些临床试验参与者的死亡。
在一项新的研究中,来自美国布罗德研究所和哈佛大学等研究机构的研究人员开发出一个新的腺相关病毒(AAV)家族---基因治疗中的基因递送主力,它们改善了对肌肉组织的靶向性,这对肌肉疾病患者可能更安全、更有效。这组病毒载体(他们称之为MyoAAV)到达肌肉的效率比目前临床试验中使用的病毒载体高10倍以上,并且在很大程度上避开了肝脏。他们发现,由于这种效率的提高,MyoAAV可用于递送治疗性基因,其剂量比其他研究和临床试验中使用的病毒载体低约100至250倍,有可能减少肝脏损伤和其他严重副作用的风险。相关研究结果于2021年9月9日在线发表在Cell期刊上,论文标题为“Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species”。论文通讯作者为哈佛大学教授、布罗德研究所成员Pardis C. Sabeti、Sabeti实验室的Mohammadsharif Tabebordbar和哈佛大学干细胞与再生生物学系教授Amy Wagers。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.08.028。
利用MyoAAV,这些作者将治疗性基因或CRISPR-Cas9基因编辑系统专门递送给肌肉细胞。他们改善了杜兴氏肌营养不良症小鼠模型和X连锁肌管性肌病小鼠模型的肌肉功能,其中杜兴氏肌营养不良症是最常见的遗传性肌肉疾病,而X连锁肌管性肌病是一种更罕见的遗传性肌肉疾病。他们还发现,MyoAAV可以有效地将基因疗法传递给非人类灵长类动物的肌肉和人类肌肉细胞。
10.Cell:实体瘤治疗重大进展!递送内源性RNA的CAR-T细胞可改善对实体瘤的治疗
doi:10.1016/j.cell.2021.08.004
嵌合抗原受体(CAR)T细胞(CAR-T)疗法利用经过基因改造的T细胞来治疗某些类型的癌症,但是由于较差的肿瘤浸润、功能衰竭和抗原匮乏,CAR-T细胞在治疗实体瘤时经常遭遇挑战,它们的疗效受到限制。CAR-T细胞需要识别癌细胞上的特定靶标来杀死它们。然而,癌细胞并不总是携带特异性的靶标,或者它们找到了隐藏靶标的方法,从而免受CAR-T细胞的攻击。递送模式识别受体激动剂是提高免疫功能的一种策略,然而,将这些激动剂靶向到免疫细胞是具有挑战性的,而且在癌细胞中脱靶信号可能是有害的。
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现作为一种自然发生的激活RIG-I/MDA5信号的内源性RNA,RN7SL1可以激活身体自身的天然T细胞,以寻找逃避CAR-T细胞识别的癌细胞。这可能有助于改善治疗实体瘤的努力,毕竟实体瘤占人类癌症的大多数。相关研究结果于2021年8月30日在线发表在Cell期刊上,论文标题为“The immunostimulatory RNA RN7SL1 enables CAR-T cells to enhance autonomous and endogenous immune function”。
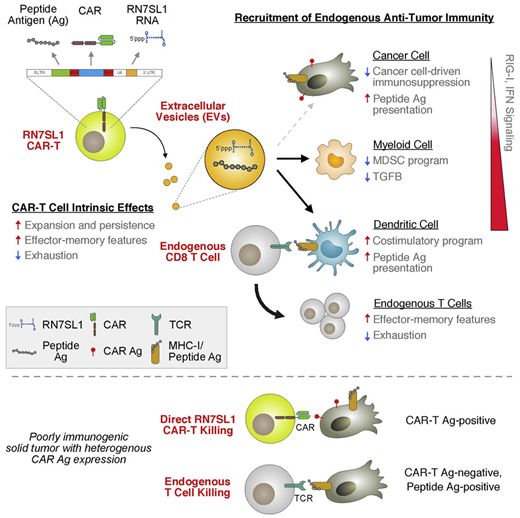
图片来自Cell, 2021, doi:10.1016/j.cell.2021.08.004。
第一种工具是一种称为RN7SL1的内源性RNA。当由CAR-T细胞递送给肿瘤时,RN7SL1模拟了病毒RNA。RN7SL1被部署在CAR-T细胞释放的胞外囊泡中并选择性地转移到先天免疫细胞中,并激活RIG-I/MDA5信号。就像病毒感染后,作为身体免疫系统的一个分支,先天免疫细胞在看到CAR-T细胞递送的RN7SL1后被激活。这些先天免疫细胞如今可以刺激身体的T细胞,动员它们加入对癌症的攻击。然而,与CAR-T细胞一样,身体的天然T细胞也需要在癌细胞上找到一种靶标来识别和攻击。因此,CAR-T细胞提供的第二种工具是外来抗原,这些外来抗原被“涂抹”在癌细胞的表面,本质上标志着它们被天然的T细胞杀死。
这些作者利用小鼠模型表明,用这种一箭双雕的方式武装CAR-T细胞,招募身体自身的免疫系统,可以防止肿瘤复发,即使许多癌细胞不能被单独的CAR-T细胞识别和杀死。因此,对 CAR-T细胞进行基因改造,使之递送RN7SL1和外来抗原,可能有助于打击实体瘤逃避CAR-T细胞的常见方式,从而增强疗效。
11.Cell:揭示趋化因子CXCL16让细胞毒性T细胞在肿瘤微环境中存活下来
doi:10.1016/j.cell.2021.07.015
身体的免疫系统可以识别和攻击癌细胞,但当这些癌细胞能够克服这种攻击时,患者体内就会出现恶性肿瘤。在一项新的研究中,来自美国麻省总医院(MGH)和哈佛医学院等研究机构的研究人员发现了免疫细胞在抗癌斗争中生存所需的一些关键因素。这一发现指出了潜在的治疗靶标,以使免疫系统能够有效地击败侵袭性癌症。相关研究结果于2021年8月2日在线发表在Cell期刊上,论文标题为“CXCR6 positions cytotoxic T cells to receive critical survival signals in the tumor microenvironment”。
细胞毒性T细胞(CTL)是识别和摧毁癌细胞的免疫细胞,它们首先在肿瘤引流淋巴结中被激活。从那里,它们进入血液,到达肿瘤并与恶性肿瘤细胞作战。然而,肿瘤对CTL来说是非常不利的环境。当这些作者使用成像技术检查肿瘤中的情况时,他们发现,为了在肿瘤中生存,CTL必须在癌细胞周围组织中的血管附近区域停留一段时间。
论文共同通讯作者、MGH免疫学与炎症性疾病中心副主任、哈佛医学院医学教授Thorsten Mempel博士解释说,“在肿瘤微环境(niche,也译为壁龛)内,它们能够与高度活化的树突细胞群体相互作用,这些树突细胞提供CTL所依赖的生存信号。此类生存信号,包括细胞因子IL-15,使CTL能够存活足够长的时间,以有效地消除癌细胞,并在理想的条件下,完全排斥肿瘤。”
Mempel和他的同事们还想知道CTL如何找到它们进入肿瘤微环境的方式。他们猜测趋化因子在其中发挥了主要作用,其中趋化因子是指导免疫细胞迁移并帮助并帮助它们在组织内找到彼此的趋化引导因子。论文共同第一作者兼论文共同通讯作者、德克萨斯大学MD安德森癌症中心免疫学系助理教授Mauro Di Pilato博士说,“我们发现,一种名为CXCL16的趋化因子被那些占据血管相关微环境的活化树突细胞高度表达,而且这种趋化因子的受体,即CXCR6,帮助CTL在这种微环境中聚集,从而对它们在肿瘤中的生存至关重要。”
12.Cell:一种激活CaMKII的基因疗法可保护视网膜神经节细胞,阻止青光眼引起的视力下降
doi:10.1016/j.cell.2021.06.031
青光眼是造成视觉障碍和失明的主要原因。在一项新的研究中,来自美国西奈山伊坎医学院等研究机构的研究人员发现在一种青光眼小鼠模型中,一种基因疗法能保护视神经细胞并保存视力。这一发现为开发针对青光眼的神经保护疗法提供了一条道路。相关研究结果于2021年7月22日在线发表在Cell期刊上,论文标题为“Preservation of vision after CaMKII-mediated protection of retinal ganglion cells”。
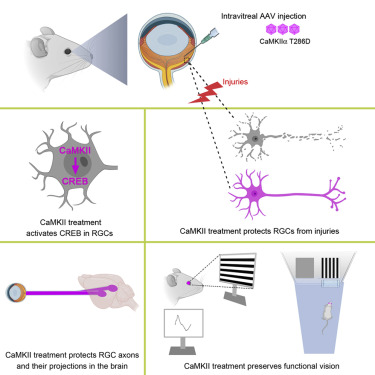
利用基因疗法阻止青光眼引起的视力下降,图片来自Cell, 2021, doi:10.1016/j.cell.2021.06.031。
在寻找干预的方法时,他们发现用基因疗法激活CaMKII通路被证明对视网膜神经节细胞有保护作用。在遭受毒性刺激(对这些细胞造成快速损害)之前和遭受视神经挤压伤(造成较慢的损害)之后,对小鼠进行基因治疗,增加了CaMKII的活性,有力地保护了视网膜神经节细胞。在经过基因治疗的小鼠中,77%的视网膜神经节细胞在遭受毒性刺激(toxic insult)后12个月内存活,而对照组小鼠只有8%。在遭受视神经挤压伤6个月后,77%的视网膜神经节细胞存活,而对照组只有7%。同样,通过基因治疗提高CaMKII的活性被证明对基于眼压升高或基因缺陷的青光眼模型中的视网膜神经节细胞有保护作用。
13.Cell:揭示中性粒细胞弹性蛋白酶选择性杀死癌细胞,有望开发出全新的抗癌疗法
doi:10.1016/j.cell.2021.04.016
在一项新的研究中,来自美国芝加哥大学的研究人员描述了一种非凡的新机制:利用该机制,人体自身的免疫系统可以在不损害宿主细胞的情况下消灭癌细胞。这一发现有可能开发出对癌细胞有选择性、对正常细胞和组织无毒的药物。如果成功,这一发现可能会通过确保在正确的时间以正确的剂量递送正确的药物来改善精准医疗的实践。这样的发现可能揭示癌症的弱点,并有可能开发出新的、更有效和副作用更少的治疗方法。相关研究结果近期发表在Cell期刊上,论文标题为“Neutrophil elastase selectively kills cancer cells and attenuates tumorigenesis”。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.016。
Becker及其同事们利用人类和小鼠模型观察到,ELANE启动了一个复杂的癌症杀伤程序,该程序抑制细胞生存途径,诱导DNA损伤,增加线粒体活性氧的产生,并最终激活程序性细胞死亡,即所谓的细胞凋亡。这一系列事件是由分泌弹性蛋白酶的PMN引发的,该蛋白酶将蛋白质分解成更小的分子。结果就是这个过程释放了CD95死亡结构域,该结构域负责通过控制哪些细胞发生凋亡来保持免疫系统的平衡。这种受到激活的CD95死亡结构域然后与组蛋白H1相互作用,组蛋白H1在癌细胞中升高以维持其基因组稳定性。
ELANE在许多类型的癌症细胞系中持续激活这一程序,但在测试的任何非癌症细胞中都没有。根据这些作者的说法,ELANE对癌细胞与非癌细胞的特异性可能限制了潜在的毒性,在注射ELANE的无瘤小鼠身上观察到的无副作用加强了这种可能性。这种选择性杀伤也保留了免疫细胞,使它们能够利用释放的抗原,产生一种增强的免疫反应以延伸到癌症扩散的部位。
14.Cell:发现一组抗聚糖抗体可有效地中和HIV病毒
doi:10.1016/j.cell.2021.04.042
天然抗体可以靶向病原体表面上的宿主聚糖。在一项新的研究中,来自美国杜克大学人类疫苗研究所的研究人员报告,一组新发现的与HIV病毒外壳上的聚糖结合的抗体能够有效地中和这种病毒,并指出一种新的疫苗方法也可潜在地用于对抗SARS-CoV-2和真菌病原体。相关研究结果于2021年5月20日在线发表在Cell期刊上,论文标题为“Fab-dimerized glycan-reactive antibodies are a structural category of natural antibodies”。
这些作者描述了在猴子和人类中发现的一类免疫细胞,它们产生一种独特的抗聚糖抗体(anti-glycan antibody)。这种新描述的抗体有能力附着在HIV外层的聚糖斑(a patch of glycans)上。这些聚糖斑是链状糖结构,类似于存在于宿主细胞表面上的聚糖。
这代表了一种新的宿主防御形式。这些新发现的抗体具有一种特殊的形状,可能对各种病原体有效。这些作者是在一系列探索是否存在靶向覆盖HIV外表面的聚糖的免疫反应中发现了这种抗体。
15.Cell:第三次进化革命!首次揭示糖基化的RNA无处不在,而且它们定位于细胞表面上
doi:10.1016/j.cell.2021.04.023
核酸的出现和蛋白的出现有时被称为第一次和第二次进化革命,因为它们使我们所知道的生命成为可能。一些专家认为,糖基化---将聚糖(glycan)添加到其他生物聚合物上---应被视为第三次进化革命,因为它使细胞能够从相同的DNA蓝图中构建无数的分子形式。长期以来,人们认为只有蛋白和脂质才会接受这些碳水化合物的修饰。然而,在一项新的研究中,来自美国斯坦福大学和哈佛大学等研究机构的研究人员发现RNA也可以被糖基化,而且这些被糖包裹的核酸似乎会定位到细胞膜上。这是科学家们有史以来第一次在RNA上观察到这一点。相关研究结果于2021年5月17日在线发表在Cell期刊上,论文标题为“Small RNAs are modified with N-glycans and displayed on the surface of living cells”。
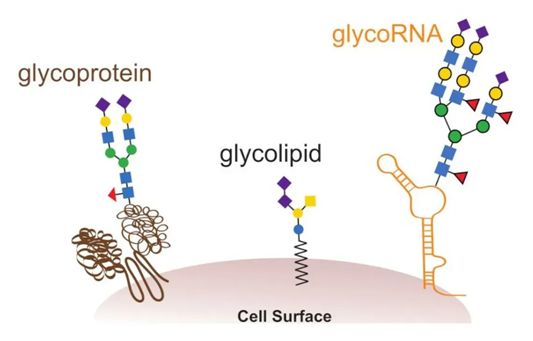
GlycoRNA、糖脂和糖蛋白是细胞糖衣的一部分。图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.023。
这些作者明显分离出一种共价的RNA-聚糖共轭物。然而,巨大的问题仍然存在,包括这些glycoRNA的作用是什么以及它们如何形成。比如,目前还不清楚RNA和聚糖到底是如何物理连接在一起的,如果没有这些信息,一些科学家不太相信这种结合是通过酶的作用发生的。
这些作者认为,RNA的糖基化方式与蛋白的糖基化方式基本相同,甚至需要一些相同的蛋白。正如那篇预印本文章所指出的那样,当他们抑制参与糖基化的关键酶时,glycoRNA以一种剂量依赖的方式消失了。同样,经基因改造后在蛋白糖基化中出现差错的细胞系产生了非常少的glycoRNA。鉴于多个糖基化步骤只有在检查了正确的蛋白折叠后才能进行,RNA与蛋白通过相同的途径进行糖基化将是很奇怪的。因此,科学家们很难想象糖基化在RNA上到底会如何发生。
16.Cell:重大进展!实验性药物CA激活分子伴侣介导的自噬,有潜力治疗阿尔茨海默病
doi:10.1016/j.cell.2021.03.048
在一项新的研究中,来自美国阿尔伯特-爱因斯坦医学院的研究人员设计出一种实验性药物,它可以在小鼠体内逆转阿尔茨海默病的关键症状。该药物通过重新激活一种消化和循环利用不需要的蛋白以去除它们的细胞清理机制而起作用。相关研究结果于2021年4月22日在线发表在Cell期刊上,论文标题为“Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome”。
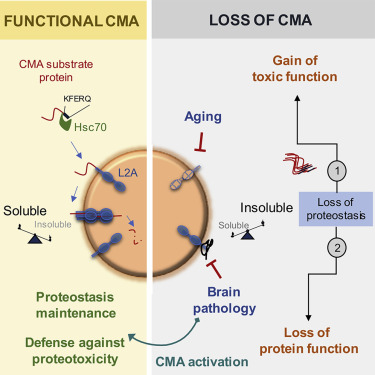
激活CMA可维持蛋白稳态和抵抗蛋白毒性,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.048。
随着人们年龄的增长,CMA的效率越来越低,这就增加了不需要的蛋白积累成损害细胞的不溶性团块的风险。事实上,阿尔茨海默病和所有其他神经退行性疾病的特点是在患者的大脑中存在有毒的蛋白聚集物。这些作者在这项研究中揭示了CMA和阿尔茨海默病之间的动态相互作用,神经元中CMA的丧失可促进阿尔茨海默病,反之亦然。这些发现表明,激活CMA的药物可能为治疗神经退行性疾病带来希望。
这些作者首先研究了CMA受损是否会导致阿尔茨海默病。为此,他们对小鼠进行了基因改造,使之具有缺乏CMA的兴奋性大脑神经元。这种脑细胞中的CMA缺失足以导致短期记忆丧失、行走障碍,以及在阿尔茨海默病的啮齿类动物模型中经常发现的其他问题。此外,CMA的缺失极大地破坏了蛋白稳态(proteostasis)---细胞调节它们所含蛋白的能力。正常情况下可溶性的蛋白已经转变为不可溶性,并有风险形成有毒的聚集物。
在其中的一项令人鼓舞的发现中,这些作者开发了一种新型药物,它显示出治疗阿尔茨海默病的潜力。他们知道CMA能够降解有缺陷的tau和其他蛋白,但是阿尔茨海默病和其他神经退行性疾病中大量的缺陷蛋白使CMA不堪重负,基本上使其瘫痪。这种药物通过提高一种关键的CMA成分的水平来重新提升CMA的效率。
在CMA中,称为分子伴侣的蛋白与体内细胞中受损或有缺陷的蛋白结合。分子伴侣将它们的货物运送到细胞的溶酶体。溶酶体是一种有膜细胞器,它含有的酶消化和循环利用废弃物。然而,为了成功地将它们携带的货物送入溶酶体,分子伴侣必须首先将货物“对接”到一种名为LAMP2A的蛋白受体上,该受体从溶酶体的膜上长出。溶酶体上的LAMP2A受体越多,潜在的CMA活动水平就越高。这种名为CA的新型药物通过增加这些LAMP2A受体的数量而发挥作用。
17.Cell:重大进展!中美科学家成功在体外利用构建出人-猴嵌合胚胎
doi:10.1016/j.cell.2021.03.020
在一种物种的有机体内生长另一种物种的细胞的能力为科学家们提供了一个强大的用于研究和医学的工具。这种方法可以促进我们对人类早期发育、疾病发生和进展以及衰老的理解;为药物评估提供创新平台;并解决对可移植器官的关键需求。然而开发这样的工具一直是一个艰巨的挑战。在一项新的研究中,来自中国昆明理工大学和美国沙克生物学研究中心等研究机构的研究人员通过展示一种新的将人类细胞整合到动物组织中的方法,向这一目标迈进了一步。这为了解一系列疾病并解决供体器官的严重短缺问题奠定基础。相关研究结果发表在2021年4月15日的Cell期刊上,论文标题为“Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo”。
据世界卫生组织(WHO)估计,每年进行的13万例器官移植手术只占需求的10%,而可用器官的短缺更加剧了这一需求。鉴于猪的器官大小、生理学和解剖学与人类相似,科学家们希望在猪组织中生长人类细胞可能能够解决这一问题。此前,在2017年的研究中,沙克生物学研究中心的科学家们报告了他们的突破性研究工作:他们将人皮肤细胞重编程为诱导性多能干细胞(iPS),然后将ips细胞暴露于某种分子混合物中,从而将它们转化为潜能扩展的人多能性干细胞(extended pluripotent stem cell, EPS),而所产生的EPS细胞可产生更多类型的组织;他们将EPS细胞整入早期阶段的猪组织中,标志着利用大型动物生产可移植人类器官的第一步(Cell, 2017, doi:10.1016/j.cell.2016.12.036; Cell, 2017, doi:10.1016/j.cell.2017.02.005)。但人体细胞的贡献相当低,这可能是由于两个物种之间的进化距离很大(9000万年)。于是,在这项新的研究中,这些作者开始在一种关系更密切的物种---食蟹猴---中研究嵌合体形成。
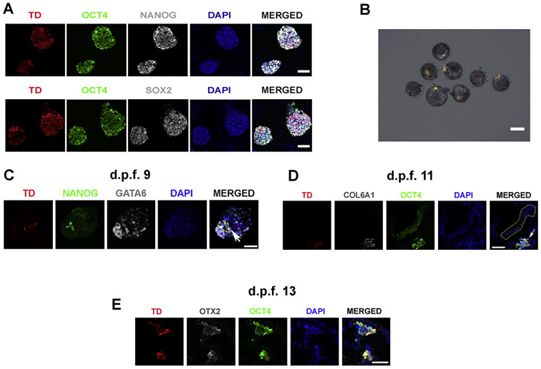
宿主猴胚胎中人EPS干细胞的谱系特化,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.020。
在这项新的研究中,这些作者在食蟹猴身上测试了这些EPS细胞。他们将25个人EPS干细胞分别插入132个食蟹猴胚胎中,并将所获得的嵌合体在培养皿中培养长达20天。他们发现,人类细胞显示出了持久的能力:13天后,它们仍然存在于三分之一的嵌合体中。人类细胞似乎与食蟹猴细胞融合在一起,并已开始特化为将发育成不同器官的细胞类型。
为了确定这两种物种的细胞之间的分子沟通途径,这些作者分析了这种嵌合体的转录组。他们观察到来自嵌合体组织的细胞具有与对照组不同的转录组图谱,并检测到在嵌合体细胞中有几条增强的或新的分子沟通途径。这些途径可能促进了人细胞和食蟹猴细胞之间的融合。操纵其中的一些途径可能会帮助人类细胞在“更适合再生医学”的物种胚胎中存活。
18.Cell:新研究揭示动脉粥样硬化加速克隆性造血产生
doi:10.1016/j.cell.2021.01.049
在一项新的研究中,来自美国麻省总医院(MGH)和哈佛医学院的研究人员如今提出了一种不同的、额外的可能性:动脉粥样硬化导致克隆性造血。动脉粥样硬化患者遭受高脂血症和炎症,这两种症状会长期增强造血干细胞分裂率。他们证实这种增加的分裂会加速克隆性造血的产生。相关研究结果于2021年2月25日在线发表在Cell期刊上,论文标题为“Increased stem cell proliferation in atherosclerosis accelerates clonal hematopoiesis”。
论文通讯作者、MGH系统生物学中心首席研究员Kamila Naxerova博士说,“动脉粥样硬化患者基本上经历了‘时间加速’。这是因为基因改变出现并在造血系统中传播的速度是由干细胞分裂的基本速度决定的。从遗传学的角度来看,你可以说动脉粥样硬化加速了血液的老化。鉴于克隆性造血是一种与年龄相关的疾病,因此动脉粥样硬化患者比健康人容易更早发病。”(生物谷 Bioon.com)
19.Cell:重大突破!HIV完整无损地通过核孔进入细胞核,并在那里释放它的基因组
doi:10.1016/j.cell.2021.01.025
在一项新的研究中,来自德国马克斯-普朗克生物物理研究所、海德堡欧洲分子生物学实验室和海德堡大学医院的研究人员首次成功地对转运到被感染细胞的细胞核的过程中的人类免疫缺陷病毒(HIV,俗称艾滋病病毒)进行了成像。通过成像获得的电子断层图像显示了这种病毒的蛋白包膜通过核孔---细胞核周围膜上的开口,允许分子进出。他们发现,这种病毒完好无损地通过核孔,只是在细胞核内破裂,并在那里释放它的遗传信息。这阐明了这种病毒的遗传物质整合到被感染细胞基因组中的一个重要机制。相关研究结果发表在2021年2月18日的Cell期刊上,论文标题为“Cone-shaped HIV-1 capsids are transported through intact nuclear pores”。
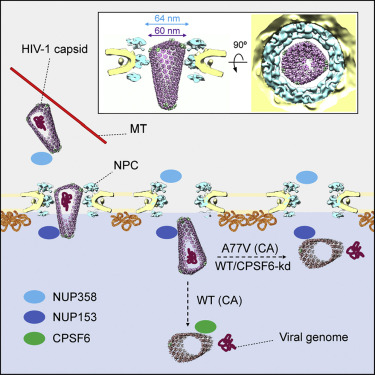
图片来自Cell, 2021, doi:10.1016/j.cell.2021.01.025。
HIV-1是这项研究的重点,它主要感染免疫系统中的某些细胞,从而大大削弱了人体自身对疾病的防御能力。这种病毒的遗传物质被安全地包装在一种称为“衣壳(capsid)”的圆锥形蛋白胶囊中。科学家们已知道,在感染过程中,这种衣壳如何穿过细胞膜进入细胞内部,但不知道这种病毒的遗传物质是如何从衣壳进入细胞核,并在那里引发新病毒的形成。
20.Cell论文详解!大数据揭示无论癌症的来源如何,癌症可分为112种亚型,在每种亚型中,控制癌症转录状态的主调节蛋白几乎完全相同
doi:10.1016/j.cell.2020.11.045
数千种不同的基因突变与癌症有关,但一项针对近万名患者的新研究发现,无论癌症的来源如何,肿瘤都只能分类为112种亚型,而且在每 种亚型中,控制癌症转录状态的主调节蛋白几乎完全相同,与每个患者的特定基因突变无关。
这项研究证实了主调节蛋白提供的分子逻辑整合了许多不同的和患者特异性突变的影响,以实现特定肿瘤亚型的转录状态,从而极大地扩大 了可能对相同治疗做出反应的患者的比例。相关研究结果于2021年1月11日在线发表在Cell期刊上,论文标题为“A modular master regulator landscape controls cancer transcriptional identity”。论文通讯作者为美国哥伦比亚大学的Andrea Califano博士、Cory Abate-Shen博士和Mariano Alverez博士。

图片来自Cell, 2021, doi:10.1016/j.cell.2020.11.045。
更具体地说,这项新的研究表明,更大比例的患者可能对靶向主调节蛋白的新药物有反应,而不是寻找靶向与越来越小的患者亚群相关的突 变基因的药物。对来自所有类型癌症的数千个肿瘤进行的新分析还发现,癌细胞存活所必需的关键遗传程序仅由24种主调节模块(master regulator module, MR模块)进行机制上控制,每种MR模块仅由少量这样的主调节蛋白组成,这些蛋白协同发挥作用。这一分析有可能在未来简化和改善癌症治疗。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


