重磅!美国埃博拉治疗药物:再生元三抗鸡尾酒Inmazeb获批,单次治疗大幅降低死亡率!
来源:本站原创 2020-10-15 16:16
Inmazeb抗体技术已被用于开发COVID-19抗体鸡尾酒疗法。

2020年10月15日讯 /生物谷BIOON/ --再生元(Regeneron)近日宣布,美国食品和药物管理局(FDA)已批准Inmazeb(atoltivimab、maftivimab、odesivimab-ebgn,前称REGN-EB3),该药是一款三抗体鸡尾酒疗法,用于治疗由扎伊尔型埃博拉病毒(Zaire ebolavirus)引起的感染,该药可用于成人和儿童感染者,包括感染检测呈阳性母亲的新生儿。
值得一提的是,Inmazeb是美国FDA批准的第一个用于治疗埃博拉病毒感染的药物。Inmazeb是由3种全人IgG1单抗组成的混合物,由再生元利用专有的VelociSuite®快速反应技术开发,目前该技术正被应用于开发针对新型冠状病毒肺炎(COVID-19)的新型抗体鸡尾酒疗法。
埃博拉病毒是导致埃博拉出血热(EHF)的元凶,该病是一种急性病毒性传染病,症状包括发烧、头痛、关节和肌肉疼痛、乏力、腹泻、呕吐、胃痛、食欲不振及异常出血。在美国和欧盟,REGN-EB3均被授予了孤儿药资格、在美国被授予了突破性药物资格(BTD)。除了REGN-EB3之外,来自Ridgeback Biotherapeutics的一款治疗埃博拉病毒感染的单克隆抗体mAb114也在美国和欧盟被授予孤儿药资格、BTD、优先药物资格(PRIME)。
Inmazeb的安全性和有效性在PALM(Pamoja Tulinde Maisha,共同拯救生命)试验中得到了证实。该试验是由刚果民主共和国金沙萨国家生物医学研究所(INRB)和美国国立卫生研究院(NIH)国家过敏和传染病研究所(NIAID)共同发起和资助、由世界卫生组织(WHO)协调的一个国际研究联合会开展。该研究中的埃博拉治疗中心由刚果民主共和国金沙萨国家生物医学研究所(INRB)、刚果民主共和国卫生部和三个医疗人道主义组织的工作人员监督:国际医疗行动联盟(ALIMA)、国际医疗队(IMC)和无国界医生组织(MSF)。
从2018年11月20日至2019年8月9日,PALM研究总共入组了681例患者。研究中,这些患者以1:1:1:1的比例接受4种疗法的治疗,包括3种抗体疗法(抗体鸡尾酒ZMapp、三抗鸡尾酒疗法Inmazeb、治疗性单抗mAb114)和一款抗病毒药物remdesivir(瑞德西韦),其中ZMapp用作对照。研究中,所有药物均静脉输注:(1)ZMapp治疗组,从第1天开始每3天接受50mg/kg体重的剂量,共3次;(2)remdesivir治疗组,第1天接受负荷剂量(成人200mg,儿童根据体重调整)、从第2天开始每日维持剂量(成人100mg),持续9-13天(具体取决于病毒载量);(3)MAb114治疗组,接受50mg/kg剂量,在第1天作为单次输液;(4)Inmazeb治疗组,在第1天接受150mg/kg单次输液。研究的主要终点是治疗28天的死亡率。
结果显示:接受Inmazeb和mAb114治疗的受试者比其他两组受试者有更大的生存机会。治疗28天的具体数据为:(1)ZMapp、remdesivir、mAb114、Inmazeb治疗组感染者死亡率分别为49.7%(84/169)、53.1%(93/175)、35.1%(61/174)、33.5%(52/155);(2)在感染后早期治疗且血液病毒水平较低的患者中,数据更强,死亡率分别为:24.5%(24/98)、29.0%(29/100)、9.9%(10/101)、11.2%(10/89)。
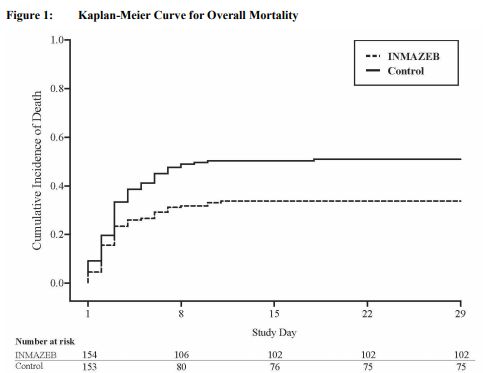
整个埃博拉疫情的死亡率约为67%。基于上述数据,PALM研究已提前终止,并选择Inmazeb和mAb114作为扩展期中用于所有未来患者随机治疗的药物。在PALM研究中,共有154例患者接受了Inmazeb治疗,在扩大获取项目中,另有284例患者接受了Inmazeb治疗。在接受Inmazeb治疗的患者中,经历的最常见不良事件是:发烧、发冷、心动过速(心率过快)、呼吸急促(呼吸急促)和呕吐;然而,这些也是埃博拉病毒感染的常见症状。接受Inmazeb治疗的患者应避免同时使用活疫苗,因为该疗法有可能抑制用于预防埃博拉病毒感染的活疫苗病毒的复制,并可能降低疫苗的效力。
再生元联合创始人、总裁和首席科学官George D.Yancopoulos博士表示:“我们对FDA批准Inmazeb(REGN-EB3)感到无比自豪。这是FDA第一次批准一种专门针对埃博拉病毒的治疗方法,埃博拉病毒已经引起了许多致命的疫情。数十年来,我们对Velocuite®快速反应技术的投资、世界一流科学家的奉献精神、医疗保健提供者和患者的勇敢贡献,以及主要国际卫生组织和政府之间的卓越合作,促成了这一重要时刻。当我们对COVID-19应用同样先进的技术和制造能力时,我们希望这将是众多证明如何成功利用科学力量对付危险的传染病的一个例子。”
再生元的VelociSuite技术能够有效地创建和选择针对特定生物目标的全人抗体,这对于解决新的和/或快速传播的病原体(如埃博拉和COVID-19)尤其重要。这些技术有助于从VelocImmune®小鼠(经基因改造具有基因人源化免疫系统)和恢复期的人类志愿者中快速克隆和产生优化的全人抗体,并允许全人抗体快速升级为制造高质量的细胞系生产和大规模的生物反应器制造。一旦确定了强有力的治疗性抗体候选物,公司内部的临床前、临床和商业规模的生产能力允许快速扩大规模和灵活性,以适应当前的需要。
埃博拉病毒(Ebola)是导致埃博拉出血热(EHF)的元凶,该病是一种急性病毒性出血性传染病,症状包括:发烧、头痛、关节和肌肉疼痛、乏力、腹泻、呕吐、胃痛、食欲不振及异常出血。这些症状可在病毒感染后2-21天内出现,但最常见于8-10天。埃博拉病毒不是一种经水传播(water-borne)或食物传播的疾病,也不通过空气传播,该病通过直接接触受感染者体液或已被病毒污染的器具(如针头)传播。
2019年11月,默沙东疫苗产品Ervebo(V920)率先在欧盟获得批准、2019年12月在美国获得批准、2020年2月在首批4个非洲国家获得批准,用于18岁及以上人群的主动免疫,以预防由扎伊尔型埃博拉病毒(Ebola Zaire)引起的埃博拉病毒病(EVD)。
Ervebo是全球首个获得监管批准的埃博拉疫苗,标志着一个历史性的里程碑。Ervebo(V920)采用了一种有缺陷的、能够感染家畜的水泡性口炎病毒,将病毒的一种基因用埃博拉病毒的基因替换。
除了Ervebo之外,2020年6月底,强生公司的埃博拉预防性疫苗方案——2针免疫方案(Zabdeno®,Mvabea®)获得欧盟批准,用于年龄≥1岁以上人群的主动免疫,以预防由扎伊尔埃博拉病毒株(Zaire ebolavirus)引起的埃博拉病毒病(EVD)。这款疫苗方案具体为:(1)将Zabdeno®作为第一针免疫疫苗,该疫苗基于杨森的AdVac技术开发;(2)2个月(大约8周)后,将Mvabea®作为第二针免疫疫苗,该疫苗基于Bavarian Nordic公司的MVA-BN技术。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


