乳腺癌靶向药!美国FDA批准PARP抑制剂Lynparza(利普卓):辅助治疗BRCAm高危HER2-早期乳腺癌!
来源:本站原创 2022-03-16 02:15
Lynparza是第一个获批治疗gBRCAm/HER2-高危早期乳腺癌的靶向辅助疗法,同时是第一个在早期乳腺癌中显示总体生存(OS)益处的PARP抑制剂。
2022年03月15日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)与默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Lynparza(中文品牌名:利普卓,通用名:olaparib,奥拉帕利片剂):用于辅助治疗已接受新辅助(术前)或辅助(术后)化疗、携带有害或疑似有害生殖系BRCA突变(gBRCAm)、HER2阴性、高危早期乳腺癌成人患者。
值得一提的是,Lynparza是第一个也是唯一一个获批治疗gBRCAm、HER2-高危早期乳腺癌的靶向辅助疗法,同时是第一个也是唯一一个在早期乳腺癌中显示总体生存(OS)益处的PARP抑制剂。在3期OlympiA试验(NCT02032823)中,与安慰剂相比,Lynparza辅助治疗显著延长了无侵袭性疾病生存期(IDFS)和总生存期(OS)。
乳腺癌是全球诊断最多的癌症类型。据估计,2020年约有230万女性被诊断为乳腺癌。近91%的乳腺癌患者在疾病早期确诊,约5%的患者中发现生殖系BRCA突变。Lynparza能够显著降低高危早期乳腺癌患者的复发风险、提高生存期,这将有潜力改变早期乳腺癌的病程,为患者带来治愈希望。
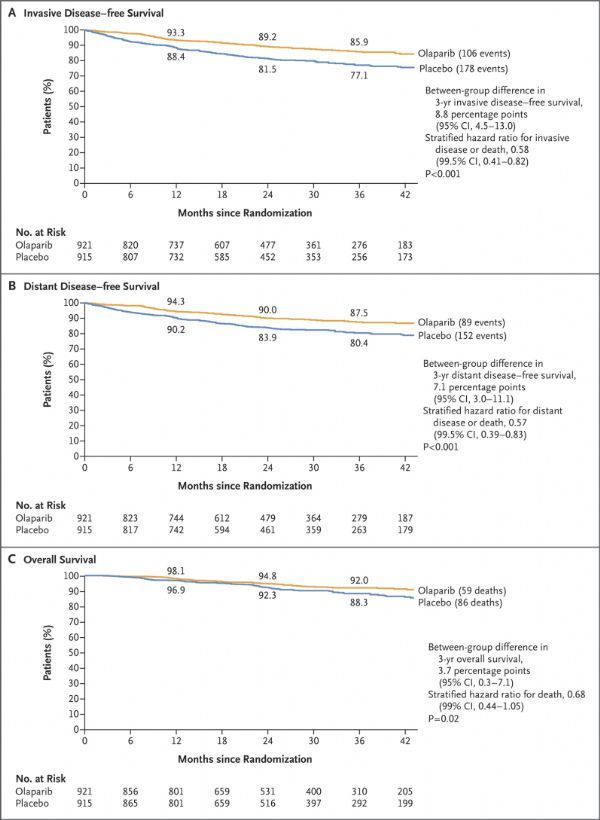
OlympiA试验结果 (图片来源:NEJM)
OlympiA是一项双盲、平行组、安慰剂对照、多中心3期试验,旨在评估Lynparza片剂与安慰剂用于辅助治疗gBRCAm、HER2-、高危早期乳腺癌成人患者的疗效和安全性,这些患者已完成局部治疗和标准新辅助或辅助化疗。试验的主要终点是IDFS,定义为从随机分组到首次治疗失败(局部或远处复发或新发癌症或任何原因死亡)的时间。关键次要终点为总生存期(OS)。
在整个试验人群中,与安慰剂相比,Lynparza辅助治疗使IDFS显示出统计学意义和临床意义的改善,将浸润性乳腺癌复发、第二种癌症或死亡的风险降低了42%(HR=0.58;99.5%CI:0.41-0.82;p<0.0001)。3年后,Lynparza治疗组有85.9%的患者仍然存活并且无浸润性乳腺癌和第二种癌症,而安慰剂组为77.1%。
此外,在整个试验人群中,与安慰剂相比,Lynparza在无远端疾病生存期(DDFS)的关键次要终点方面有统计学意义和临床意义的改善。Lynparza将远端疾病复发或死亡的风险降低了43%(HR=0.57;99.5%CI:0.39-0.83,p<0.0001)。
该试验的最新结果还显示,Lynparza辅助治疗使总生存期(OS)显示出统计学意义和临床意义的改善,将死亡风险降低了32%(HR=0.68;95%CI:0.50-0.91;p=0.0091)。该试验中,Lynparza的安全性和耐受性与先前临床试验中观察到的一致。

Lynparza是一种首创、口服多聚ADP核糖聚合酶(PARP)抑制剂,可利用肿瘤DNA损伤修复(DDR)通路的缺陷优先杀死癌细胞,这种作用模式赋予了Lynparza治疗存在DNA损伤修复缺陷(如BRCA1和/或BRCA2突变)的广泛类型肿瘤的潜力。
2017年7月,阿斯利康与默沙东达成肿瘤学全球战略合作,共同开发和商业化Lynparza及另一种MEK抑制剂selumetinib治疗广泛类型肿瘤,包括乳腺癌、前列腺癌、胰腺癌。
Lynparza是全球上市的首个PARP抑制剂,于2014年12月首次获美国FDA批准。截至目前,Lynparza已获批8个治疗适应症:(1)一线维持治疗BRCAm晚期卵巢癌成人患者;(2)联合贝伐单抗一线维持治疗HRD阳性晚期卵巢癌成人患者;(3)维持治疗复发性卵巢癌成人患者;(4)晚期gBRCAm卵巢癌成人患者;(5)治疗gBRCAm、HER2阴性(HER2-)转移性乳腺癌成人患者;(6)一线维持治疗gBRCAm转移性胰腺癌成人患者;(7)治疗gBRCAm、HER2-转移性乳腺癌;(8)治疗携带特定基因突变的转移性去势抵抗性前列腺癌(mCRPC)患者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->