结构生物学领域研究进展
来源:本站原创 2020-10-29 23:35
本期为大家带来的是结构生物学领域的最新研究进展,希望读者朋友们能够喜欢。
2020年10月29日讯/生物谷BIOON/---本期为大家带来的是结构生物学领域的最新研究进展,希望读者朋友们能够喜欢。
1. Cell:解析出人细胞中BAF复合物的三维结构
doi:10.1016/j.cell.2020.09.051.
一种称为BAF复合物的关键分子“机器”可改变DNA的结构,并且在癌症和其他一些疾病中经常发生突变。在一项新的研究中,来自美国达纳-法伯癌症研究所、洛克菲勒大学和华盛顿大学的研究人员构建出这种复合物的一种前所未有的三维结构模型。他们首次报告了首批直接从人体细胞中纯化出的处于天然状态下的BAF复合物的三维结构“图片”,这就让人们有机会将成千上万种癌症相关突变在空间上对应到这个复合物的特定位置上。相关研究结果于2020年10月13日在线发表在Cell期刊上,论文标题为“A Structural Model of the Endogenous Human BAF Complex Informs Disease Mechanisms”。论文通讯作者为达纳-法伯癌症研究所的Cigall Kadoch博士、洛克菲勒大学的Frank DiMaio博士和华盛顿大学的Thomas Walz博士。
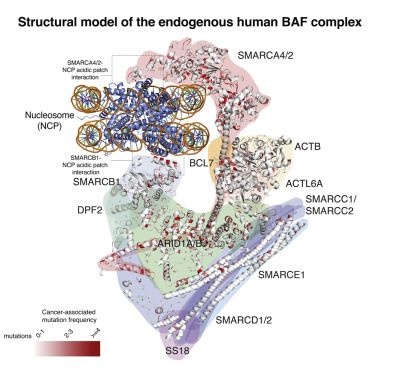
Kadoch说,“在此之前,关于这种复合物在我们细胞的细胞核内的实际面貌的三维结构模型或者说‘图片’仍然是不清晰的。”这些研究人员说,这些新获得的模型“代表了迄今为止解析出的人类BAF复合物的最完整的图片。”
这些新的发现“为理解BAF复合物成分发生的与人类疾病相关的突变提供了关键的基础,这些突变存在于20%以上的人类癌症、一些智力残疾和神经发育障碍中。”这些新见解可能有助于科学家们了解组成这种复合物的蛋白发生的突变是如何导致对DNA的正常调控受到破坏,因而有潜力破坏细胞中的基因表达,这有可能导致细胞癌变和形成肿瘤。比如,BAF复合物发生的突变是滑膜肉瘤、恶性横纹肌瘤等罕见儿童癌症的唯一原因,也是卵巢癌、肺癌等常见癌症的原因之一。
作为一种“分子机器”,BAF复合物本质上是一组重塑细胞中DNA包裹方式的蛋白。它由12个蛋白亚基组成。Kadoch说,以前试图获得BAF复合物的三维结构模型的尝试是针对实验室中经过基因改造的蛋白分子,“这无法重现整个复合物”。她说,自2014年以来,她和她的同事们一直在尝试解析BAF的三维结构,他们的主要目标是构建一种结构模型,以便帮助他们了解突变的影响,并最终帮助根据突变在BAF结构“图片”上的位置进行分类。她说,从人类细胞中提取BAF复合物是一个巨大的挑战:“我们设计了一种新的方法来纯化这种复合物---这花了好几年时间”。
BAF是几种通过修改染色质(由DNA和蛋白组成)来调节基因表达的分子“机器”之一。染色质是将长长的含有基因的DNA链更紧密压缩形成的。一个细胞中含有数十万个染色质修饰复合物,BAF就是其中的一种。BAF发生的突变虽然不会改变DNA基因密码而导致癌症,但会破坏DNA的拓扑结构和易接近性,从而导致基因表达异常和恶性肿瘤生长。
这些研究人员结合使用了几种强大的新分析工具,构建出BAF复合物作为单个孤立的复合物时和与核小体结合在一起时的结构模型。核小体是染色质的卷轴状单元,DNA片段缠绕在核小体周围。与核小体结合是BAF复合物重塑染色质和影响基因表达的必要条件。他们用来获得与核小体结合的BAF结构的最新和最有用的工具之一是低温电镜(cryo-EM)。作为电子显微镜的一种形式,它可以在天然环境中构建分子的高分辨率模型,并且正在引发结构生物学变革。在这种情况下,人类的BAF复合物太过复杂和灵活,单靠这种方法无法产生高分辨率的结构,但当与另外两种方法(交联质谱和同源建模)相结合时,亚基之间的结构连接变得更加清晰。
Kadoch和她的同事们报告说,BAF复合物由三个模块组成,这三个模块形成“C”形结构,并像木匠用C形夹把木头块固定在一起一样夹住核小体。他们发现,BAF结构中夹住核小体的两个区域是经常发生致癌突变的“热点”,并通过实验说明突变如何破坏BAF复合物对染色质的正常调控。他们还在这种复合物中发现了已知癌症突变的其他位点,其中,这些已知的癌症突变包含在一个称为COSMIC(Catalogue of Somatic Mutations in Cancer, 癌症体细胞突变目录)的数据库中,在结构上“簇集”在一起,并揭示了它们的功能。
Kadoch说,“在BAF复合物的结构上绘制这样的突变图谱并并了解它们的功能影响几十年来一直是这个领域的一个主要的、未被满足的目标。这标志着一个时代的开始,在这个时代里,我们将能够对确定特定肿瘤特征和提供治疗机会的突变进行功能性分类。”
2. Cell:对SARS-CoV-2刺突蛋白变体D614G的结构和功能分析
doi:10.1016/j.cell.2020.09.032.
自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的 症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。

新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。疫苗是控制大流行迫切需要的必要对策。目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。
SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。在此之前,科学家们已经证实,SARS-CoV和MERS-CoV的RBD包含主要的构象依赖性中和表位,并能够在免疫动物中引起强效的中和抗体,因而是有希望的疫苗开发靶标。
SARS-CoV-2刺突蛋白(S蛋白)变体D614G在全球范围内取代了祖先病毒,并且在几个月内达到了接近固定化的程度。
在一项新的研究中,来自美国马萨诸塞大学医学院、哈佛大学、赛默飞世尔科技公司和再生元制药公司的研究人员发现D614G在人类肺细胞、结肠细胞以及在通过异位表达人类ACE2或来自各种哺乳动物(包括中华菊头蝠和马来亚穿山甲)的ACE2同源物而允许被病毒感染的细胞上,比它的祖先病毒更具感染力。相关研究结果于2020年9月15日在线发表在Cell期刊上,论文标题为“Structural and Functional Analysis of the D614G SARS-CoV-2 Spike Protein Variant”。
D614G没有改变S蛋白的合成、加工或整合到SARS-CoV-2病毒颗粒中,但由于较快的解离速度,D614G对ACE2的亲和力降低。
通过低温电子显微镜对S蛋白三聚体的评估表明,D614G破坏了S蛋白的原聚体(protomer)之间的接触,使得S蛋白的构象转向能够结合ACE2的状态,这被认为是病毒颗粒与靶细胞膜融合的途径。与这种更开放的构象相一致的是,靶向S蛋白受体结合结构域(RBD)的抗体的中和效力并没有减弱。
3. Cell:我国科学家从结构上揭示BD-368-2抗体可有效治疗遭受新冠病毒严重感染的仓鼠
doi:10.1016/j.cell.2020.09.035.
了解强效中和抗体(NAb)如何抑制SARS-CoV-2是开发有效疗法的关键。在之前的一项新的研究中,利用在单细胞基因组学方面的专长,北京大学北京未来基因诊断高精尖创新中心的谢晓亮团队与首都医科大学附属北京佑安医院副院长的研究人员合作,从60余名恢复期患者体内收集了血液样本,在这些血液样本中,从8558个抗原结合的IgG1+克隆型(clonotype)中筛选出14种高强效中和抗体(Cell, 2020, doi:10.1016/j.cell.2020.05.025)。作为它们中最强效的抗体,BD-368-2对SARS-CoV-2假病毒和真正的SARS-CoV-2病毒的IC50值分别为8pM和100pM。
这些研究人员利用中国医学科学院实验动物研究所秦川博士实验室开发的hACE2转基因小鼠模型,完成了中和抗体的体内抗病毒实验。实验结果显示,BD-368-2抗体对SARS-CoV-2具有较强的治疗效果和预防保护作用:将BD-368-2抗体注射到受感染的小鼠体内时,病毒载量降低了约2400倍;将BD-368-2抗体注射到未受感染的小鼠体内时,它们免受病毒感染。
然而,BD-368-2抗体中和SARS-CoV-2的机制在很大程度上是未知的。为此,在一项新的研究中,这些研究人员报道了BD-368-2与SARS-CoV-2刺突蛋白(S蛋白)三聚体复合物结合在一起时的分辨率为3.5埃的低温电镜(cryo-EM)结构,揭示出BD-368-2通过同时占据所有三个受体结合结构域(RBD)来完全阻止这种S蛋白三聚体复合物对ACE2的识别,而且不论RBD是处于“上”构象还是“下”构象,都是如此。相关研究结果于2020年9月14日在线发表在Cell期刊上,论文标题为“Structurally resolved SARS-CoV-2 antibody shows high efficacy in severely infected hamsters and provides a potent cocktail pairing strategy”。
再者,BD-368-2以低剂量和不同给药窗口可治疗受感染的成年仓鼠,而接受安慰剂处理的受感染仓鼠表现出严重的间质性肺炎。
此外,BD-368-2的表位完全避开了反复出现的VH3-53/VH3-66中和抗体的共同结合位点,与RBD的三方共晶结构也证实了这一点。
将BD-368-2与反复出现的强效中和抗体配对,可在pM水平下中和SARS-CoV-2假病毒,并拯救突变诱导的中和逃逸。
综上所述,这些研究人员合理设计了一个可导致高中和效力的新RBD表位,并证实BD-368-2在治疗COVID-19方面的治疗潜力。
4. Cell:揭示新冠病毒S蛋白RBD结构域的中和位点和免疫显性位点
doi:10.1016/j.cell.2020.09.037.
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。目前人们迫切需要一种有效的预防疫苗来对抗这种病毒。然而,目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。
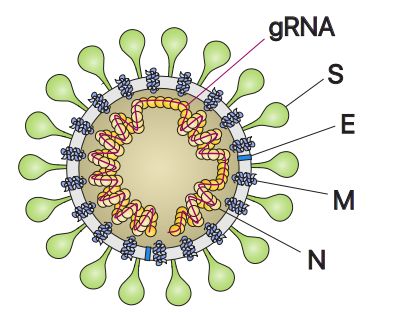
SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。
分析SARS-CoV-2感染引起的中和抗体(nAb)的特异性和动力学特征对于理解免疫保护和确定用于疫苗设计的靶标至关重要。
在一项新的研究中,来自美国华盛顿大学和Vir生物技术(Vir Biotechnology)子公司Humabs Biomed SA等研究机构的研究人员在647名SARS-CoV-2感染者的队列中,发现对SARS-CoV-2刺突蛋白和核蛋白(nucleoprotein, NP)的抗体反应强度和中和抗体滴度均与临床评分相关。相关研究结果于2020年9月16日在线发表在Cell期刊上,论文标题为“Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology”。
SARS-CoV-2刺突蛋白的受体结合结构域(RBD)是免疫显性的,也是SARS-CoV-2免疫血清中存在的90%中和抗体的靶点。
尽管整体RBD特异性血清IgG滴度在半衰期为49天的情形下减弱,但是一些个体的nAb滴度和亲合力(avidity)随着时间的推移而增加,这与亲和力成熟(affinity maturation)相一致。
这些研究人员利用单克隆抗体从结构上确定RBD抗原图谱,并对不同RBD表位特异性的血清抗体进行了血清学定量,从而确定了两个主要的受体结合基序抗原位点。这些研究结果解释了受体结合基序的免疫显性,并将会指导COVID-19疫苗设计和药物开发。
5. Cell:清华大学和浙江大学联手揭示新冠病毒的分子结构
doi:10.1016/j.cell.2020.09.018.
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。疫苗是控制大流行迫切需要的必要对策。目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。
SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。在此之前,科学家们已经证实,SARS-CoV和MERS-CoV的RBD包含主要的构象依赖性中和表位,并能够在免疫动物中引起强效的中和抗体,因而是有希望的疫苗开发靶标。
尽管最近在SARS-CoV-2蛋白的结构阐明方面取得了进展,但完整病毒的详细结构仍有待揭晓。
在一项新的研究中,来自中国清华大学和浙江大学等研究机构的研究人员利用低温电子断层扫描(cryo-electron tomography, cryo-ET)和子断层扫描图平均化(subtomogram averaging, STA)技术,报道了真实的SARS-CoV-2病毒的分子结构。相关研究结果于2020年9月14日在线发表在Cell期刊上,论文标题为“Molecular architecture of the SARS-CoV-2 virus”。
这些研究人员确定了SARS-CoV-2刺突蛋白在融合前和融合后构象下的天然结构,平均分辨率为8.7~11埃。
他们利用质谱分析了天然的SARS-CoV-2刺突蛋白中的N-连接聚糖(N-linked glycan)的组成,发现这些天然N-连接聚糖的整体加工状态与重组SARS-CoV-2刺突蛋白上的聚糖加工状态高度相似。
他们揭示出SARS-CoV-2核糖核蛋白(ribonucleoprotein, RNP)的天然构象及其高阶组装体。总的来说,这些表征极其详细地揭示了SARS-CoV-2病毒的结构,并阐明了这种病毒如何将它的长达大约30 kb的单分段RNA包装在直径为大约80 nm的壳体内。
6. Cell:首次解析出致幻剂与5-HT2A血清素受体结合在一起时的三维结构
doi:10.1016/j.cell.2020.08.024.
诸如麦角酰二乙胺(LSD)、裸盖菇素(psilocybin)和墨斯卡灵(mescaline)之类的致幻剂会导致严重且往往是持久的幻觉,但是它们在治疗重度抑郁症等严重精神疾病方面显示出巨大的潜力。为了充分研究这种潜力,科学家们需要知道这些药物如何在分子水平上与脑细胞相互作用,以引起它们的引人注目的生物效应。
在一项新的研究中,美国北卡罗来纳大学教堂山分校的Bryan L. Roth博士和斯坦福大学的Georgios Skiniotis博士及其同事们朝着这个方向迈出了一大步。他们首次解析出这些致幻剂与脑细胞表面上的5-HT2A血清素受体(5-HT2A serotonin receptor, HTR2A)结合在一起时的高分辨率结构。相关研究结果发表在2020年9月17日的Cell期刊上,论文标题为“Structure of a Hallucinogen-Activated Gq-Coupled 5-HT2A Serotonin Receptor”。
这一发现已经在引导人们探索更精确的化合物,这些化合物可以消除幻觉,但仍有很强的治疗效果。此外,科学家们还可以有效地改变LSD和裸盖菇素等药物的化学成分,其中裸盖菇素是蘑菇中的致幻化合物,已被美国食品药品管理局(FDA)授予治疗抑郁症的突破性地位。
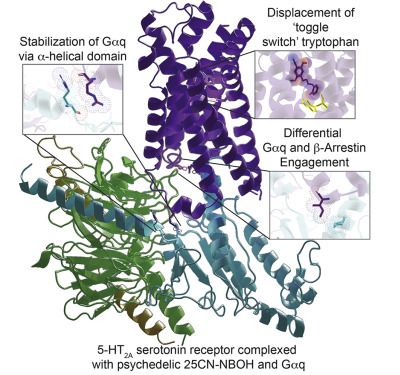
论文共同通讯作者、北卡罗来纳大学教堂山分校医学院药理学教授Bryan L. Roth博士说,“数以百万计的人为了消遣而服用这些药物,如今它们正逐渐成为治疗药物。首次了解它们在分子水平上如何发挥作用真地很重要,这是了解它们如何起作用的关键。鉴于裸盖菇素对抑郁症的显著疗效(在II期临床试验中),我们相信我们的发现将加速发现快速起效的抗抑郁药,并有可能发现治疗重度焦虑和物质使用障碍等其他疾病的新药。”
科学家们认为,HTR2A在人类大脑皮层中的表达水平非常高,它的激活是致幻药物起作用的关键。Roth说,“当激活时,这种受体会导致神经元以不同步和无序的方式放电,从而将噪音输入到大脑系统中。我们认为这是这些药物导致迷幻体验的原因。但目前还完全不清楚这些药物是如何发挥它们的治疗作用的。”
在这项新的研究中,Roth实验室与斯坦福大学医学院结构生物学家Skiniotis合作。Skiniotis说,“多项不同的研究进展的结合使得我们能够进行这项研究。其中之一是制备出更好、更均匀的5-HT2A受体蛋白。另一个是低温电镜技术(cryo-EM),它使得我们能够观察非常大的复合物,而不必让它们结晶。”
Roth表扬了他实验室的博士后研究员Kuglae Kim博士,这是因为Kim坚定不移地探索各种实验方法来纯化和稳定非常脆弱的血清素受体HTR2A。Roth说,“Kim很了不起。我毫不夸张地说,他完成的工作是最难做的事情之一。在三年的时间里,在一种慎重的、反复的、创造性的过程中,他能够稍加修改血清素蛋白,这样我们就可以得到足够数量的稳定蛋白来进行研究。”
Roth团队利用Kim的研究工作,首次揭示了LSD与HTR2A结合在一起时的X射线晶体结构。重要的是,Skiniotis及其团队随后利用低温电镜技术揭示了一种名为25-CN-NBOH的原型致幻剂与这整个受体复合物(包括效应蛋白Gαq)结合在一起时的图像。在大脑中,这个复合物控制神经递质的释放,并影响许多生物过程和神经过程。Kim利用低温电镜图像来说明HTR2A在氨基酸水平上的精确结构。
Roth和同事们如今正将他们的发现应用于基于结构的新药物发现,以便开发新的治疗药物。其中的一个目标是发现潜在的候选药物,这些候选药物可能能够在没有致幻效果的情况下提供治疗益处。
Skiniotis说,“我们对这些药物如何与HTR2A受体结合了解越多,我们就越能理解它们的信号转导特性。这项研究还没有给我们提供全貌,但是它提供了其中的相当大一部分。”
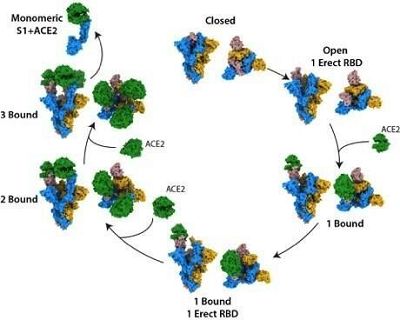
7. Nature:揭示SARS-CoV-2刺突蛋白结合人ACE2受体的结构机制
doi:10.1038/s41586-020-2772-0.
在一项新的研究中,来自英国弗朗西斯-克里克研究所的研究人员发现位于SARS-CoV-2冠状病毒表面上的刺突蛋白(S蛋白)与人类病毒受体ACE2接触时,可以采取至少十种不同的结构状态。这种对感染机制的新见解为开发疫苗和治疗方法奠定基础。相关研究结果于2020年9月17日在线发表在Nature期刊上,论文标题为“Receptor binding and priming of the spike protein of SARS-CoV-2 for membrane fusion”。
作为引起新冠肺炎(COVID-19)的冠状病毒,SARS-CoV-2的表面覆盖着S蛋白,这使得这种病毒能够感染人体细胞。当S蛋白与细胞表面受体ACE2结合,并在随后阶段催化病毒基因组释放到细胞中时,感染就开始了。然而,ACE2与SARS-CoV-2的S蛋白结合的确切性质仍然未知。
在首次对ACE2与S蛋白之间的结合机制进行整体考察的研究中,这些研究人员,对S蛋白与受体结合和感染的不同阶段相关的10种不同结构进行了表征。他们首先孵育S蛋白和ACE2的混合物,然后通过在液态乙烷中快速冷冻,捕捉不同形式的S蛋白。他们使用低温电镜技术检查这些蛋白样品,获得了数万张不同结合阶段的高分辨率图像。
他们观察到,S蛋白是以封闭和开放结构的混合物存在的。在ACE2结合一个开放位点后,S蛋白变得更加开放,导致一系列有利的构象变化,从而为进一步的结合做好准备。一旦S蛋白在所有三个结合位点上与ACE2结合,它的中央核心就会暴露出来,这可能有助于SARS-CoV-2与细胞膜融合,使得感染得以发生。
论文共同通讯作者、弗朗西斯-克里克研究所疾病过程结构生物学实验室博士后培训研究员Donald Benton说,“通过从整体角度研究结合事件,我们能够描述SARS-CoV-2特有的S蛋白结构。我们可以观察到,当S蛋白变得更加开放时,这种蛋白的稳定性会降低,这可能会增加它进行膜融合的能力,从而允许感染发生。”
这些研究人员希望,他们越能发现SARS-CoV-2与其他冠状病毒的不同之处,他们就能更有针对性地开发新的治疗方法和疫苗。
论文共同通讯作者、弗朗西斯-克里克研究所疾病过程结构生物学实验室博士后培训研究员Antoni Wrobel说,“随着我们揭开感染最早阶段的机制,我们可能会暴露出新的治疗靶点,或者了解目前现有的哪些抗病毒疗法更有可能发挥作用。”
论文共同通讯作者、弗朗西斯-克里克研究所疾病过程结构生物学实验室负责人Steve Gamblin说,“我们对SARS-CoV-2还有很多不了解的地方,但它的基本生物学包含了控制这种流行病的线索。通过了解是什么使这种病毒与众不同,我们就可以暴露出可利用的弱点。” 这些研究人员正在继续研究SARS-CoV-2和其他物种中相关冠状病毒的S蛋白结构,以更好地了解病毒感染和进化的机制。
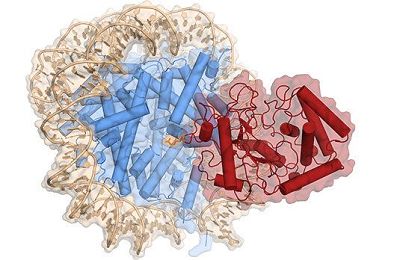
8. Nature:揭示核小体抑制cGAS的结构机制
doi:10.1038/s41586-020-2750-6.
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作2'3'环状GMP-AMP(cGAMP)的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
作为一种DNA传感蛋白,cGAS在微生物感染、细胞应激和癌症后启动先天免疫反应。一旦被双链DNA激活后,细胞质cGAS产生cGAMP,并触发炎性细胞因子和I型干扰素(IFN)产生。
cGAS也存在于充满基因组DNA的细胞核内,在那里,染色质参与限制它的酶活性。然而,染色质抑制cGAS的结构基础仍然未知。
在一项新的研究中,来自瑞士洛桑联邦理工学院和巴塞尔大学的研究人员确定了人cGAS与核小体结合在一起时的分辨率为3.1埃的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“Structural mechanism of cGAS inhibition by the nucleosome”。
cGAS与组蛋白H2A-H2B异源二聚体的酸性口袋(acidic patch)和核小体DNA广泛接触。结构和互补生化分析还发现cGAS与第二个核小体反式结合。从机制上看,核小体结合将cGAS锁定在单体状态,在这种状态下,空间位阻抑制了基因组DNA对cGAS的错误激活。
这些研究人员发现,cGAS-酸性口袋界面上发生的突变足以在体外消除核小体对cGAS的抑制作用以及在活细胞中触发cGAS在基因组DNA上的酶活性。
这项研究揭示了cGAS与染色质相互作用的结构基础,并确定了一个令人信服的机制,从而允许cGAS对基因组DNA进行自我-非自我识别。
9. Science:揭示核小体抑制cGAS激活的结构基础
doi:10.1126/science.abd0237.
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作cGAMP的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
有人提出宿主DNA组装成核小体可限制cGAS的自动激活,但是它的基本机制尚不清楚。
在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis for the inhibition of cGAS by nucleosomes”。
这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。
总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。(生物谷 Bioon.com)
1. Cell:解析出人细胞中BAF复合物的三维结构
doi:10.1016/j.cell.2020.09.051.
一种称为BAF复合物的关键分子“机器”可改变DNA的结构,并且在癌症和其他一些疾病中经常发生突变。在一项新的研究中,来自美国达纳-法伯癌症研究所、洛克菲勒大学和华盛顿大学的研究人员构建出这种复合物的一种前所未有的三维结构模型。他们首次报告了首批直接从人体细胞中纯化出的处于天然状态下的BAF复合物的三维结构“图片”,这就让人们有机会将成千上万种癌症相关突变在空间上对应到这个复合物的特定位置上。相关研究结果于2020年10月13日在线发表在Cell期刊上,论文标题为“A Structural Model of the Endogenous Human BAF Complex Informs Disease Mechanisms”。论文通讯作者为达纳-法伯癌症研究所的Cigall Kadoch博士、洛克菲勒大学的Frank DiMaio博士和华盛顿大学的Thomas Walz博士。

Kadoch说,“在此之前,关于这种复合物在我们细胞的细胞核内的实际面貌的三维结构模型或者说‘图片’仍然是不清晰的。”这些研究人员说,这些新获得的模型“代表了迄今为止解析出的人类BAF复合物的最完整的图片。”
这些新的发现“为理解BAF复合物成分发生的与人类疾病相关的突变提供了关键的基础,这些突变存在于20%以上的人类癌症、一些智力残疾和神经发育障碍中。”这些新见解可能有助于科学家们了解组成这种复合物的蛋白发生的突变是如何导致对DNA的正常调控受到破坏,因而有潜力破坏细胞中的基因表达,这有可能导致细胞癌变和形成肿瘤。比如,BAF复合物发生的突变是滑膜肉瘤、恶性横纹肌瘤等罕见儿童癌症的唯一原因,也是卵巢癌、肺癌等常见癌症的原因之一。
作为一种“分子机器”,BAF复合物本质上是一组重塑细胞中DNA包裹方式的蛋白。它由12个蛋白亚基组成。Kadoch说,以前试图获得BAF复合物的三维结构模型的尝试是针对实验室中经过基因改造的蛋白分子,“这无法重现整个复合物”。她说,自2014年以来,她和她的同事们一直在尝试解析BAF的三维结构,他们的主要目标是构建一种结构模型,以便帮助他们了解突变的影响,并最终帮助根据突变在BAF结构“图片”上的位置进行分类。她说,从人类细胞中提取BAF复合物是一个巨大的挑战:“我们设计了一种新的方法来纯化这种复合物---这花了好几年时间”。
BAF是几种通过修改染色质(由DNA和蛋白组成)来调节基因表达的分子“机器”之一。染色质是将长长的含有基因的DNA链更紧密压缩形成的。一个细胞中含有数十万个染色质修饰复合物,BAF就是其中的一种。BAF发生的突变虽然不会改变DNA基因密码而导致癌症,但会破坏DNA的拓扑结构和易接近性,从而导致基因表达异常和恶性肿瘤生长。
这些研究人员结合使用了几种强大的新分析工具,构建出BAF复合物作为单个孤立的复合物时和与核小体结合在一起时的结构模型。核小体是染色质的卷轴状单元,DNA片段缠绕在核小体周围。与核小体结合是BAF复合物重塑染色质和影响基因表达的必要条件。他们用来获得与核小体结合的BAF结构的最新和最有用的工具之一是低温电镜(cryo-EM)。作为电子显微镜的一种形式,它可以在天然环境中构建分子的高分辨率模型,并且正在引发结构生物学变革。在这种情况下,人类的BAF复合物太过复杂和灵活,单靠这种方法无法产生高分辨率的结构,但当与另外两种方法(交联质谱和同源建模)相结合时,亚基之间的结构连接变得更加清晰。
Kadoch和她的同事们报告说,BAF复合物由三个模块组成,这三个模块形成“C”形结构,并像木匠用C形夹把木头块固定在一起一样夹住核小体。他们发现,BAF结构中夹住核小体的两个区域是经常发生致癌突变的“热点”,并通过实验说明突变如何破坏BAF复合物对染色质的正常调控。他们还在这种复合物中发现了已知癌症突变的其他位点,其中,这些已知的癌症突变包含在一个称为COSMIC(Catalogue of Somatic Mutations in Cancer, 癌症体细胞突变目录)的数据库中,在结构上“簇集”在一起,并揭示了它们的功能。
Kadoch说,“在BAF复合物的结构上绘制这样的突变图谱并并了解它们的功能影响几十年来一直是这个领域的一个主要的、未被满足的目标。这标志着一个时代的开始,在这个时代里,我们将能够对确定特定肿瘤特征和提供治疗机会的突变进行功能性分类。”
2. Cell:对SARS-CoV-2刺突蛋白变体D614G的结构和功能分析
doi:10.1016/j.cell.2020.09.032.
自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的 症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。

新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。疫苗是控制大流行迫切需要的必要对策。目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。
SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。在此之前,科学家们已经证实,SARS-CoV和MERS-CoV的RBD包含主要的构象依赖性中和表位,并能够在免疫动物中引起强效的中和抗体,因而是有希望的疫苗开发靶标。
SARS-CoV-2刺突蛋白(S蛋白)变体D614G在全球范围内取代了祖先病毒,并且在几个月内达到了接近固定化的程度。
在一项新的研究中,来自美国马萨诸塞大学医学院、哈佛大学、赛默飞世尔科技公司和再生元制药公司的研究人员发现D614G在人类肺细胞、结肠细胞以及在通过异位表达人类ACE2或来自各种哺乳动物(包括中华菊头蝠和马来亚穿山甲)的ACE2同源物而允许被病毒感染的细胞上,比它的祖先病毒更具感染力。相关研究结果于2020年9月15日在线发表在Cell期刊上,论文标题为“Structural and Functional Analysis of the D614G SARS-CoV-2 Spike Protein Variant”。
D614G没有改变S蛋白的合成、加工或整合到SARS-CoV-2病毒颗粒中,但由于较快的解离速度,D614G对ACE2的亲和力降低。
通过低温电子显微镜对S蛋白三聚体的评估表明,D614G破坏了S蛋白的原聚体(protomer)之间的接触,使得S蛋白的构象转向能够结合ACE2的状态,这被认为是病毒颗粒与靶细胞膜融合的途径。与这种更开放的构象相一致的是,靶向S蛋白受体结合结构域(RBD)的抗体的中和效力并没有减弱。
3. Cell:我国科学家从结构上揭示BD-368-2抗体可有效治疗遭受新冠病毒严重感染的仓鼠
doi:10.1016/j.cell.2020.09.035.
了解强效中和抗体(NAb)如何抑制SARS-CoV-2是开发有效疗法的关键。在之前的一项新的研究中,利用在单细胞基因组学方面的专长,北京大学北京未来基因诊断高精尖创新中心的谢晓亮团队与首都医科大学附属北京佑安医院副院长的研究人员合作,从60余名恢复期患者体内收集了血液样本,在这些血液样本中,从8558个抗原结合的IgG1+克隆型(clonotype)中筛选出14种高强效中和抗体(Cell, 2020, doi:10.1016/j.cell.2020.05.025)。作为它们中最强效的抗体,BD-368-2对SARS-CoV-2假病毒和真正的SARS-CoV-2病毒的IC50值分别为8pM和100pM。

这些研究人员利用中国医学科学院实验动物研究所秦川博士实验室开发的hACE2转基因小鼠模型,完成了中和抗体的体内抗病毒实验。实验结果显示,BD-368-2抗体对SARS-CoV-2具有较强的治疗效果和预防保护作用:将BD-368-2抗体注射到受感染的小鼠体内时,病毒载量降低了约2400倍;将BD-368-2抗体注射到未受感染的小鼠体内时,它们免受病毒感染。
然而,BD-368-2抗体中和SARS-CoV-2的机制在很大程度上是未知的。为此,在一项新的研究中,这些研究人员报道了BD-368-2与SARS-CoV-2刺突蛋白(S蛋白)三聚体复合物结合在一起时的分辨率为3.5埃的低温电镜(cryo-EM)结构,揭示出BD-368-2通过同时占据所有三个受体结合结构域(RBD)来完全阻止这种S蛋白三聚体复合物对ACE2的识别,而且不论RBD是处于“上”构象还是“下”构象,都是如此。相关研究结果于2020年9月14日在线发表在Cell期刊上,论文标题为“Structurally resolved SARS-CoV-2 antibody shows high efficacy in severely infected hamsters and provides a potent cocktail pairing strategy”。
再者,BD-368-2以低剂量和不同给药窗口可治疗受感染的成年仓鼠,而接受安慰剂处理的受感染仓鼠表现出严重的间质性肺炎。
此外,BD-368-2的表位完全避开了反复出现的VH3-53/VH3-66中和抗体的共同结合位点,与RBD的三方共晶结构也证实了这一点。
将BD-368-2与反复出现的强效中和抗体配对,可在pM水平下中和SARS-CoV-2假病毒,并拯救突变诱导的中和逃逸。
综上所述,这些研究人员合理设计了一个可导致高中和效力的新RBD表位,并证实BD-368-2在治疗COVID-19方面的治疗潜力。
4. Cell:揭示新冠病毒S蛋白RBD结构域的中和位点和免疫显性位点
doi:10.1016/j.cell.2020.09.037.
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。目前人们迫切需要一种有效的预防疫苗来对抗这种病毒。然而,目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。

SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。
分析SARS-CoV-2感染引起的中和抗体(nAb)的特异性和动力学特征对于理解免疫保护和确定用于疫苗设计的靶标至关重要。
在一项新的研究中,来自美国华盛顿大学和Vir生物技术(Vir Biotechnology)子公司Humabs Biomed SA等研究机构的研究人员在647名SARS-CoV-2感染者的队列中,发现对SARS-CoV-2刺突蛋白和核蛋白(nucleoprotein, NP)的抗体反应强度和中和抗体滴度均与临床评分相关。相关研究结果于2020年9月16日在线发表在Cell期刊上,论文标题为“Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology”。
SARS-CoV-2刺突蛋白的受体结合结构域(RBD)是免疫显性的,也是SARS-CoV-2免疫血清中存在的90%中和抗体的靶点。
尽管整体RBD特异性血清IgG滴度在半衰期为49天的情形下减弱,但是一些个体的nAb滴度和亲合力(avidity)随着时间的推移而增加,这与亲和力成熟(affinity maturation)相一致。
这些研究人员利用单克隆抗体从结构上确定RBD抗原图谱,并对不同RBD表位特异性的血清抗体进行了血清学定量,从而确定了两个主要的受体结合基序抗原位点。这些研究结果解释了受体结合基序的免疫显性,并将会指导COVID-19疫苗设计和药物开发。
5. Cell:清华大学和浙江大学联手揭示新冠病毒的分子结构
doi:10.1016/j.cell.2020.09.018.
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。疫苗是控制大流行迫切需要的必要对策。目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。

SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。在此之前,科学家们已经证实,SARS-CoV和MERS-CoV的RBD包含主要的构象依赖性中和表位,并能够在免疫动物中引起强效的中和抗体,因而是有希望的疫苗开发靶标。
尽管最近在SARS-CoV-2蛋白的结构阐明方面取得了进展,但完整病毒的详细结构仍有待揭晓。
在一项新的研究中,来自中国清华大学和浙江大学等研究机构的研究人员利用低温电子断层扫描(cryo-electron tomography, cryo-ET)和子断层扫描图平均化(subtomogram averaging, STA)技术,报道了真实的SARS-CoV-2病毒的分子结构。相关研究结果于2020年9月14日在线发表在Cell期刊上,论文标题为“Molecular architecture of the SARS-CoV-2 virus”。
这些研究人员确定了SARS-CoV-2刺突蛋白在融合前和融合后构象下的天然结构,平均分辨率为8.7~11埃。
他们利用质谱分析了天然的SARS-CoV-2刺突蛋白中的N-连接聚糖(N-linked glycan)的组成,发现这些天然N-连接聚糖的整体加工状态与重组SARS-CoV-2刺突蛋白上的聚糖加工状态高度相似。
他们揭示出SARS-CoV-2核糖核蛋白(ribonucleoprotein, RNP)的天然构象及其高阶组装体。总的来说,这些表征极其详细地揭示了SARS-CoV-2病毒的结构,并阐明了这种病毒如何将它的长达大约30 kb的单分段RNA包装在直径为大约80 nm的壳体内。
6. Cell:首次解析出致幻剂与5-HT2A血清素受体结合在一起时的三维结构
doi:10.1016/j.cell.2020.08.024.
诸如麦角酰二乙胺(LSD)、裸盖菇素(psilocybin)和墨斯卡灵(mescaline)之类的致幻剂会导致严重且往往是持久的幻觉,但是它们在治疗重度抑郁症等严重精神疾病方面显示出巨大的潜力。为了充分研究这种潜力,科学家们需要知道这些药物如何在分子水平上与脑细胞相互作用,以引起它们的引人注目的生物效应。
在一项新的研究中,美国北卡罗来纳大学教堂山分校的Bryan L. Roth博士和斯坦福大学的Georgios Skiniotis博士及其同事们朝着这个方向迈出了一大步。他们首次解析出这些致幻剂与脑细胞表面上的5-HT2A血清素受体(5-HT2A serotonin receptor, HTR2A)结合在一起时的高分辨率结构。相关研究结果发表在2020年9月17日的Cell期刊上,论文标题为“Structure of a Hallucinogen-Activated Gq-Coupled 5-HT2A Serotonin Receptor”。
这一发现已经在引导人们探索更精确的化合物,这些化合物可以消除幻觉,但仍有很强的治疗效果。此外,科学家们还可以有效地改变LSD和裸盖菇素等药物的化学成分,其中裸盖菇素是蘑菇中的致幻化合物,已被美国食品药品管理局(FDA)授予治疗抑郁症的突破性地位。

论文共同通讯作者、北卡罗来纳大学教堂山分校医学院药理学教授Bryan L. Roth博士说,“数以百万计的人为了消遣而服用这些药物,如今它们正逐渐成为治疗药物。首次了解它们在分子水平上如何发挥作用真地很重要,这是了解它们如何起作用的关键。鉴于裸盖菇素对抑郁症的显著疗效(在II期临床试验中),我们相信我们的发现将加速发现快速起效的抗抑郁药,并有可能发现治疗重度焦虑和物质使用障碍等其他疾病的新药。”
科学家们认为,HTR2A在人类大脑皮层中的表达水平非常高,它的激活是致幻药物起作用的关键。Roth说,“当激活时,这种受体会导致神经元以不同步和无序的方式放电,从而将噪音输入到大脑系统中。我们认为这是这些药物导致迷幻体验的原因。但目前还完全不清楚这些药物是如何发挥它们的治疗作用的。”
在这项新的研究中,Roth实验室与斯坦福大学医学院结构生物学家Skiniotis合作。Skiniotis说,“多项不同的研究进展的结合使得我们能够进行这项研究。其中之一是制备出更好、更均匀的5-HT2A受体蛋白。另一个是低温电镜技术(cryo-EM),它使得我们能够观察非常大的复合物,而不必让它们结晶。”
Roth表扬了他实验室的博士后研究员Kuglae Kim博士,这是因为Kim坚定不移地探索各种实验方法来纯化和稳定非常脆弱的血清素受体HTR2A。Roth说,“Kim很了不起。我毫不夸张地说,他完成的工作是最难做的事情之一。在三年的时间里,在一种慎重的、反复的、创造性的过程中,他能够稍加修改血清素蛋白,这样我们就可以得到足够数量的稳定蛋白来进行研究。”
Roth团队利用Kim的研究工作,首次揭示了LSD与HTR2A结合在一起时的X射线晶体结构。重要的是,Skiniotis及其团队随后利用低温电镜技术揭示了一种名为25-CN-NBOH的原型致幻剂与这整个受体复合物(包括效应蛋白Gαq)结合在一起时的图像。在大脑中,这个复合物控制神经递质的释放,并影响许多生物过程和神经过程。Kim利用低温电镜图像来说明HTR2A在氨基酸水平上的精确结构。
Roth和同事们如今正将他们的发现应用于基于结构的新药物发现,以便开发新的治疗药物。其中的一个目标是发现潜在的候选药物,这些候选药物可能能够在没有致幻效果的情况下提供治疗益处。
Skiniotis说,“我们对这些药物如何与HTR2A受体结合了解越多,我们就越能理解它们的信号转导特性。这项研究还没有给我们提供全貌,但是它提供了其中的相当大一部分。”
7. Nature:揭示SARS-CoV-2刺突蛋白结合人ACE2受体的结构机制
doi:10.1038/s41586-020-2772-0.
在一项新的研究中,来自英国弗朗西斯-克里克研究所的研究人员发现位于SARS-CoV-2冠状病毒表面上的刺突蛋白(S蛋白)与人类病毒受体ACE2接触时,可以采取至少十种不同的结构状态。这种对感染机制的新见解为开发疫苗和治疗方法奠定基础。相关研究结果于2020年9月17日在线发表在Nature期刊上,论文标题为“Receptor binding and priming of the spike protein of SARS-CoV-2 for membrane fusion”。
作为引起新冠肺炎(COVID-19)的冠状病毒,SARS-CoV-2的表面覆盖着S蛋白,这使得这种病毒能够感染人体细胞。当S蛋白与细胞表面受体ACE2结合,并在随后阶段催化病毒基因组释放到细胞中时,感染就开始了。然而,ACE2与SARS-CoV-2的S蛋白结合的确切性质仍然未知。
在首次对ACE2与S蛋白之间的结合机制进行整体考察的研究中,这些研究人员,对S蛋白与受体结合和感染的不同阶段相关的10种不同结构进行了表征。他们首先孵育S蛋白和ACE2的混合物,然后通过在液态乙烷中快速冷冻,捕捉不同形式的S蛋白。他们使用低温电镜技术检查这些蛋白样品,获得了数万张不同结合阶段的高分辨率图像。
他们观察到,S蛋白是以封闭和开放结构的混合物存在的。在ACE2结合一个开放位点后,S蛋白变得更加开放,导致一系列有利的构象变化,从而为进一步的结合做好准备。一旦S蛋白在所有三个结合位点上与ACE2结合,它的中央核心就会暴露出来,这可能有助于SARS-CoV-2与细胞膜融合,使得感染得以发生。
论文共同通讯作者、弗朗西斯-克里克研究所疾病过程结构生物学实验室博士后培训研究员Donald Benton说,“通过从整体角度研究结合事件,我们能够描述SARS-CoV-2特有的S蛋白结构。我们可以观察到,当S蛋白变得更加开放时,这种蛋白的稳定性会降低,这可能会增加它进行膜融合的能力,从而允许感染发生。”
这些研究人员希望,他们越能发现SARS-CoV-2与其他冠状病毒的不同之处,他们就能更有针对性地开发新的治疗方法和疫苗。
论文共同通讯作者、弗朗西斯-克里克研究所疾病过程结构生物学实验室博士后培训研究员Antoni Wrobel说,“随着我们揭开感染最早阶段的机制,我们可能会暴露出新的治疗靶点,或者了解目前现有的哪些抗病毒疗法更有可能发挥作用。”
论文共同通讯作者、弗朗西斯-克里克研究所疾病过程结构生物学实验室负责人Steve Gamblin说,“我们对SARS-CoV-2还有很多不了解的地方,但它的基本生物学包含了控制这种流行病的线索。通过了解是什么使这种病毒与众不同,我们就可以暴露出可利用的弱点。” 这些研究人员正在继续研究SARS-CoV-2和其他物种中相关冠状病毒的S蛋白结构,以更好地了解病毒感染和进化的机制。
8. Nature:揭示核小体抑制cGAS的结构机制
doi:10.1038/s41586-020-2750-6.
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。

cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作2'3'环状GMP-AMP(cGAMP)的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
作为一种DNA传感蛋白,cGAS在微生物感染、细胞应激和癌症后启动先天免疫反应。一旦被双链DNA激活后,细胞质cGAS产生cGAMP,并触发炎性细胞因子和I型干扰素(IFN)产生。
cGAS也存在于充满基因组DNA的细胞核内,在那里,染色质参与限制它的酶活性。然而,染色质抑制cGAS的结构基础仍然未知。
在一项新的研究中,来自瑞士洛桑联邦理工学院和巴塞尔大学的研究人员确定了人cGAS与核小体结合在一起时的分辨率为3.1埃的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“Structural mechanism of cGAS inhibition by the nucleosome”。
cGAS与组蛋白H2A-H2B异源二聚体的酸性口袋(acidic patch)和核小体DNA广泛接触。结构和互补生化分析还发现cGAS与第二个核小体反式结合。从机制上看,核小体结合将cGAS锁定在单体状态,在这种状态下,空间位阻抑制了基因组DNA对cGAS的错误激活。
这些研究人员发现,cGAS-酸性口袋界面上发生的突变足以在体外消除核小体对cGAS的抑制作用以及在活细胞中触发cGAS在基因组DNA上的酶活性。
这项研究揭示了cGAS与染色质相互作用的结构基础,并确定了一个令人信服的机制,从而允许cGAS对基因组DNA进行自我-非自我识别。
9. Science:揭示核小体抑制cGAS激活的结构基础
doi:10.1126/science.abd0237.
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。

cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作cGAMP的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
有人提出宿主DNA组装成核小体可限制cGAS的自动激活,但是它的基本机制尚不清楚。
在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis for the inhibition of cGAS by nucleosomes”。
这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。
总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


