4期(转移性)肺癌新药!美国FDA批准双重免疫+化疗方案(Imfinzi+Imjudo+铂类化疗):一线治疗,显著延长生存期!
来源:生物谷原创 2022-11-14 10:43
Imfinzi和Imjudo均为免疫检查点抑制剂,Imfinzi可阻断PD-L1,Imjudo可阻断CTLA-4。与化疗相比,三联方案一线治疗显著延长生存期。
图片来源:摄图网
2022年11月11日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,美国食品和药物管理局(FDA)已批准抗PD-L1疗法Imfinzi(英飞凡,通用名:durvalumab,度伐利尤单抗)联合抗CTLA-4疗法Imjudo(tremelimumab)和铂类化疗:用于治疗IV期(转移性)非小细胞肺癌(NSCLC)成人患者。在美国,肺癌是第二大常见癌症,预计2022年将确诊超过236000名患者,转移性NSCLC患者预后特别差,只有约8%的患者在确诊后5年仍然存活。
此次批准,标志着Imjudo+Imfinzi组合的第二项适应症批准。2022年10月,美国FDA已批准Imjudo联合Imfinzi:用于治疗不可切除性肝细胞癌(HCC)成人患者。这种双重免疫治疗方案,利用CTLA-4抑制的潜力,与PD-L1抑制进行独特组合,来增强机体对抗癌症的免疫应答。
此次新适应症批准基于3期POSEIDON研究的阳性结果。该研究评估了Imfinzi联合Imjudo和铂类化疗、单用铂类化疗一线治疗IV期(转移性)NSCLC成人患者的疗效和安全性。结果显示,与一系列化疗方案相比,有限疗程(5个周期)Imjudo联合Imfinzi和4个周期铂类化疗方案将死亡风险降低了23%(HR=0.77;95%CI:0.65-0.92;p=0.00304)。估计的2年存活率,联合治疗组为33%,化疗组为22%。此外,与化疗相比,联合治疗将疾病进展或死亡的风险降低了28%(HR=0.72;95%CI:0.60-0.86;p=0.00031)。
2022年欧洲肿瘤内科学会(ESMO)大会上公布的3期POSEIDON试验的最新结果显示:经过大约4年的随访,联合治疗显示出持续的生存获益,与化疗相比总生存期(OS)提高了25%(HR=0.75;95%CI:0.63-0.88)。估计的3年存活率,联合治疗组为25%,化疗组为13.6%。Imjudo联合Imfinzi和化疗方案的安全性与每种药物的已知安全性一致,未发现新的安全性信号。
根据POSEIDON研究的结果,欧洲、日本和其他几个国家也正在审查Imjudo+Imfinzi+铂类化疗方案的监管申请。
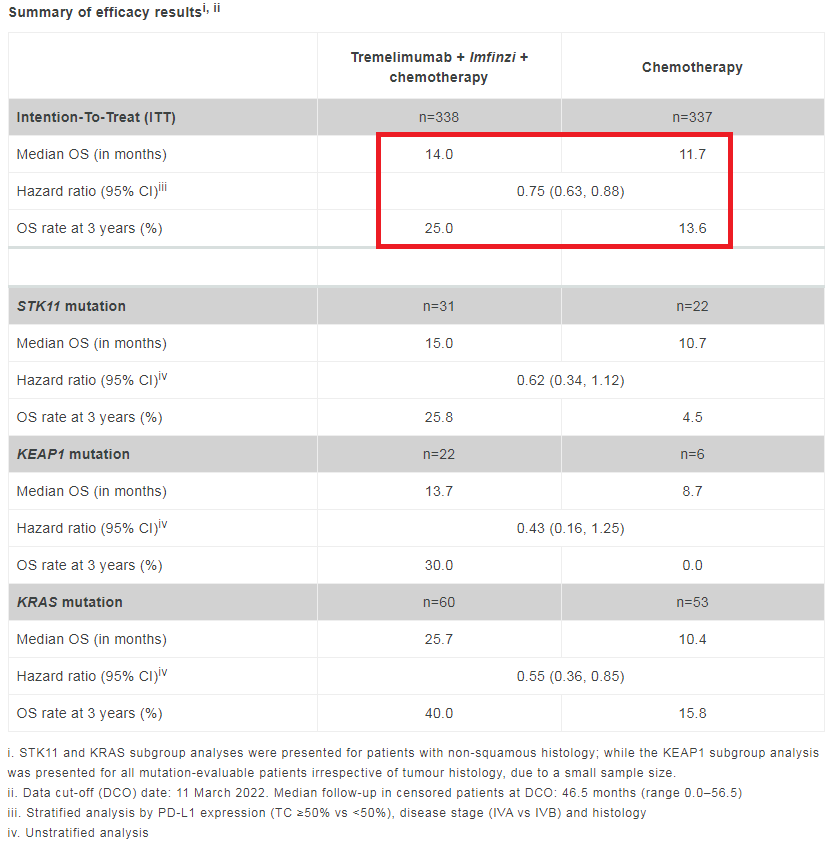
POSEIDON研究随访4年结果(图片来源:阿斯利康)
肺癌是男性和女性中癌症死亡的首要原因,约占所有癌症死亡的五分之一。肺癌大致分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC约占80-85%。在NSCLC中,患者被分类为鳞状细胞癌(约占25-30%)或非鳞状细胞癌(约占70-75%)。4期肺癌是肺癌的最晚期类型,通常被称为转移性疾病。大多数患者在确诊时癌症已转移到肺部以外。对于转移性疾病患者,预后非常差,确诊后的5年生存率约为8%。
Imfinzi(英飞凡,度伐利尤单抗)是一种人单克隆抗体,靶向结合细胞程序性死亡因子配体1(PD-L1),阻断PD-L1与PD-1和CD80的相互作用,对抗肿瘤的免疫逃避策略并释放免疫反应的抑制作用。
Imjudo活性药物成分为tremelimumab,这是一种人单克隆抗体,靶向细胞毒性T淋巴细胞抗原4(CTLA-4),阻断CTLA-4的活性、促进T细胞活化、启动肿瘤免疫反应、促进癌细胞死亡。tremelimumab与百时美施贵宝已上市抗体药物Yervoy(伊匹木单抗)靶向的是同一个靶点CTLA-4。
作为新药研发项目的一部分,Imfinzi目前正以单药或者联合Imjudo以及其它药物,探索在非小细胞肺癌、小细胞肺癌、膀胱癌、头颈癌、肝癌、宫颈癌、胆管癌和其它实体肿瘤等方向的治疗前景。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


