PLoS Biol:科学家有望开发出脱靶率更低的安全CRISPR基因编辑技术
来源:本站原创 2020-07-19 23:09
2020年7月19日 讯 /生物谷BIOON/ --CRISPR系统是一种能够靶向编辑基因组的强大工具,其具有明显的治疗潜力,然而其经常也会不恰当地编辑一些“脱靶”(off-target)位点,近日,一项刊登在国际杂志PLoS Biology上的研究报告中,来自温州医科大学等机构的科学家们通过研究表示,突变CRISPR基因编辑系统核心的酶类或许就能改善其编辑
2020年7月19日 讯 /生物谷BIOON/ --CRISPR系统是一种能够靶向编辑基因组的强大工具,其具有明显的治疗潜力,然而其经常也会不恰当地编辑一些“脱靶”(off-target)位点,近日,一项刊登在国际杂志PLoS Biology上的研究报告中,来自温州医科大学等机构的科学家们通过研究表示,突变CRISPR基因编辑系统核心的酶类或许就能改善其编辑的精准度,相关研究结果或能为基因编辑提供一种相比使用未修饰酶类系统更安全的治疗性策略。
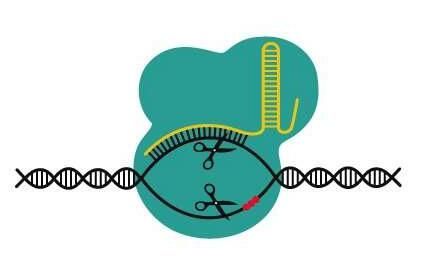
图片来源: DataBase Center for Life Science (DBCLS)
CRISPR基因编辑系统能利用Cas9酶类进行DNA的切割,而Cas9能切割几乎任何的DNA序列,其特异性源于与导向RNA(gRNA)之间的相互作用,gRNA的序列能使其通过碱基对匹配的方式来靶向作用DNA,一旦结合后,该酶类就会被激活,随后就会开启DNA的切割过程。
CRISPR系统存在于多种常用于研究的细菌物种中,而来自金黄色葡萄球菌的CRISPR系统则具有尺寸上的优势,与其它细菌不同的是,其基因小到足以能装载入一种称之为腺相关病毒的多功能无害基因疗法载体中,从而就使其在治疗目的上具有一定的吸引力。包括来自金黄色葡萄球菌在内的任何CRISPR系统的关键局限性在于其在会进行DNA的脱靶切割,导向RNA可能会与序列接近但不完全匹配的位点结合地很弱,而根据匹配的紧密程度及成对gRNA-DNA复合体相互作用的紧密程度,酶类可能会被激活并错误地切割DNA,从而产生潜在的有害后果。
为了深入研究来自金黄色葡萄球菌的Cas9是否能被修饰以高保真性来切割预期的靶点,研究人员开发了一系列新型的Cas9突变体,同时在维持预期位点较高活性的同时检测其区分不完美配对的能力,他们发现了一种突变体,其都能区分并拒绝gRNA和DNA之间的单碱基对错误匹配,无论靶点如何,这都能使保真度相比原始酶类提高了93倍;研究者表示,这种突变影响了部分的识别结构域,即酶类的特殊区域,该区域能协调酶类和gRNA-DNA复合体之间的接触,这种突变可能会削弱这些接触,从而就能确保只有来自完美序列匹配的最强配对才能够触发酶类活性。
最后研究者Gu表示,避免脱靶切割是利用CRISPR开发疾病治疗性手段过程中所面临的关键挑战,比如纠正遗传性疾病或靶向作用癌细胞等,本文研究结果或能帮助研究人员开发潜在安全的基因疗法策略。(生物谷Bioon.com)
原始出处:
Xie H, Ge X, Yang F, et al.High-fidelity SaCas9 identified by directional screening in human cells. PLoS Biology (2020) 18(7): e3000747. doi:10.1371/journal.pbio.3000747
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


