近期科学家们在癌症复发研究领域取得的新进展!
来源:本站原创 2021-10-29 08:30
复发一直是科学家们在癌症研究领域所面临的巨大挑战,近年来科学家们投入了大量精力来阐明多种癌症复发背后的机制,本文中,小编整理了近期科学家们在癌症复发研究领域取得的新进展,与大家一起学习!
复发一直是科学家们在癌症研究领域所面临的巨大挑战,近年来科学家们投入了大量精力来阐明多种癌症复发背后的机制,本文中,小编整理了近期科学家们在癌症复发研究领域取得的新进展,与大家一起学习!
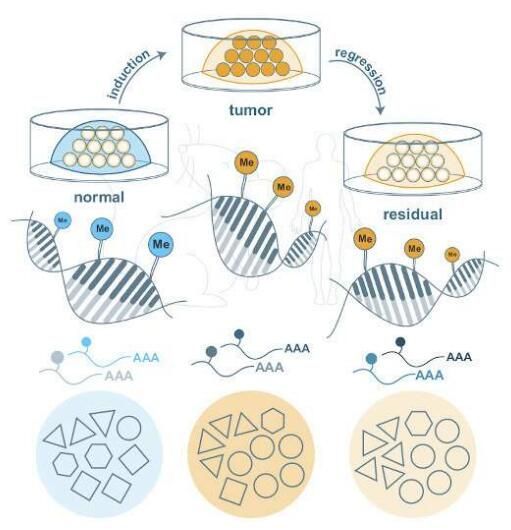
代谢记忆或在乳腺癌复发过程中扮演着关键角色。
图片来源:DOI:10.15252/msb.202010141
doi:10.15252/msb.202010141
大多数与乳腺癌相关的死亡都是由对疗法耐受细胞(最小的残留性疾病,MRD)引起的肿瘤复发所导致的,然而,定义其恶性程度的分子特征在很大程度上研究人员并不清楚。近日,一篇发表在国际杂志Molecular Systems Biology上题为“Metabolic memory underlying minimal residual disease in breast cancer”的研究报告中,来自欧洲分子生物学实验室等机构的科学家们通过分析对原有疗法耐受的肿瘤细胞,识别出了能有效预防乳腺癌复发的疗法的分子靶点。
最近在早期检测和靶向性疗法开发上的研究进展使得科学家们成功治疗乳腺癌的机会越来越多,中通常是通过沉默驱动肿瘤的爱因并引发肿瘤消退来实现的;然而,在初次治疗后有一小部分的肿瘤细胞会存活下来,这或许会让研究人员面临着巨大挑战,因为这类细胞会导致20%-40%的患者在几年甚至几十年后出现疾病复发,而且会非常难以治疗。这篇研究报告中,研究人员所得到的研究结果或有望帮助开发出有效预防乳腺癌复发并改善患者生活质量的新型疗法。
癌基因表达水平的生长与多种癌症发生直接相关,这是由其突变或对其表达的控制过程发生改变所致;在肿瘤发生过程中参与癌基因表达水平升高的主要过程之一就是DNA甲基化水平的改变,即甲基基团附着到DNA上会导致基础基因表达发生改变;研究人员对在初始疗法中存活的一小部分细胞(MRD)进行甲基化的改变分析,MRD能在相当长的休眠期后进行增殖,并引发癌症发生不可治愈的复发。通过在乳腺癌小鼠模型中应用先进的数据集中化技术并整合不同水平的细胞行为,研究人员就能将MRD细胞的代谢和甲基化水平与原始肿瘤细胞和正常健康细胞的相同过程进行对比。
【2】Cancer Cell:通过检测样本中的游离DNA来指示小儿髓母细胞瘤复发的迹象
doi:10.1016/j.ccell.2021.09.012
髓母细胞瘤(成神经管细胞瘤,medulloblastoma)是小脑发生的一种恶性胚胎性肿瘤,近三分之一的患儿都会死于这种癌症;通过成像和脑脊液对患者进行常规反应的监测目前对于科学家们而言仍然具有一定的挑战性,而且还缺乏可测量残余疾病(MRD,measurable residual disease)的标志物。近日,一篇发表在国际杂志Cancer Cell上题为“Serial assessment of measurable residual disease in medulloblastoma liquid biopsies”的研究报告中,来自圣犹大儿童研究医院等机构的科学家们通过研究表明,来自脑脊液中的游离DNA或能被用来检测接受髓母细胞瘤患儿机体中的可测量的残留物疾病。研究人员开发出了一种针对MRD的检测技术,其或能检测患儿疾病复发的风险,这要比利用传统成像扫描来确定复发时间更早一些。
针对髓母细胞瘤患者,疗法结束时的成像结果有助于帮助评估其是否存在疾病复发的可能性,然而截至目前为止,并没有一种确定的检测技术能判断患儿并未患此种疾病;因此,临床医生并不知道哪些患者已经被治愈以及哪些患者会复发,但他们知道有高达三分之一的患者可能会出现疾病复发。
MDR指的是在患者进行癌症疗法期间以及之后机体中所存在的肿瘤细胞,检测这些肿瘤细胞或标志物(比如游离DNA)对于确定患者疾病复发的早期风险以及在患者疾病复发之间将其消灭都至关重要。研究者Giles Robinson说道,我们在病人停止治疗的前几年经常会对其进行疾病扫描,但很不幸的是,当我们在扫描过程中发现疾病复发时,患者已经有很多疾病了;复发的髓母细胞瘤患者预后极差,对于许多患者而言这时候治疗已经太晚了;因此研究人员就想通过研究寻找到一种方法来确定是否患儿在停止接受治疗时其机体中真正已经清除了疾病。
有了这种新型检测技术,研究者就知道了,如果在治疗结束时患儿的脑脊液中存在髓母细胞瘤的游离DNA的话,那么这名患者可能就会出现疾病复发的情况,这或许就能及时让研究人员采取措施,在癌症有机会复发或重现时就对其进行清除;作为髓母细胞瘤标准疗法的一部分,患儿需要接受连续的脊髓穿刺来检测疾病,这是治疗小儿脑瘤的特有手段,而小儿脑瘤更有可能会通过脑脊液来发生扩散。游离DNA并不会受到细胞膜的束缚,而是会漂浮在血浆或脑脊液中;这样一来,研究人员就能在SJMB03研究中利用来自髓母细胞瘤患者的脑脊液样本来寻找是否有游离DNA的存在,进而来指示MRD的存在,而这些试验样本能作为对患者必要护理的一部分来进行收集。
【3】Nature子刊:热量可控的CAR-T细胞可破坏实体瘤并阻止癌症复发
doi:10.1038/s41551-021-00781-2
一种称为CAR-T细胞疗法的革命性免疫疗法已在引发肿瘤治疗变革。科学家们正在不断扩大CAR-T细胞疗法的精确度和能力。CAR-T细胞疗法已被患者、临床研究人员、投资者和媒体誉为治疗某些癌症的可行方法。
这是一个新的、蓬勃发展的免疫疗法领域,目前全世界有500多项临床试验正在分析CAR-T细胞的癌症治疗。CAR-T细胞疗法涉及在实验室里对从患者体内提取的T细胞进行基因改造,使之表达特异性识别癌细胞的嵌合抗原受体(CAR),然后将这些定制的CAR-T细胞输注回相同患者体内,在那里它们寻找并摧毁癌细胞。这就是它的作用机制。
美国佐治亚理工学院生物医学工程系副教授Gabe Kwong说,“这类免疫疗法已被证明对液体肿瘤---即在血液中循环的肿瘤,如白血病---的患者非常有效。不幸的是,对于实体瘤---肉瘤、癌瘤---它们的效果并不理想。有许多不同的原因。一个巨大的问题是,CAR-T细胞受到肿瘤微环境的免疫抑制。”
在一项新的研究中,Kwong和他的合作者改变肿瘤微环境,并对他们自己的细胞进行一些修改,以加强CAR-T细胞对抗癌症的方式。他们在CAR-T细胞中加入了一个基因开关,并开发了一个遥控系统,将这些经过基因改造的T细胞精确地送入肿瘤微环境中,在那里它们杀死肿瘤并防止复发。相关研究结果于2021年8月12日在线发表在Nature Biomedical Engineering期刊上,论文标题为“Enhanced intratumoural activity of CAR T cells engineered to produce immunomodulators under photothermal control”。
这项新的研究建立在Kwong实验室探索远程控制细胞疗法的工作基础上,在之前的这些工作中,他们通过局部的热量沉积可以精确地靶向肿瘤,无论它们在身体的什么地方。Kwong说,“这种热量基本上激活了肿瘤内的CAR-T细胞,克服了免疫抑制的问题。”
在早期的研究中,这些作者没有对肿瘤进行临床治疗,但是他们如今正在通过这项新的研究针对这一点进行研究。为了在小鼠的肿瘤中产生热量,他们从这些动物的身体外将激光脉冲照射到肿瘤所在的位置。递送到肿瘤上的金纳米棒将光波转化为局部的温和热量,将温度提高到40~42摄氏度(104~107.6华氏度),刚好足以激活CAR-T细胞的这个基因开关,但不会热到损害健康组织和这些经过基因改造的T细胞。一旦开启,CAR-T细胞就开始工作,增加抗癌蛋白质的表达。
Kwong说,真正的创新之处在于对临床级别的CAR-T细胞进行基因改造,这也是该团队在过去三年里所做的事情。如今,除了对热量作出反应的开关外,他们还对CAR-T细胞进行了一些升级,将它们重新连接起来,以产生刺激免疫系统的分子。这些强效的、经过设计的蛋白分子(细胞因子和双特异性T细胞衔接蛋白)的局部产生必须得到精确控制。
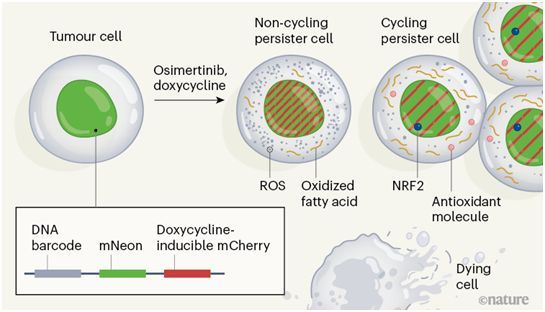
一种分析肿瘤中持久性细胞的方法。
图片来源:Nature, 2021, doi:10.1038/d41586-021-02117-1。
【4】Nature:重大进展!揭示循环持久性细胞促进癌症复发机制
doi:10.1038/s41586-021-03796-6
大多数癌症相关死亡不是发生在患者第一次患肿瘤时,而是发生在治疗几个月或几年后癌症复发时。科学家们认为,一组罕见的癌细胞,即持久性细胞(persister cell),可能促成了这种复发。持久性细胞只占癌细胞的一小部分;正如它们的名字所暗示的那样,尽管有药物治疗,它们仍然存在,可以在体内生存足够长的时间,获得新的突变,使它们能够逃避药物,并最终推动肿瘤的复发生长。
如今,在一项新的研究中,来自美国哈佛医学院和布罗德研究所的研究人员发现一小部分持久性细胞,即循环持久性细胞(cycling persister cell),不仅在暴露于癌症药物时能够存活,而且即使在不断的药物治疗下也能保持生长和增殖的能力。在这项新的研究中,他们开发了一种新的系统来追踪这些细胞,并用单细胞基因组学对它们进行分析。该分析确定了可能使这些细胞对治疗产生抗性的关键特征以及它们用来生长的生化途径。相关研究结果于2021年8月11日在线发表在Nature期刊上,论文标题为“Cycling cancer persister cells arise from lineages with distinct programs”。
这些研究结果可能有助于解释为什么这么多在实验室里显示有希望的癌症治疗方法在临床试验中遭遇失败。这些作者指出,靶向这些持久性细胞的新疗法可能可以延迟或最终阻止疾病复发。
论文共同通讯作者、哈佛医学院细胞生物学教授Joan Brugge说,“这项研究让我们对药物治疗后细胞状态的动态变化有了前所未有的了解。这种信息对于制定预防治疗抗性的策略至关重要,毕竟治疗抗性严重限制了当今大多数靶向治疗的有效性。”
论文第一作者、布罗德研究所博士后研究员Yaara Oren说,“我们希望我们的研究将提供一个垫脚石,帮助科学家们开始确定针对复发患者的治疗方法。”
【5】Nat Cancer:中德美科学家揭示化疗诱导的突变导致ALL白血病复发
doi:10.1038/s43018-021-00230-8
化疗有助于使急性淋巴细胞白血病(ALL)成为最容易存活的儿童癌症之一。如今,来自中国上海交通大学医学院、美国圣犹大儿童研究医院和德国柏林夏里特医学院的研究人员展示了称为硫嘌呤的化疗药物如何导致突变,从而使患者复发。这项研究为儿童癌症提供了第一个直接的基因组学和实验证据,表明耐药性突变可以由化疗诱发,而且在确诊时并不总是存在。相关研究结果于2021年7月22日在线发表在Nature Cancer期刊上,论文标题为“Chemotherapy and mismatch repair deficiency cooperate to fuel TP53 mutagenesis and ALL relapse”。
Zhang说,“这些发现为理解耐药性如何产生提供了观念上的根本变化。这些结果还为复发的ALL患者提出了可能的治疗策略,包括筛选出那些应该避免额外硫嘌呤治疗的患者。”虽然在圣犹大儿童研究医院,94%的ALL患者存活了5年,但复发仍然是全世界ALL儿童和青少年患者死亡的主要原因。
这项研究涉及从美国、中国和德国的复发儿童ALL患者中收集ALL样本。这些作者分析了在治疗的不同时期从患者身上收集的1000多份样本,包括在确诊、缓解和复发时收集的181名患者的样本。论文共同第一作者、圣犹大儿童研究医院计算生物学系的Samuel Brady博士确定了有助于破译这一过程的突变特征(mutational signature),其中突变特征反映了细胞中基因变化的历史。
这些作者将硫嘌呤诱导的突变增加与白血病中发生突变的基因(比如MSH2)联系起来。这些突变使一种叫做错配修复的DNA修复过程失活,并使ALL对硫嘌呤产生耐药性。这让ALL的突变增加了10倍,包括肿瘤抑制基因TP53的改变。一种称为TP53 R248Q的突变促进了对多种化疗药物的耐药性,包括长春新碱(vincristine)、柔红霉素(daunorubicin)和阿糖胞苷(cytarabine)。
【6】Cell:揭示一种罕见的以前未知的巨噬细胞与治疗后的肾癌复发有关
doi:10.1016/j.cell.2021.04.038
与其他癌症相比,肾癌的免疫特性非常突出:与大多数其他实体瘤相比,有更多的免疫细胞浸润肾癌,而且肾癌是对当今免疫治疗方案反应最强烈的恶性肿瘤之一。然而,尽管进行了治疗,许多肾透明细胞癌(clear cell renal carcinoma,最常见的肾癌类型)患者最终还是会复发,并出现无法治愈的转移性疾病。在一项新的研究中,美国研究人员发现肾脏肿瘤中存在一种罕见的、以前未知的免疫细胞类型,可以预测哪些患者在手术后可能会出现癌症复发。这些细胞甚至可能驱动侵袭性疾病。这些结果表明这些细胞的存在可能用来识别手术后疾病复发的高风险患者,这些患者可能是更积极的治疗的候选对象。相关研究结果于2021年5月20日在线发表在Cell期刊上,论文标题为“Single-cell protein activity analysis identifies recurrence-associated renal tumor macrophages”。
虽然肾脏肿瘤被免疫细胞密集浸润,但免疫细胞亚型及其与术后预后的关系在很大程度上仍是未知数。为了揭示浸润肾癌的免疫细胞的精细细节,这些作者结合了癌症研究中的两种最新技术。
第一种技术,称为单细胞RNA测序,捕获了肿瘤内单个细胞的基因活性快照。这种高通量技术使得人们能够在一次实验中从一种肿瘤的数万个细胞中获得这种快照,从而深入了解各种细胞类型的身份和行为。
这种强大的技术可以识别新的细胞类型,但也有一个缺点。因为单细胞测序是通过检测每个细胞内的少量mRNA分子来工作的,它往往不能检测到表达水平低的基因的mRNA,包括关键信号基因和药物靶点,如免疫疗法检查点。在许多实验中,单细胞RNA测序会遗漏高达90%的基因活性,这种现象被称为基因丢弃(gene dropout)。
这些作者通过开发一种预测算法来解决基因丢弃问题,该算法可以通过查看其他相关基因的表达来推断哪些基因是活跃的。即使由于基因丢弃导致很多数据丢失,他们仍然有足够的线索来推断上游调节基因的活性。
该算法被称为meta-VIPER,建立在哥伦比亚大学瓦格洛斯内外科学院的Andrea Califano实验室开发的VIPER算法的基础上。随着metaVIPER的加入,这些作者估计他们可以准确地检测出每个细胞中70%至80%的调节基因的活性,消除了细胞中的基因丢弃现象。
【7】JCO:CD19-CAR-T细胞治疗后的异基因造血干细胞移植可阻止相当一部分B-ALL患者出现疾病复发
doi:10.1200/JCO.20.02262
嵌合抗原受体(CAR)T细胞(CAR-T)免疫疗法将患者自身的T细胞进行基因改造,使之更有效地杀死癌症。靶向CD19的CAR-T细胞(下称CD19-CAR-T)在儿童和青少年(children and young adult, CAYA)B细胞急性淋巴细胞白血病(B-ALL)患者(下称CAYA B-ALL患者)中给送28天后,其缓解率高达100%。但是,有限的数据表明,复发的人数相当多。之前的一项研究发现,超过40%的人在13.1个月后复发。CD19-CAR-T细胞治疗后的异基因造血干细胞移植(alloHSCT)在改善B-ALL CAYA 患者的长期临床结果中的作用尚未被研究。
在一项新的研究中,来自美国国家癌症研究所和弗吉尼亚大学等研究机构的研究人员在复发性或难治性CAYA B-ALL患者中进行了自体CD19.28ζ-CAR-T细胞的I期临床试验。他们评估了与疾病和治疗变量相关的反应和长期临床结果。相关研究结果近期发表在Journal of Clinical Oncology期刊上,论文标题为“Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL”。
在这项临床试验中,50名B-ALL CAYA 患者(中位年龄,13.5岁;范围,4.3-30.4)接受了CD19.28ζ-CAR-T细胞治疗。在这50名患者中,31人(62.0%)实现完全缓解,其中的28人(90.3%)经流式细胞仪检查为微小残留病(minimal residual disease)阴性。与基于非氟达拉滨(fludarabine)/环磷酰胺(cyclophosphamide)的淋巴细胞清除(2/8,25%;P=0.041)相比,基于氟达拉滨/环磷酰胺的淋巴细胞清除与疾病缓解率的提高相关(29/42,69%)。
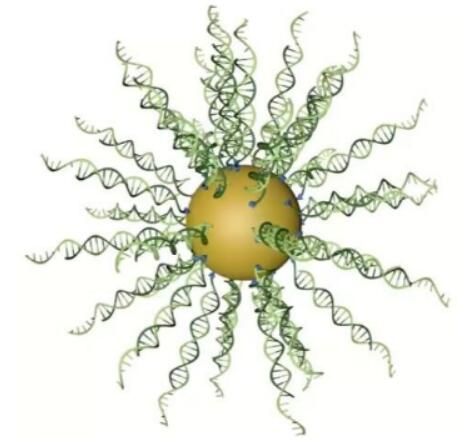
图片来源:Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abb3945。
【8】Science子刊:新型球形核酸高效穿过血脑屏障,有望治疗复发性胶质母细胞瘤
doi:10.1126/scitranslmed.abb3945
胶质母细胞瘤(GBM)是最难有效治疗的癌症之一,部分原因是缺乏精准疗法,而且由于血脑屏障和血肿瘤屏障的存在,进入颅内肿瘤部位的治疗途径有限。在一项新的研究中,来自美国西北大学的研究人员开发出一种用于GBM治疗的精准疗法,该疗法涉及使用基于脑渗透RNA干扰的球形核酸(spherical nucleic acid, SNA),SNA由与呈放射状排列并密集排列的小干扰RNA(siRNA)寡核苷酸共价偶联的金纳米颗粒核组成。相关研究结果发表在2021年3月10日的Science Translational Medicine期刊上,论文标题为“A first-in-human phase 0 clinical study of RNA interference–based spherical nucleic acids in patients with recurrent glioblastoma”。
在以往临床前评价的基础上,这些作者在称为食蟹猴的非人灵长类动物中进行了毒理学和毒代动力学研究,并进行了单臂、开放标签的首次人体临床试验(NCT03020017),以确定系统性给送携带GBM癌基因Bcl2Like12(Bcl2L12)特异性siRNA的SNA的安全性、药代动力学、瘤内积累和基因抑制活性。
8名复发性GBM患者接受静脉注射siBcl2L12-SNA(药物代号:NU-0129)治疗,剂量相当于未观察到不良反应水平的1/50,然后进行肿瘤切除。安全性评估显示没有4级或5级治疗相关毒副作用。对切除的GBM组织的电感耦合等离子体质谱分析、X射线荧光显微镜观察和银染色表明,静脉给送的SNA到达患者肿瘤,并且在肿瘤相关的内皮细胞、巨噬细胞和肿瘤细胞中观察到金的富集。
【9】Sci Transl Med:新发现!机体的压力激素或会促进休眠的癌细胞苏醒引起癌症复发!
doi:10.1126/scitranslmed.abb5817
近日,一篇发表在国际杂志Science Translational Medicine上的研究报告中,来自美国、德国等国家的科学家们通过联合研究发现,天然的压力激素或会再度激活小鼠机体中休眠的癌细胞,相关研究结果或有望帮助开发治疗癌症的新型疗法。
如今医学科学家们已经通过很多年的研究尝试理解为何癌变肿瘤有时仍然会在最初成功治疗后的多年发生复发,这项研究中,研究人员就发现证据表明,当休眠的癌细胞被患者机体的压力激素唤醒时,癌症复发就会发生。此前研究结果表明,当癌变肿瘤开始生长时,某些细胞就会移动到其它附近的位点并进入一种休眠的状态,由于这些细胞位置较远且处于休眠状态,其似乎并不太可能会被外科手术或化疗杀灭或移除。
此前研究结果表明,诸如此类休眠的细胞会突然苏醒并开始生长形成新的肿瘤,有时甚至会发生患者治疗后的数年后;文章中,研究人员阐明了休眠癌细胞发生再度复苏的分子机制,其罪魁祸首就是机体的压力激素,比如去甲肾上腺素等。通过将这类激素注射到携带休眠癌细胞的小鼠体内并观察这些细胞的苏醒以及其如何开始增殖,研究者还发现,如果给予β阻滞剂(减弱激素所表达的蛋白水平),被检测的小鼠就不太可能会从苏醒的癌细胞中形成新的肿瘤了。
【10】Nat Med:I期临床试验表明双特异性CD19/CD20 CAR-T细胞有望治疗复发性B细胞恶性肿瘤
doi:10.1126/scitranslmed.abf2636
嵌合抗原受体(CAR)T细胞(CAR-T)疗法被认为是治疗多种类型肿瘤的突破性技术。非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)和慢性淋巴细胞白血病(CLL)是两种CD19阳性的B细胞癌症,已经用识别CD19的CAR-T细胞进行治疗。虽然CD19是位于B细胞表面上的经典分子,但是仅靶向CD19会导致它的表达下调的方法经常遭遇治疗失败。
为了克服这一局限性,Shah等人在一项新的研究中利用一种自动化细胞处理平台开发出双特异性靶向CD19和CD20的CAR-T细胞(下称CD19/CD20 CAR-T细胞)疗法。这项研究是一项1期剂量递增和扩大临床试验。在这项临床试验中,利用这些双特异性CAR-T细胞治疗NHL或CLL患者。基于此,本临床研究中纳入了26名此前经历多次抗B细胞治疗而遭遇失败的患者。
总的来说,这种双特异性CAR-T细胞疗法被认为在治疗上是安全的。分别有64%和32%的患者出现细胞因子释放综合征和神经毒性。总体反应率为82%,12名接受高剂量、新鲜制备的CD19/CD20 CAR-T细胞的患者均有反应。相反,43%接受低温保存CD19/CD20 CAR-T细胞的患者遭遇治疗失败。这表明,使用新鲜制备的CD19/CD20 CAR-T细胞可能是治疗成功的关键。最后,3名患者对这种治疗没有反应。所有无应答者均表现出高水平的循环CAR-T细胞,这提示着存在抗原刺激,但是这些CAR-T细胞的杀伤活性明显下降。(生物谷Bioon.com)
更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



