阿尔兹海默症研究进展
来源:本站原创 2019-05-20 23:11
2019年5月21日 讯 /生物谷BIOON/ --本期为大家带来的是阿尔兹海默症领域的最新研究进展,希望读者朋友们能够喜欢。1. Nat Commun:人工智能促进阿尔兹海默症的研究DOI: 10.1038/s41467-019-10212-1加州大学戴维斯分校和加州大学旧金山分校的研究人员已经找到了一种方法来训练计算机精确检测人类大脑组织中阿尔茨海默病的生物标志物。淀粉样斑块是阿尔茨海默病患者
2019年5月21日 讯 /生物谷BIOON/ --本期为大家带来的是阿尔兹海默症领域的最新研究进展,希望读者朋友们能够喜欢。
1. Nat Commun:人工智能促进阿尔兹海默症的研究
DOI: 10.1038/s41467-019-10212-1

加州大学戴维斯分校和加州大学旧金山分校的研究人员已经找到了一种方法来训练计算机精确检测人类大脑组织中阿尔茨海默病的生物标志物。
淀粉样斑块是阿尔茨海默病患者大脑中蛋白质碎片的团块,可破坏神经细胞的连接。加州大学科学家团队开发的机器学习工具可以“看到”脑组织样本是否有一种类型的淀粉样蛋白斑块,并且很快就能完成。
该研究结果于5月15日发表在Nature Communications上,表明机器学习可以增强专家神经病理学家的专业知识和分析。该工具允许他们分析数千倍的数据,并提出即使是训练有素的人类专家的有限数据处理能力也无法实现的新问题。
“我们仍然需要病理学家,”加州大学戴维斯分校加州大学戴维斯分校病理学和检验医学系助理教授,该研究的主要作者布列塔尼N. Dugger博士说。 “这是一个工具,就像键盘一样用于写作。由于键盘有助于编写工作流程,数字病理学与机器学习相结合可以帮助进行神经病理学工作流程。”
在这项研究中,她与加州大学旧金山分校神经退行性疾病研究所和药物化学系助理教授Michael J. Keizer博士合作,确定他们是否可以教一台计算机来自动识别和分析微小淀粉样蛋白斑块的繁琐过程。各种类型的大片尸检人脑组织。对于这项工作,Keiser和他的团队设计了一个“卷积神经网络”(CNN),这是一个计算机程序,旨在识别基于数千个人类标记示例的模式。
为了创建足够的训练样例来教授CNN算法Dugger如何分析脑组织,UCSF团队与她合作设计了一种方法,允许她快速注释或标记来自50万个特写图像的数万张图像。来自43个健康和患病大脑样本的组织。
UCSF团队使用这个数以万计的标记示例图像数据库来训练他们的CNN机器学习算法,以识别阿尔茨海默病中所见的不同类型的大脑变化。这包括区分所谓的核心和弥漫性斑块以及识别血管异常。研究人员表明,他们的算法可以处理整个脑片切片,准确率为98.7%,速度仅受他们使用的计算机处理器数量的限制。 然后,该团队对计算机的识别技能进行了严格的测试,以确保其分析具有生物学上的有效性。
DOI: 10.1007/s00401-019-02013-z
近年来,研究人员越来越清楚,蛋白质galectin-3参与大脑的炎症发生。由瑞典隆德大学研究人员领导的一项研究现在显示了这种蛋白质在阿尔茨海默病中的关键作用。当研究人员关闭在小鼠中产生这种蛋白质的基因时,阿尔茨海默氏菌斑块的数量和炎症负荷都会下降。
相关研究发表在《Acta Neuropathologica》杂志上,该研究强调了相关蛋白galectin-3作为阿尔茨海默病的关键参与者的情况。除其他外,阿尔茨海默病涉及细胞外淀粉样斑块的积累和tau蛋白在神经细胞内形成肿块。当我们的先天免疫防御系统发现斑块时,大脑的免疫反应被激活。正是在这种机制中,半乳糖凝集素-3蛋白似乎发挥了重要作用。
研究人员研究的蛋白质是由大脑的小胶质细胞产生的,它们对大脑的免疫系统的护理包括清除积聚在大脑中的有害蛋白质。在大脑中斑块形成的情况下,似乎需要galectin-3来激活小神经胶质细胞。“我们发现这种炎症蛋白在患有阿尔茨海默病的已故患者的大脑中增加了十倍,我们尤其在小胶质细胞中发现它在淀粉样蛋白斑块周围积聚,”Antonio Boza-Serrano说。
在帕金森病中,半乳糖凝集素-3也参与炎症的发生。据研究人员称,从药物的角度来看,这种蛋白质在健康的大脑中几乎检测不到,但在炎症的情况下增加是好的,因为他们不想冒一种影响细胞的药物的风险,而不是那些特别负责细胞发育的药物。疾病。通过使用阻止蛋白质在炎症中活性的抑制剂确实可以减缓半乳糖凝集素-3的作用。“我们已经证明,通过去除半乳糖凝集素-3,我们可以减少小鼠斑块和炎症的数量,但我们还没有研究这是否适用于人类。有充分的理由继续并进一步研究这一点。虽然它是对患者来说还有很长的路要走,我们希望我们的研究结果也可以为人们今后治疗阿尔茨海默病提供治疗,“Tomas Deierborg说。
3. Nature:首次对阿尔茨海默病进行单细胞转录组分析
doi:10.1038/s41586-019-1195-2.

在美国,阿尔茨海默病影响了500多万人。在一项新的研究中,来自美国麻省理工学院的研究人员首次对阿尔茨海默病患者的单个脑细胞中表达的基因进行了综合分析。所获得的分析结果允许他们鉴定出在神经元和其他类型的脑细胞中受到影响的独特细胞通路。这一分析可能为阿尔茨海默病提供许多潜在的新型药物靶点。相关研究结果于2019年5月1日在线发表在Nature期刊上,论文标题为“Single-cell transcriptomic analysis of Alzheimer’s disease”。
论文共同通讯作者、麻省理工学院计算机科学与人工智能实验室的Manolis Kellis教授说道,“在我看来,这项研究提供了首张图谱来研究在阿尔茨海默病中在每种细胞类型中发生了变化的所有分子过程,我们如今能够可靠地对这些细胞进行描述。它开启了一个了解阿尔茨海默病的全新时代。”
这项研究显示,阿尔茨海默病患者的轴突髓鞘形成过程受到严重破坏。这些研究人员还发现,男性和女性的脑细胞在他们的基因对这种疾病的反应方式上存在显著的差异。
单细胞分析
这些研究人员分析了24名表现出高水平阿尔茨海默病病理学特征的人和24名具有相似年龄的没有这些疾病迹象的人的尸检大脑样本。所有受试者都是“宗教秩序研究(Religious Orders Study)”的一部分,其中宗教秩序研究是一项关于衰老和阿尔茨海默病的纵向研究。他们还获得了这些受试者在认知测试中作出表现的数据。
这些研究人员对来自这些受试者的大约8万个细胞进行了单细胞RNA测序。论文共同通讯作者、麻省理工学院皮考尔学习与记忆研究所主任Li-Huei Tsai说道,之前对阿尔茨海默病患者基因表达的研究已测量了一部分脑组织的总体RNA水平,但是它们都没有区分不同细胞类型之间的差别,这就可能掩盖丰度较小的细胞类型中发生的变化。
她说,“我们想知道我们是否可以区分每种细胞类型在健康的脑组织和患病的脑组织之间具有不同的基因表达模式。这是单细胞水平分析的强大功能:人们能够真正看到大脑中所有不同细胞类型之间的差异。”
通过使用单细胞测序方法,这些研究人员不仅能够分析最丰富的细胞类型,包括兴奋性和抑制性神经元,而且还能分析稀有的非神经元脑细胞,如少突胶质细胞、星形胶质细胞和小胶质细胞。他们发现,这些细胞类型中的每一种在阿尔茨海默病患者中都表现出明显的基因表达差异。
一最重要的变化发生在与轴突再生和髓鞘形成相关的基因中。髓鞘是一种让轴突保持电隔离的脂肪鞘,有助于这些轴突传递电信号。这些研究人员发现,在患有阿尔茨海默病的个体中,与髓鞘形成相关的基因在神经元和少突胶质细胞(产生髓鞘的细胞)中都受到影响。
大多数这些细胞类型特异性的基因表达变化发生在这种疾病的发展早期。在后期阶段,这些研究人员发现大多数细胞类型具有非常相似的基因表达变化模式。具体而言,大多数脑细胞激活了与应激反应、程序性细胞死亡以及维持蛋白完整性所需的细胞复合物相关的基因。
性别差异
这些研究人员还发现了基因表达模式与阿尔茨海默氏症严重程度的其他指标(淀粉样斑块和神经原纤维缠结的水平)以及认知障碍之间的相关性。这允许他们能够鉴定出似乎与这种疾病的不同方面相关的基因“模块”。
论文共同第一作者、麻省理工学院博士后研究员Hansruedi Mathys说道,“为了鉴定出这些模块,我们设计了一种新策略,它涉及使用人工神经网络,这让我们能够以一种完全无偏见的数据驱动方式了解一系列与阿尔茨海默病不同方面相关的基因。我们预计这种策略对鉴定与其他脑部疾病相关的基因模块也很有价值。”
这些研究人员说道,最令人吃惊的发现是发现了男性和女性阿尔茨海默病患者的脑细胞之间的巨大差异。他们发现,男性患者的兴奋性神经元和其他脑细胞在阿尔茨海默病中表现出的基因表达变化并不如女性患者中的那么显著,即使这些患者确实表现出相似的症状,包括淀粉样蛋白斑和认知障碍。相比之下,来自女性患者的脑细胞在阿尔茨海默病中显示出更严重的基因表达变化,以及更多的发生变化的通路。
Tsai说,“当我们意识到有一些非常有趣的事情发生时。我们感到非常震惊。”
到目前为止,尚不清楚为何存在这种差异。在产生髓磷脂的少突胶质细胞中,这种性别差异尤为明显,因此这些研究人员对患者的白质进行了分析,这种白质主要由有髓鞘的轴突组成。通过对参与宗教秩序研究的另外500名受试者进行一组核磁共振成像(MRI)扫描,他们发现,有严重记忆缺陷的女性受试者的白质损伤程度要远远高于匹配的男性受试者。
这些研究人员表示,还需要开展更多的研究来确定为什么男性和女性对阿尔茨海默病的反应如此不同,而且这些研究结果可能会对开发和选择治疗方法产生影响。
论文共同第一作者、麻省理工学院博士后研究员Jose Davila-Velderrain说道,“越来越多的临床和临床前证据表明阿尔茨海默病易感性存在性别差异,但是它的内在机制是未知的。我们的研究指出了与非神经元成髓鞘细胞(non-neuronal myelinating cell)相关的细胞过程变化潜在地发挥着作用。确定这些差异是否仅在一种性别中保护或损害脑细胞---以及如何在另一种性别中按照预期的方向对这种反应加以平衡将是其中的关键。”
这些研究人员如今正在使用小鼠和人诱导性多能干细胞模型来进一步研究他们在这项研究中鉴定出的与阿尔茨海默病相关的一些关键细胞通路,包括那些参与髓鞘形成的通路。他们还计划对与阿尔茨海默病有关的其他形式的痴呆症以及诸如精神分裂症、双相情感障碍、精神病和多种痴呆症等其他脑部疾病开展类似的基因表达分析。
4. ADDADM:新研究开发阿尔兹海默症的早期血液检测
DOI: 10.1016/j.dadm.2019.01.008

阿尔茨海默病是痴呆症的最常见原因,只有在大脑中形成典型的斑块后才能检测到。此时进行治疗似乎不再可能。然而,阿尔茨海默氏症引起的第一次变化很快就会在蛋白质水平上发生。在波鸿鲁尔大学(RUB)开发的双层方法可以在更早的阶段帮助检测疾病。
“这为早期治疗方法铺平了道路,在这种方法中,我们寄予希望的低效药物可能证明是有效的,”RUB生物物理系的Klaus Gerwert教授说。
5. Science子刊:开发一种用于阿尔茨海默早期诊断症的血液测试
DOI: 10.1126/sciadv.aav1388
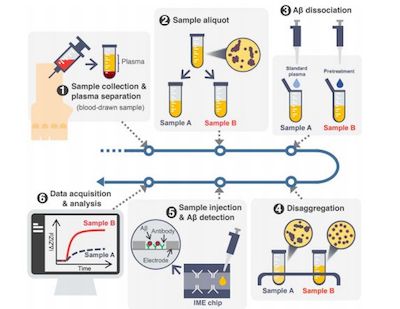
韩国多家机构的一个大型研究团队开发了一种全新的血液检测方法,可以在尚未出现症状的早期阶段检测出老年痴呆症患者。在这篇发表于《Science Advances》杂志上的论文中,该小组描述了他们的研究以及他们开发的检测这种疾病的技术。
阿尔茨海默氏症是一种进行性疾病,涉及大脑神经元退化,导致各种症状,最显著的是记忆力丧失。它是无法治愈的,那些受折磨的人最终都会死去。科学家们多年来一直在研究阿尔茨海默病,并了解了一个发生在这样的病人的大脑中的现象:淀粉样β蛋白肽(Aβ)的积累。
虽然对可能的治疗方法的研究仍在继续,但在症状出现之前,人们也在努力寻找一种诊断这种疾病的方法。先前的研究已经表明Aβ能够从大脑进入到血液中,这表明血液测试可能是一种检测这种疾病的方法。不幸的是,这个想法还没有成功,因为没有办法确定血液中的Aβ水平是否可以反应阿尔茨海默病已经开始。
在这个新的工作中,研究人员认为他们已经找到一种方法来改变血液样本中的Aβ以揭示Aβ的存在。研究人员发现,如果一个被称为EPPS的小分子是添加到Aβ浓度一定的溶液中,这些分子会迫使它们分开。这让他们产生了一个想法:从被诊断出患有这种疾病的患者身上提取破碎的样本,与对照组进行对比,看看是否存在差异。
研究人员报告说,他们的技术能够可靠地区分确诊的病人和对照组的病人。他们还表明,这项技术可以作为一种监测疾病进展的方法。据报道,他们已经制定计划,让医生在临床实践中用他们的技术。
6. Cell:操纵SKN-1A的蛋白序列编辑有望治疗阿尔茨海默病等神经退行性疾病
doi:10.1016/j.cell.2019.03.035.
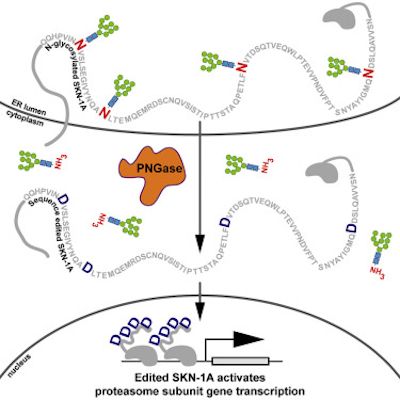
在一项新的研究中,来自美国麻省总医院的研究人员发现细胞通过编辑一种关键的传感蛋白的氨基酸序列来感知蛋白酶体功能障碍并以一种之前未描述的方式作出反应的机制。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Controls Proteasome Gene Expression”。
作为一种降解不需要的或者有缺陷的蛋白的细胞组分,蛋白酶体由约20种蛋白组成,这些蛋白形成一种结构,在这种结构中,不需要的细胞蛋白以一种以受到高度调节的方式被处理掉。蛋白酶体功能障碍可导致异常蛋白的沉积,这种异常蛋白的沉积是阿尔茨海默病等神经退行性疾病的特征,也可在正常衰老中观察到。
为了应对蛋白酶体功能障碍,健康细胞增加蛋白酶体的蛋白组分的产生。两年前,麻省总医院的Gary Ruvkun博士和Nicolas Lehrbach博士已鉴定出包括转录因子SKN-1A在内的一系列传感和信号传导蛋白允许秀丽隐杆线虫中的细胞检测蛋白酶体功能障碍并对此作出反应。在这项新的研究中,Ruvkun及其团队描述了SKN-1A及其哺乳动物同源蛋白Nrf1是如何通过添加一种称为聚糖的糖分子进行修饰的,这种修饰在细胞分泌的蛋白中是比较常见的,但在DNA结合调控蛋白中是很少见的。
在正常情况下,SKN-1A/Nrf1被蛋白酶体有效降解,这就使得这种蛋白成为蛋白酶体功能的一种天然的监测者。如果蛋白的过量聚集超过蛋白酶体的处理能力,那么SKN-1A/Nrf1就不会遭受完全降解,就与蛋白酶体基因附近的DNA结合,从而诱导额外的蛋白酶体产生直到这种蛋白再次被充分降解。
2016年,Lehrbach和Ruvkun已证实SKN-1A/Nrf1的活化需要对这种蛋白进行酶促切割以及添加和随后去除聚糖分子。但是,这些事件的功能意义尚不清楚。在这项新的研究中,他们发现这种从SKN-1A中移除聚糖分子的蛋白--- PNG-1---不仅移除了这些聚糖分子,而且还编辑了SKN-1A中的氨基酸序列:将4个天冬酰胺残基转化为天冬氨酸。如果将天冬酰胺转化为一种不同的氨基酸,那么SKN-1A就会出现功能障碍。在PNG-1不存在下,通过基因手段导入天冬氨酸分子也可激活SKN-1A,这表明这种蛋白序列编辑而不是去糖基化是SKN-1A发挥功能的关键。这种新发现的通过氨基酸序列编辑控制蛋白酶体功能的机制代表了内源性蛋白的一种前所未有的翻译后修饰。
这些研究人员还发现,通过基因工程手段让SKN-1A过度活化,因而在遗传上将4个去糖基化的天冬酰胺改变为天冬氨酸,这对蛋白酶体维持和抗逆性产生显著影响。过度活跃的SKN-1A赋予对蛋白酶体抑制剂的极强抵抗力,并有效地“治愈”阿尔茨海默病线虫模型。
这些研究人员指出这一发现在癌症、衰老、神经退行性疾病和一种罕见的涉及蛋白NGLY1(线虫蛋白PNG-1的人类同源蛋白,它影响着很多神经细胞的功能)突变的人类疾病中具有重要的应用。在这项新的以秀丽隐杆线虫为研究对象的研究中,他们取得的发现表明这种人类疾病还涉及未能将Nrf1中的糖分子修饰的天冬酰胺编辑成天冬氨酸,从而使得蛋白酶体未能对蛋白聚集做出反应。采取对这些天冬酰胺进行预编辑的干预措施可能重新激活受影响患者的蛋白酶体基因。
Lehrbach说,“迄今为止,我们还不明白为何SKN-1A/Nrf1的序列编辑是它调节蛋白酶体基因表达所必需的。更深入的机制理解可能有助于开发治疗NGLY1缺乏症和其他神经退行性疾病的方法。寻找受到去糖基化依赖性序列编辑调控的其他蛋白也将是令人关注的。”(生物谷Bioon.com)
1. Nat Commun:人工智能促进阿尔兹海默症的研究
DOI: 10.1038/s41467-019-10212-1

加州大学戴维斯分校和加州大学旧金山分校的研究人员已经找到了一种方法来训练计算机精确检测人类大脑组织中阿尔茨海默病的生物标志物。
淀粉样斑块是阿尔茨海默病患者大脑中蛋白质碎片的团块,可破坏神经细胞的连接。加州大学科学家团队开发的机器学习工具可以“看到”脑组织样本是否有一种类型的淀粉样蛋白斑块,并且很快就能完成。
该研究结果于5月15日发表在Nature Communications上,表明机器学习可以增强专家神经病理学家的专业知识和分析。该工具允许他们分析数千倍的数据,并提出即使是训练有素的人类专家的有限数据处理能力也无法实现的新问题。
“我们仍然需要病理学家,”加州大学戴维斯分校加州大学戴维斯分校病理学和检验医学系助理教授,该研究的主要作者布列塔尼N. Dugger博士说。 “这是一个工具,就像键盘一样用于写作。由于键盘有助于编写工作流程,数字病理学与机器学习相结合可以帮助进行神经病理学工作流程。”
在这项研究中,她与加州大学旧金山分校神经退行性疾病研究所和药物化学系助理教授Michael J. Keizer博士合作,确定他们是否可以教一台计算机来自动识别和分析微小淀粉样蛋白斑块的繁琐过程。各种类型的大片尸检人脑组织。对于这项工作,Keiser和他的团队设计了一个“卷积神经网络”(CNN),这是一个计算机程序,旨在识别基于数千个人类标记示例的模式。
为了创建足够的训练样例来教授CNN算法Dugger如何分析脑组织,UCSF团队与她合作设计了一种方法,允许她快速注释或标记来自50万个特写图像的数万张图像。来自43个健康和患病大脑样本的组织。
UCSF团队使用这个数以万计的标记示例图像数据库来训练他们的CNN机器学习算法,以识别阿尔茨海默病中所见的不同类型的大脑变化。这包括区分所谓的核心和弥漫性斑块以及识别血管异常。研究人员表明,他们的算法可以处理整个脑片切片,准确率为98.7%,速度仅受他们使用的计算机处理器数量的限制。 然后,该团队对计算机的识别技能进行了严格的测试,以确保其分析具有生物学上的有效性。
DOI: 10.1007/s00401-019-02013-z

近年来,研究人员越来越清楚,蛋白质galectin-3参与大脑的炎症发生。由瑞典隆德大学研究人员领导的一项研究现在显示了这种蛋白质在阿尔茨海默病中的关键作用。当研究人员关闭在小鼠中产生这种蛋白质的基因时,阿尔茨海默氏菌斑块的数量和炎症负荷都会下降。
相关研究发表在《Acta Neuropathologica》杂志上,该研究强调了相关蛋白galectin-3作为阿尔茨海默病的关键参与者的情况。除其他外,阿尔茨海默病涉及细胞外淀粉样斑块的积累和tau蛋白在神经细胞内形成肿块。当我们的先天免疫防御系统发现斑块时,大脑的免疫反应被激活。正是在这种机制中,半乳糖凝集素-3蛋白似乎发挥了重要作用。
研究人员研究的蛋白质是由大脑的小胶质细胞产生的,它们对大脑的免疫系统的护理包括清除积聚在大脑中的有害蛋白质。在大脑中斑块形成的情况下,似乎需要galectin-3来激活小神经胶质细胞。“我们发现这种炎症蛋白在患有阿尔茨海默病的已故患者的大脑中增加了十倍,我们尤其在小胶质细胞中发现它在淀粉样蛋白斑块周围积聚,”Antonio Boza-Serrano说。
在帕金森病中,半乳糖凝集素-3也参与炎症的发生。据研究人员称,从药物的角度来看,这种蛋白质在健康的大脑中几乎检测不到,但在炎症的情况下增加是好的,因为他们不想冒一种影响细胞的药物的风险,而不是那些特别负责细胞发育的药物。疾病。通过使用阻止蛋白质在炎症中活性的抑制剂确实可以减缓半乳糖凝集素-3的作用。“我们已经证明,通过去除半乳糖凝集素-3,我们可以减少小鼠斑块和炎症的数量,但我们还没有研究这是否适用于人类。有充分的理由继续并进一步研究这一点。虽然它是对患者来说还有很长的路要走,我们希望我们的研究结果也可以为人们今后治疗阿尔茨海默病提供治疗,“Tomas Deierborg说。
3. Nature:首次对阿尔茨海默病进行单细胞转录组分析
doi:10.1038/s41586-019-1195-2.

在美国,阿尔茨海默病影响了500多万人。在一项新的研究中,来自美国麻省理工学院的研究人员首次对阿尔茨海默病患者的单个脑细胞中表达的基因进行了综合分析。所获得的分析结果允许他们鉴定出在神经元和其他类型的脑细胞中受到影响的独特细胞通路。这一分析可能为阿尔茨海默病提供许多潜在的新型药物靶点。相关研究结果于2019年5月1日在线发表在Nature期刊上,论文标题为“Single-cell transcriptomic analysis of Alzheimer’s disease”。
论文共同通讯作者、麻省理工学院计算机科学与人工智能实验室的Manolis Kellis教授说道,“在我看来,这项研究提供了首张图谱来研究在阿尔茨海默病中在每种细胞类型中发生了变化的所有分子过程,我们如今能够可靠地对这些细胞进行描述。它开启了一个了解阿尔茨海默病的全新时代。”
这项研究显示,阿尔茨海默病患者的轴突髓鞘形成过程受到严重破坏。这些研究人员还发现,男性和女性的脑细胞在他们的基因对这种疾病的反应方式上存在显著的差异。
单细胞分析
这些研究人员分析了24名表现出高水平阿尔茨海默病病理学特征的人和24名具有相似年龄的没有这些疾病迹象的人的尸检大脑样本。所有受试者都是“宗教秩序研究(Religious Orders Study)”的一部分,其中宗教秩序研究是一项关于衰老和阿尔茨海默病的纵向研究。他们还获得了这些受试者在认知测试中作出表现的数据。
这些研究人员对来自这些受试者的大约8万个细胞进行了单细胞RNA测序。论文共同通讯作者、麻省理工学院皮考尔学习与记忆研究所主任Li-Huei Tsai说道,之前对阿尔茨海默病患者基因表达的研究已测量了一部分脑组织的总体RNA水平,但是它们都没有区分不同细胞类型之间的差别,这就可能掩盖丰度较小的细胞类型中发生的变化。
她说,“我们想知道我们是否可以区分每种细胞类型在健康的脑组织和患病的脑组织之间具有不同的基因表达模式。这是单细胞水平分析的强大功能:人们能够真正看到大脑中所有不同细胞类型之间的差异。”
通过使用单细胞测序方法,这些研究人员不仅能够分析最丰富的细胞类型,包括兴奋性和抑制性神经元,而且还能分析稀有的非神经元脑细胞,如少突胶质细胞、星形胶质细胞和小胶质细胞。他们发现,这些细胞类型中的每一种在阿尔茨海默病患者中都表现出明显的基因表达差异。
一最重要的变化发生在与轴突再生和髓鞘形成相关的基因中。髓鞘是一种让轴突保持电隔离的脂肪鞘,有助于这些轴突传递电信号。这些研究人员发现,在患有阿尔茨海默病的个体中,与髓鞘形成相关的基因在神经元和少突胶质细胞(产生髓鞘的细胞)中都受到影响。
大多数这些细胞类型特异性的基因表达变化发生在这种疾病的发展早期。在后期阶段,这些研究人员发现大多数细胞类型具有非常相似的基因表达变化模式。具体而言,大多数脑细胞激活了与应激反应、程序性细胞死亡以及维持蛋白完整性所需的细胞复合物相关的基因。
性别差异
这些研究人员还发现了基因表达模式与阿尔茨海默氏症严重程度的其他指标(淀粉样斑块和神经原纤维缠结的水平)以及认知障碍之间的相关性。这允许他们能够鉴定出似乎与这种疾病的不同方面相关的基因“模块”。
论文共同第一作者、麻省理工学院博士后研究员Hansruedi Mathys说道,“为了鉴定出这些模块,我们设计了一种新策略,它涉及使用人工神经网络,这让我们能够以一种完全无偏见的数据驱动方式了解一系列与阿尔茨海默病不同方面相关的基因。我们预计这种策略对鉴定与其他脑部疾病相关的基因模块也很有价值。”
这些研究人员说道,最令人吃惊的发现是发现了男性和女性阿尔茨海默病患者的脑细胞之间的巨大差异。他们发现,男性患者的兴奋性神经元和其他脑细胞在阿尔茨海默病中表现出的基因表达变化并不如女性患者中的那么显著,即使这些患者确实表现出相似的症状,包括淀粉样蛋白斑和认知障碍。相比之下,来自女性患者的脑细胞在阿尔茨海默病中显示出更严重的基因表达变化,以及更多的发生变化的通路。
Tsai说,“当我们意识到有一些非常有趣的事情发生时。我们感到非常震惊。”
到目前为止,尚不清楚为何存在这种差异。在产生髓磷脂的少突胶质细胞中,这种性别差异尤为明显,因此这些研究人员对患者的白质进行了分析,这种白质主要由有髓鞘的轴突组成。通过对参与宗教秩序研究的另外500名受试者进行一组核磁共振成像(MRI)扫描,他们发现,有严重记忆缺陷的女性受试者的白质损伤程度要远远高于匹配的男性受试者。
这些研究人员表示,还需要开展更多的研究来确定为什么男性和女性对阿尔茨海默病的反应如此不同,而且这些研究结果可能会对开发和选择治疗方法产生影响。
论文共同第一作者、麻省理工学院博士后研究员Jose Davila-Velderrain说道,“越来越多的临床和临床前证据表明阿尔茨海默病易感性存在性别差异,但是它的内在机制是未知的。我们的研究指出了与非神经元成髓鞘细胞(non-neuronal myelinating cell)相关的细胞过程变化潜在地发挥着作用。确定这些差异是否仅在一种性别中保护或损害脑细胞---以及如何在另一种性别中按照预期的方向对这种反应加以平衡将是其中的关键。”
这些研究人员如今正在使用小鼠和人诱导性多能干细胞模型来进一步研究他们在这项研究中鉴定出的与阿尔茨海默病相关的一些关键细胞通路,包括那些参与髓鞘形成的通路。他们还计划对与阿尔茨海默病有关的其他形式的痴呆症以及诸如精神分裂症、双相情感障碍、精神病和多种痴呆症等其他脑部疾病开展类似的基因表达分析。
4. ADDADM:新研究开发阿尔兹海默症的早期血液检测
DOI: 10.1016/j.dadm.2019.01.008

阿尔茨海默病是痴呆症的最常见原因,只有在大脑中形成典型的斑块后才能检测到。此时进行治疗似乎不再可能。然而,阿尔茨海默氏症引起的第一次变化很快就会在蛋白质水平上发生。在波鸿鲁尔大学(RUB)开发的双层方法可以在更早的阶段帮助检测疾病。
“这为早期治疗方法铺平了道路,在这种方法中,我们寄予希望的低效药物可能证明是有效的,”RUB生物物理系的Klaus Gerwert教授说。
5. Science子刊:开发一种用于阿尔茨海默早期诊断症的血液测试
DOI: 10.1126/sciadv.aav1388

韩国多家机构的一个大型研究团队开发了一种全新的血液检测方法,可以在尚未出现症状的早期阶段检测出老年痴呆症患者。在这篇发表于《Science Advances》杂志上的论文中,该小组描述了他们的研究以及他们开发的检测这种疾病的技术。
阿尔茨海默氏症是一种进行性疾病,涉及大脑神经元退化,导致各种症状,最显著的是记忆力丧失。它是无法治愈的,那些受折磨的人最终都会死去。科学家们多年来一直在研究阿尔茨海默病,并了解了一个发生在这样的病人的大脑中的现象:淀粉样β蛋白肽(Aβ)的积累。
虽然对可能的治疗方法的研究仍在继续,但在症状出现之前,人们也在努力寻找一种诊断这种疾病的方法。先前的研究已经表明Aβ能够从大脑进入到血液中,这表明血液测试可能是一种检测这种疾病的方法。不幸的是,这个想法还没有成功,因为没有办法确定血液中的Aβ水平是否可以反应阿尔茨海默病已经开始。
在这个新的工作中,研究人员认为他们已经找到一种方法来改变血液样本中的Aβ以揭示Aβ的存在。研究人员发现,如果一个被称为EPPS的小分子是添加到Aβ浓度一定的溶液中,这些分子会迫使它们分开。这让他们产生了一个想法:从被诊断出患有这种疾病的患者身上提取破碎的样本,与对照组进行对比,看看是否存在差异。
研究人员报告说,他们的技术能够可靠地区分确诊的病人和对照组的病人。他们还表明,这项技术可以作为一种监测疾病进展的方法。据报道,他们已经制定计划,让医生在临床实践中用他们的技术。
6. Cell:操纵SKN-1A的蛋白序列编辑有望治疗阿尔茨海默病等神经退行性疾病
doi:10.1016/j.cell.2019.03.035.

在一项新的研究中,来自美国麻省总医院的研究人员发现细胞通过编辑一种关键的传感蛋白的氨基酸序列来感知蛋白酶体功能障碍并以一种之前未描述的方式作出反应的机制。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Controls Proteasome Gene Expression”。
作为一种降解不需要的或者有缺陷的蛋白的细胞组分,蛋白酶体由约20种蛋白组成,这些蛋白形成一种结构,在这种结构中,不需要的细胞蛋白以一种以受到高度调节的方式被处理掉。蛋白酶体功能障碍可导致异常蛋白的沉积,这种异常蛋白的沉积是阿尔茨海默病等神经退行性疾病的特征,也可在正常衰老中观察到。
为了应对蛋白酶体功能障碍,健康细胞增加蛋白酶体的蛋白组分的产生。两年前,麻省总医院的Gary Ruvkun博士和Nicolas Lehrbach博士已鉴定出包括转录因子SKN-1A在内的一系列传感和信号传导蛋白允许秀丽隐杆线虫中的细胞检测蛋白酶体功能障碍并对此作出反应。在这项新的研究中,Ruvkun及其团队描述了SKN-1A及其哺乳动物同源蛋白Nrf1是如何通过添加一种称为聚糖的糖分子进行修饰的,这种修饰在细胞分泌的蛋白中是比较常见的,但在DNA结合调控蛋白中是很少见的。
在正常情况下,SKN-1A/Nrf1被蛋白酶体有效降解,这就使得这种蛋白成为蛋白酶体功能的一种天然的监测者。如果蛋白的过量聚集超过蛋白酶体的处理能力,那么SKN-1A/Nrf1就不会遭受完全降解,就与蛋白酶体基因附近的DNA结合,从而诱导额外的蛋白酶体产生直到这种蛋白再次被充分降解。
2016年,Lehrbach和Ruvkun已证实SKN-1A/Nrf1的活化需要对这种蛋白进行酶促切割以及添加和随后去除聚糖分子。但是,这些事件的功能意义尚不清楚。在这项新的研究中,他们发现这种从SKN-1A中移除聚糖分子的蛋白--- PNG-1---不仅移除了这些聚糖分子,而且还编辑了SKN-1A中的氨基酸序列:将4个天冬酰胺残基转化为天冬氨酸。如果将天冬酰胺转化为一种不同的氨基酸,那么SKN-1A就会出现功能障碍。在PNG-1不存在下,通过基因手段导入天冬氨酸分子也可激活SKN-1A,这表明这种蛋白序列编辑而不是去糖基化是SKN-1A发挥功能的关键。这种新发现的通过氨基酸序列编辑控制蛋白酶体功能的机制代表了内源性蛋白的一种前所未有的翻译后修饰。
这些研究人员还发现,通过基因工程手段让SKN-1A过度活化,因而在遗传上将4个去糖基化的天冬酰胺改变为天冬氨酸,这对蛋白酶体维持和抗逆性产生显著影响。过度活跃的SKN-1A赋予对蛋白酶体抑制剂的极强抵抗力,并有效地“治愈”阿尔茨海默病线虫模型。
这些研究人员指出这一发现在癌症、衰老、神经退行性疾病和一种罕见的涉及蛋白NGLY1(线虫蛋白PNG-1的人类同源蛋白,它影响着很多神经细胞的功能)突变的人类疾病中具有重要的应用。在这项新的以秀丽隐杆线虫为研究对象的研究中,他们取得的发现表明这种人类疾病还涉及未能将Nrf1中的糖分子修饰的天冬酰胺编辑成天冬氨酸,从而使得蛋白酶体未能对蛋白聚集做出反应。采取对这些天冬酰胺进行预编辑的干预措施可能重新激活受影响患者的蛋白酶体基因。
Lehrbach说,“迄今为止,我们还不明白为何SKN-1A/Nrf1的序列编辑是它调节蛋白酶体基因表达所必需的。更深入的机制理解可能有助于开发治疗NGLY1缺乏症和其他神经退行性疾病的方法。寻找受到去糖基化依赖性序列编辑调控的其他蛋白也将是令人关注的。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


