Cell:操纵SKN-1A的蛋白序列编辑有望治疗阿尔茨海默病等神经退行性疾病
来源:本站原创 2019-04-22 21:23
2019年4月22日讯/生物谷BIOON/---在一项新的研究中,来自美国麻省总医院的研究人员发现细胞通过编辑一种关键的传感蛋白的氨基酸序列来感知蛋白酶体功能障碍并以一种之前未描述的方式作出反应的机制。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Co
2019年4月22日讯/生物谷BIOON/---在一项新的研究中,来自美国麻省总医院的研究人员发现细胞通过编辑一种关键的传感蛋白的氨基酸序列来感知蛋白酶体功能障碍并以一种之前未描述的方式作出反应的机制。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Controls Proteasome Gene Expression”。
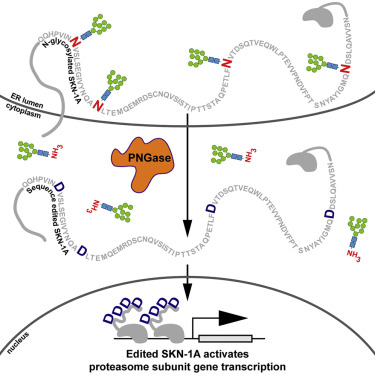
作为一种降解不需要的或者有缺陷的蛋白的细胞组分,蛋白酶体由约20种蛋白组成,这些蛋白形成一种结构,在这种结构中,不需要的细胞蛋白以一种以受到高度调节的方式被处理掉。蛋白酶体功能障碍可导致异常蛋白的沉积,这种异常蛋白的沉积是阿尔茨海默病等神经退行性疾病的特征,也可在正常衰老中观察到。
为了应对蛋白酶体功能障碍,健康细胞增加蛋白酶体的蛋白组分的产生。两年前,麻省总医院的Gary Ruvkun博士和Nicolas Lehrbach博士已鉴定出包括转录因子SKN-1A在内的一系列传感和信号传导蛋白允许秀丽隐杆线虫中的细胞检测蛋白酶体功能障碍并对此作出反应。在这项新的研究中,Ruvkun及其团队描述了SKN-1A及其哺乳动物同源蛋白Nrf1是如何通过添加一种称为聚糖的糖分子进行修饰的,这种修饰在细胞分泌的蛋白中是比较常见的,但在DNA结合调控蛋白中是很少见的。
在正常情况下,SKN-1A/Nrf1被蛋白酶体有效降解,这就使得这种蛋白成为蛋白酶体功能的一种天然的监测者。如果蛋白的过量聚集超过蛋白酶体的处理能力,那么SKN-1A/Nrf1就不会遭受完全降解,就与蛋白酶体基因附近的DNA结合,从而诱导额外的蛋白酶体产生直到这种蛋白再次被充分降解。
2016年,Lehrbach和Ruvkun已证实SKN-1A/Nrf1的活化需要对这种蛋白进行酶促切割以及添加和随后去除聚糖分子。但是,这些事件的功能意义尚不清楚。在这项新的研究中,他们发现这种从SKN-1A中移除聚糖分子的蛋白--- PNG-1---不仅移除了这些聚糖分子,而且还编辑了SKN-1A中的氨基酸序列:将4个天冬酰胺残基转化为天冬氨酸。如果将天冬酰胺转化为一种不同的氨基酸,那么SKN-1A就会出现功能障碍。在PNG-1不存在下,通过基因手段导入天冬氨酸分子也可激活SKN-1A,这表明这种蛋白序列编辑而不是去糖基化是SKN-1A发挥功能的关键。这种新发现的通过氨基酸序列编辑控制蛋白酶体功能的机制代表了内源性蛋白的一种前所未有的翻译后修饰。
这些研究人员还发现,通过基因工程手段让SKN-1A过度活化,因而在遗传上将4个去糖基化的天冬酰胺改变为天冬氨酸,这对蛋白酶体维持和抗逆性产生显著影响。过度活跃的SKN-1A赋予对蛋白酶体抑制剂的极强抵抗力,并有效地“治愈”阿尔茨海默病线虫模型。
这些研究人员指出这一发现在癌症、衰老、神经退行性疾病和一种罕见的涉及蛋白NGLY1(线虫蛋白PNG-1的人类同源蛋白,它影响着很多神经细胞的功能)突变的人类疾病中具有重要的应用。在这项新的以秀丽隐杆线虫为研究对象的研究中,他们取得的发现表明这种人类疾病还涉及未能将Nrf1中的糖分子修饰的天冬酰胺编辑成天冬氨酸,从而使得蛋白酶体未能对蛋白聚集做出反应。采取对这些天冬酰胺进行预编辑的干预措施可能重新激活受影响患者的蛋白酶体基因。
Lehrbach说,“迄今为止,我们还不明白为何SKN-1A/Nrf1的序列编辑是它调节蛋白酶体基因表达所必需的。更深入的机制理解可能有助于开发治疗NGLY1缺乏症和其他神经退行性疾病的方法。寻找受到去糖基化依赖性序列编辑调控的其他蛋白也将是令人关注的。”(生物谷 Bioon.com)
参考资料:
Nicolas J. Lehrbach et al. Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Controls Proteasome Gene Expression. Cell, 2019, doi:10.1016/j.cell.2019.03.035.

图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.035。
作为一种降解不需要的或者有缺陷的蛋白的细胞组分,蛋白酶体由约20种蛋白组成,这些蛋白形成一种结构,在这种结构中,不需要的细胞蛋白以一种以受到高度调节的方式被处理掉。蛋白酶体功能障碍可导致异常蛋白的沉积,这种异常蛋白的沉积是阿尔茨海默病等神经退行性疾病的特征,也可在正常衰老中观察到。
为了应对蛋白酶体功能障碍,健康细胞增加蛋白酶体的蛋白组分的产生。两年前,麻省总医院的Gary Ruvkun博士和Nicolas Lehrbach博士已鉴定出包括转录因子SKN-1A在内的一系列传感和信号传导蛋白允许秀丽隐杆线虫中的细胞检测蛋白酶体功能障碍并对此作出反应。在这项新的研究中,Ruvkun及其团队描述了SKN-1A及其哺乳动物同源蛋白Nrf1是如何通过添加一种称为聚糖的糖分子进行修饰的,这种修饰在细胞分泌的蛋白中是比较常见的,但在DNA结合调控蛋白中是很少见的。
在正常情况下,SKN-1A/Nrf1被蛋白酶体有效降解,这就使得这种蛋白成为蛋白酶体功能的一种天然的监测者。如果蛋白的过量聚集超过蛋白酶体的处理能力,那么SKN-1A/Nrf1就不会遭受完全降解,就与蛋白酶体基因附近的DNA结合,从而诱导额外的蛋白酶体产生直到这种蛋白再次被充分降解。
2016年,Lehrbach和Ruvkun已证实SKN-1A/Nrf1的活化需要对这种蛋白进行酶促切割以及添加和随后去除聚糖分子。但是,这些事件的功能意义尚不清楚。在这项新的研究中,他们发现这种从SKN-1A中移除聚糖分子的蛋白--- PNG-1---不仅移除了这些聚糖分子,而且还编辑了SKN-1A中的氨基酸序列:将4个天冬酰胺残基转化为天冬氨酸。如果将天冬酰胺转化为一种不同的氨基酸,那么SKN-1A就会出现功能障碍。在PNG-1不存在下,通过基因手段导入天冬氨酸分子也可激活SKN-1A,这表明这种蛋白序列编辑而不是去糖基化是SKN-1A发挥功能的关键。这种新发现的通过氨基酸序列编辑控制蛋白酶体功能的机制代表了内源性蛋白的一种前所未有的翻译后修饰。
这些研究人员还发现,通过基因工程手段让SKN-1A过度活化,因而在遗传上将4个去糖基化的天冬酰胺改变为天冬氨酸,这对蛋白酶体维持和抗逆性产生显著影响。过度活跃的SKN-1A赋予对蛋白酶体抑制剂的极强抵抗力,并有效地“治愈”阿尔茨海默病线虫模型。
这些研究人员指出这一发现在癌症、衰老、神经退行性疾病和一种罕见的涉及蛋白NGLY1(线虫蛋白PNG-1的人类同源蛋白,它影响着很多神经细胞的功能)突变的人类疾病中具有重要的应用。在这项新的以秀丽隐杆线虫为研究对象的研究中,他们取得的发现表明这种人类疾病还涉及未能将Nrf1中的糖分子修饰的天冬酰胺编辑成天冬氨酸,从而使得蛋白酶体未能对蛋白聚集做出反应。采取对这些天冬酰胺进行预编辑的干预措施可能重新激活受影响患者的蛋白酶体基因。
Lehrbach说,“迄今为止,我们还不明白为何SKN-1A/Nrf1的序列编辑是它调节蛋白酶体基因表达所必需的。更深入的机制理解可能有助于开发治疗NGLY1缺乏症和其他神经退行性疾病的方法。寻找受到去糖基化依赖性序列编辑调控的其他蛋白也将是令人关注的。”(生物谷 Bioon.com)
参考资料:
Nicolas J. Lehrbach et al. Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Controls Proteasome Gene Expression. Cell, 2019, doi:10.1016/j.cell.2019.03.035.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


