CAR-T细胞疗法研究进展(第33期)
来源:生物谷原创 2022-11-30 15:42
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Blood:新研究揭示CAR-T细胞治疗后出现癌症复发的多发性骨髓瘤患者的治疗选择
doi:10.1182/blood.2022017848
在一项新的研究中,来自美国西奈山伊坎医学院和纪念斯隆-凯特琳癌症中心的研究人员确定了能够帮助接受CAR-T细胞治疗后出现癌症复发的多发性骨髓瘤患者的疗法。相关研究结果于2022年11月3日在线发表在Blood期刊上,论文标题为“Interventions and outcomes of multiple myeloma patients receiving salvage treatment after BCMA-directed CAR T therapy”。
在这项新的研究中,这些作者研究了一大群多发性骨髓瘤患者,他们在接受一种名为靶向BCMA的CAR-T细胞疗法治疗后复发时,被给予了几种不同的治疗方法。这种CAR-T细胞疗法靶向癌变浆细胞表面上的BCMA蛋白,以对抗多发性骨髓瘤。
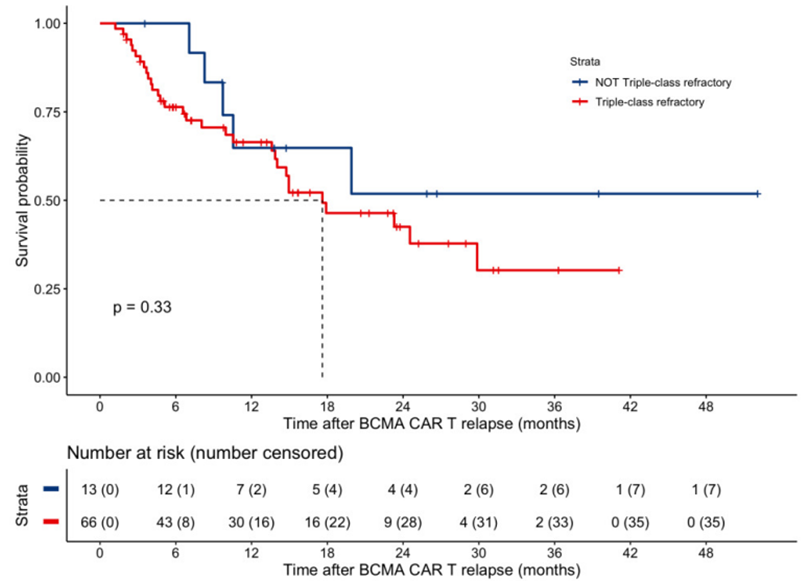
在靶向BCMA的CAR-T细胞疗法治疗后出现癌症复发的时间。图片来自Blood, 2022, doi:10.1182/blood.2022017848。
这些作者发现,其他基于T细胞的疗法,包括双特异性抗体和其他类型的CAR-T细胞疗法,似乎在最长时间内抑制这些复发患者的癌症方面取得了最显著的成功。
论文通讯作者、西奈山伊坎医学院的Samir Parekh博士说,“这项新研究的结果将为开展未来旨在改善CAR-T治疗后出现病情恶化的患者预后的前瞻性临床研究奠定基础。它是首次报告了对靶向BCMA的CAR-T细胞疗法治疗后出现癌症复发的大队列患者给予不同治疗方案的结果。这是骨髓瘤患者最迫切和未满足的需求之一,因此,血液学界对此非常感兴趣。”
2.Science子刊:1期临床试验表明经过CRISPR基因编辑的通用CAR-T细胞可用于治疗复发性B细胞白血病
doi:10.1126/scitranslmed.abq3010
在一项新的临床研究中,来自英国大奥蒙德街儿童医院和伦敦大学学院的研究人员利用CRISPR/Cas9技术对供者T细胞进行基因改造,试图治疗患有耐药性白血病的重症儿童,这些儿童已用尽所有可用的治疗方法。这项I期临床试验是首次在人类身上使用“通用的”经过CRISPR基因编辑的T细胞,代表着在使用基因编辑细胞治疗癌症方面迈出了重要一步。作为这项临床试验的一部分,他们构建并应用了新一代的更精确的“通用”基因组编辑T细胞。相关研究结果发表在2022年10月26日的Science Translational Medicine期刊上,论文标题为“Phase 1 clinical trial of CRISPR-engineered CAR19 universal T cells for treatment of children with refractory B cell leukemia”。
这些作者使用CRISPR对T细胞进行了基因修饰,具体而言它对T细胞的DNA进行切割并插入了一段遗传代码。在这种情况下,这段遗传代码允许T细胞表达一种识别癌变B细胞表面上的一种称为CD19的标志物的嵌合抗原受体(CAR),所产生的CD19 CAR-T细胞摧毁这些癌变B细胞。他们随后利用CRISPR破坏了CD19 CAR-T细胞中的T细胞受体α链并移除它们的CD52,由此获得TT52CAR19 T细胞,这样构建出一种通用的可以“现成”使用的CAR-T细胞疗法,而无需任何供者匹配。
图片来自Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abq3010。
六名年龄在14个月至11岁的复发性和治疗抵抗性的B-ALL儿童在2022年2月之前已接受了治疗。所有这些儿童以前都接受过英国对B-ALL的标准治疗,但不幸的是,他们的疾病多次复发。患者接受了预计将在四周左右具有活性的TT52CAR19 T细胞。这段时间足够达到深度缓解,也就是癌症显著减少或无法检测的状态。一旦取得成功,患者就有资格进行骨髓造血干细胞移植,以帮助重建健康的免疫系统。
在首批接受TT52CAR19 T细胞治疗的6名儿童中,有4人在28天内进入缓解期,这使他们能够接受造血干细胞移植。在这4名儿童中,2人分别在治疗后9个月和18个月内仍在持续缓解,而不幸的是,另外2人在造血干细胞移植后复发了。在这项新的临床研究中,整体的副作用在预期之内,并在医院得到控制,有1名儿童需要短期的重症监护。
3.Cancer Immunol Res:靶向肿瘤巨噬细胞的CAR-T细胞有望治疗一系列实体瘤
doi:10.1158/2326-6066.CIR-21-1075
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员指出一种新的癌症免疫疗法利用一种免疫细胞杀死另一种免疫细胞而不是直接攻击癌症,可引起一种强大的抗肿瘤免疫反应,这种免疫反应在临床前疾病模型中让卵巢肿瘤、肺部肿瘤和胰腺肿瘤萎缩。相关研究结果发表2022年11月1日的Cancer Immunology Research期刊上,论文标题为“Targeting Macrophages with CAR T Cells Delays Solid Tumor Progression and Enhances Antitumor Immunity”。
大多数实体瘤遭受一种不同类型的称为巨噬细胞的免疫细胞严重浸润。巨噬细胞通过阻止T细胞进入肿瘤组织来帮助肿瘤生长,这使得CAR-T细胞和患者自身的T细胞无法消灭癌细胞。为了从源头上解决这种免疫抑制问题,这些作者对T细胞进行基因改造,使之表达一种能够识别巨噬细胞表面分子F4/80的“嵌合抗原受体(CAR)”。当这些CAR-T细胞遇到驻留在肿瘤中的巨噬细胞时,它们被激活并杀死肿瘤中驻留的巨噬细胞。用这些靶向巨噬细胞的CAR-T细胞治疗患有卵巢肿瘤、肺部肿瘤和胰腺肿瘤的小鼠,减少了肿瘤中驻留的巨噬细胞数量,缩小了这些肿瘤,并延长了它们的生存期。
杀死驻留在肿瘤中的巨噬细胞使小鼠自身的T细胞能够进入并杀死癌细胞。这些作者进一步证实这种抗肿瘤免疫反应是由这些CAR-T细胞释放的细胞因子干扰素---一种参与调节炎症反应的分子---所驱动的。
论文共同通讯作者、西奈山伊坎医学院的Brian Brown博士说,“我们最初的目标只是利用CAR-T细胞杀死免疫抑制性巨噬细胞,但我们发现它们也通过释放这种强大的免疫促进分子来提高肿瘤免疫反应。这是单次治疗实现一举两得的效果。”
4.两篇论文利用三维生物打印的肿瘤模型测试化疗药物和CAR-T细胞的疗效
doi:10.1002/adfm.202203966; doi:10.1088/1758-5090/ac925a
来自美国宾夕法尼亚州立大学的研究人员成功地三维生物打印出乳腺癌肿瘤,并在一项突破性的研究中对它们进行了治疗,以更好地了解这种作为全球主要死亡原因之一的疾病。这一科学上的首次创举为肿瘤模型的精确制作奠定了基础。这一进展将使未来的抗癌疗法的研究和开发无需使用动物实验。
宾夕法尼亚州立大学工程科学与力学系教授、生物医学工程系教授和神经外科教授Ibrahim Ozbolat说,“这将帮助我们了解人类免疫细胞如何与实体瘤相互作用。我们开发出一种工具,作为一个临床测试平台,用于安全和准确评估实验性疗法。它也是免疫学家和生物学家的研究平台,以了解肿瘤如何生长,如何与人体细胞相互作用,以及如何在体内转移和扩散。”
Ozbolat实验室专门从事于利用三维生物打印制造一系列用于人体健康的组织。关于该实验室利用三维生物打印帮助研究乳腺癌的两篇论文近期发表在Advanced Functional Materials期刊和Biofabrication期刊上,论文标题为分别为“Chemotherapeutics and CAR-T Cell-Based Immunotherapeutics Screening on a 3D Bioprinted Vascularized Breast Tumor Model”和“Biofabrication of 3D breast cancer models for dissecting the cytotoxic response of human T cells expressing engineered MAIT cell receptors”。

这些作者使用了一种相对较新的技术,即吸取式生物打印技术(aspiration-assisted bioprinting),在三维空间中精确定位肿瘤并制造这种组织。他们随后将这种肿瘤组织形成一种带有血管的多尺度乳腺肿瘤模型,他们发现该模型对化疗和基于T细胞的免疫疗法有反应。他们首先通过用阿霉素(doxorubicin)治疗这种肿瘤模型来验证它的准确性,其中阿霉素是一种常用于治疗乳腺癌的蒽环类化疗药物。在发现这种生物打印的肿瘤对化疗有反应后,他们继续与杰克逊实验室的免疫学家Derya Unutmaz博士合作,对这种肿瘤进行了基于T细胞的免疫治疗。
他们使用了通过基因编辑设计的人类CAR-T细胞来识别和对抗一种侵袭性的乳腺癌细胞。在经过基因编辑的CAR-T细胞在肿瘤内循环72小时后,他们发现,这种生物打印的肿瘤中的细胞产生了积极的免疫反应,并正在对抗这些癌细胞。
5.Nature:首次使用非病毒精确基因组编辑开发出的neoTCR-T细胞在临床试验中治疗实体癌并取得积极进展
doi:10.1038/s41586-022-05531-1
人类免疫系统在T细胞表面上有特定的受体,即T细胞受体(TCR),可以专门识别癌细胞并将它们与正常细胞区分开来。这些受体对每名患者来说都是不同的,因此找到一种有效的方法来分离它们并将它们导入到T细胞中,以产生一种个性化的T细胞疗法来治疗癌症,是使这种方法大规模可行的关键。
在一项新的研究中,来自美国加州大学洛杉矶分校和PACT制药公司的研究人员首次使用CRISPR技术将外源基因导入到称为T细胞的免疫细胞中,使得这些经过基因改造的T细胞集中攻击癌细胞,潜在地让正常细胞不受伤害,从而提高免疫疗法的有效性。相关研究结果于2022年11月10日在线发表在Nature期刊上,论文标题为“Non-viral precision T cell receptor replacement for personalized cell therapy”。论文通讯作者为加州大学洛杉矶分校的Antoni Ribas博士、PACT制药公司的Stefanie J. Mandl博士和Susan P. Foy博士。
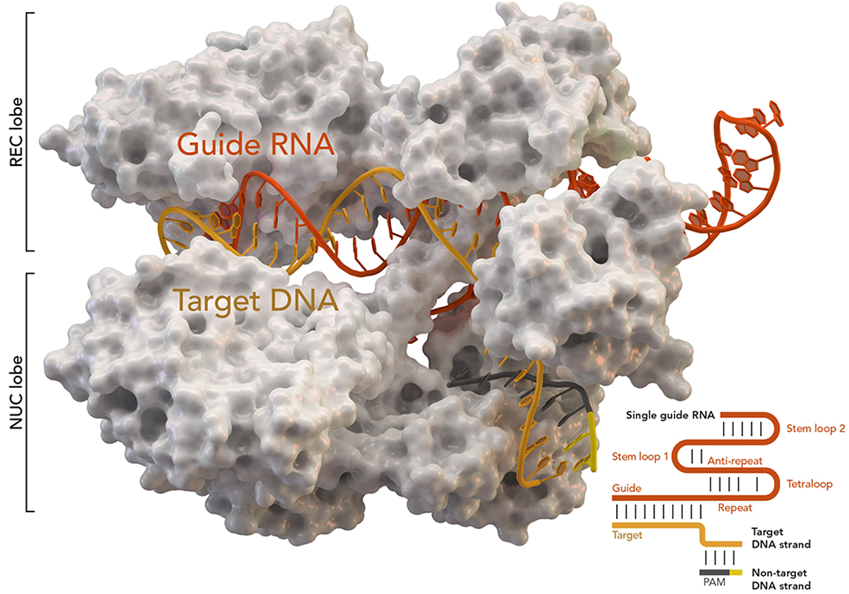
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
CRISPR技术以前曾被用于人体中去除特定的基因,使免疫系统能够更有效地对抗癌症。在这项新的研究中,这些作者开发了一种基于CRISPR/Cas9非病毒精确基因组编辑的临床级方法,同时敲除T细胞中的两个内源性TCR基因:TCRα(TRAC)和TCRβ(TRBC),并在TRAC基因座上插入新抗原特异性TCR(neoantigen-specific TCR, neoTCR)的两条链,所使用的neoTCR是从患者自身的循环T细胞中分离出来的,由此获得的T细胞称为neoTCR-T细胞。
16名难治性实体癌(包括结肠癌、乳腺癌和肺癌)患者首次在neoTCR-T细胞剂量递增的1期临床试验(NCT03970382)中接受了多达三种不同的neoTCR-T细胞输注,每种neoTCR-T细胞都表达了患者特异性的neoTCR。一名患者出现了1级细胞因子释放综合征,一名患者出现了3级脑炎。在接受neoTCR-T细胞输注前,所有患者都接受清除淋巴细胞的化疗,并且在化疗后出现预期的副作用。在接受neoTCR-T细胞输注后,5名患者病情稳定,其他11名患者出现疾病进展。在接受neoTCR-T细胞治疗后的肿瘤活组织中检测到neoTCR-T细胞,其频率高于治疗前表达内源性TCR的T细胞。
6.Cancer Immunol Res:血液中较低的磷酸盐水平可能与CAR-T细胞疗法的神经副作用有关
doi:10.1158/2326-6066.CIR-22-0418
在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员发现嵌合抗原受体(CAR)T细胞(CAR-T)疗法的神经系统副作用的发生率和严重程度在有低磷酸盐血症(hypophosphatemia)的患者中更高。相关研究结果于2022年10月19日在线发表在Cancer Immunology Research期刊上,论文标题为“Hypophosphatemia Due to Increased Effector Cell Metabolic Activity Is Associated with Neurotoxicity Symptoms in CD19-Targeted CAR T-cell Therapy”。
与CAR-T细胞疗法相关的神经系统毒性,即免疫效应细胞相关的神经毒性综合征(immune effector cell-associated neurotoxicity syndrome, ICANS),影响了大约50%的接受这种疗法的患者。症状包括意识模糊、谵妄、失语、运动技能受损和昏睡。在严重的情况下,可能发生危及生命的事件,包括癫痫发作和昏迷。
论文通讯作者、加州大学洛杉矶分校大卫-格芬医学院儿科系(血液学/肿瘤学)驻校助理教授Theodore Scott Nowicki博士说,“对ICANS的治疗目前仅限于支持性护理和类固醇,而类固醇是非特异性的,并可能有其副作用。因此,有能力预测ICANS发病将是对临床医生非常有帮助。”
7.NEJM:小型临床试验表明靶向GPRC5D的CAR-T细胞可有效治疗骨髓瘤
doi:10.1056/NEJMoa2209900
在一项新的研究中,来自美国纪念斯隆-凯特琳癌症中心(MSK)、丹娜-法伯癌症研究所和罗斯威尔公园综合癌症中心的研究人员指出一种利用对免疫系统中的T细胞进行基因改造后获得的CAR-T细胞疗法靶向一种有点神秘的细胞蛋白---GPRC5D抗原,该方法在对多发性骨髓瘤患者的首次临床试验中产生了令人瞩目的结果。相关研究结果发表在2022年9月29日的NEJM期刊上,论文标题为“GPRC5D-Targeted CAR T Cells for Myeloma”。
这些作者报告说,这种靶向GPRC5D的CAR-T细胞疗法在参加这项临床试验的17名出现肿瘤复发或对以前的疗法有抵抗力的骨髓瘤患者中让70.6%的人获得了缓解。许多获得缓解的患者之前在接受靶向BCMA的上一代CAR-T细胞疗法治疗后出现肿瘤复发。这些发现促使人们开始对这种靶向GPRC5D的新疗法在骨髓瘤患者中进行更大规模的临床试验。
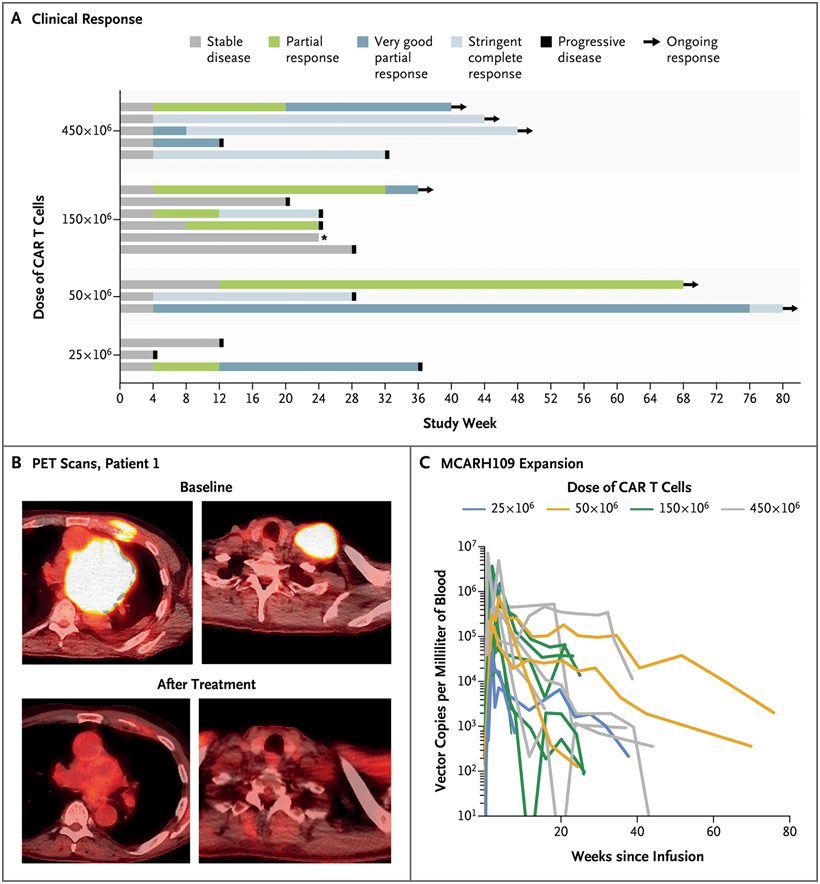
靶向GPRC5D的CAR-T细胞疗法导致的临床缓解。图片来自NEJM, 2022, doi:10.1056/NEJMoa2209900。
论文第一作者Sham Mailankody说,“CAR-T细胞疗法是治疗癌症的最有前途的方法之一。虽然这项临床试验仍处于早期阶段,但我们对这些结果感到鼓舞,因为治疗后的测试显示,6名参与者对这种新的疗法有完全的反应,12名患者的癌症出现了可测量的下降。”
论文共同通讯作者、丹娜-法伯癌症研究所的Eric L. Smith博士说,“靶向BCMA--一种在免疫系统中的B细胞表面上普遍存在的蛋白---的CAR-T细胞疗法在晚期骨髓瘤中显示出了希望,但许多患者出现了肿瘤复发。我们开发出针对我们鉴定出的一种称为GPRC5D(protein-coupled receptor, class C group 5 member D)的抗原的CAR-T细胞,它们在实验室中对骨髓瘤细胞和骨髓瘤的动物模型有效,包括那些对靶向BCMA 的CAR-T细胞不再有反应的动物模型。我们的1期临床研究代表了这种第二代CAR-T细胞疗法首次在骨髓瘤患者身上进行测试。”
8.Nat Med:双靶向CAR NK细胞有望阻止NK细胞功能衰竭和肿瘤逃逸
doi:10.1038/s41591-022-02003-x
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员开发了一种新方法:除了对自然杀伤细胞(NK细胞)进行基因改造使之表达一种识别肿瘤抗原的嵌合抗原受体(CAR)之外,还对它们进行进一步基因改造使之表达一种抑制NK细胞自我识别的作为逻辑门起作用的CAR,这样就使得这种双靶向CAR NK细胞需要两种信号才能杀死靶细胞。在临床前实验中,这种下一代CAR NK细胞通过克服一种导致NK细胞功能障碍和肿瘤复发的过程,改善了肿瘤的特异性并增强了抗肿瘤活性。相关研究结果发表在2022年10月的Nature Medicine期刊上,论文标题为“KIR-based inhibitory CARs overcome CAR-NK cell trogocytosis-mediated fratricide and tumor escape”。
这项新的研究表明,一种称为“胞啃作用(trogocytosis)”的正常生理过程通过导致肿瘤抗原丢失、CAR NK细胞功能衰竭和自相残杀,导致了肿瘤逃逸和CAR NK细胞治疗后反应不佳。
论文通讯作者、德克萨斯大学MD安德森癌症中心干细胞移植与细胞治疗学教授Katayoun Rezvani博士说,“我们发现了CAR NK细胞治疗后肿瘤复发的新机制,我们还开发了一种策略来缓解这一过程。为此,我们设计了具有这种双靶向CAR NK细胞,它们能够忽略它们的同伴NK细胞表面因胞啃作用而获得的肿瘤抗原,并选择性地消除肿瘤细胞。”
9.Science子刊:新研究表明CAR-T细胞有望用于治疗真菌感染
doi:10.1126/scitranslmed.abh1209
在一项新的研究中,来自德国维尔茨堡大学和慕尼黑大学等研究机构的研究人员开发出一种对CAR-T细胞工程化过程进行改进的方法,据此他们构建出能够协助对抗肺部真菌感染的CAR-T细胞。相关研究结果发表在2022年9月28日的Science Translational Medicine期刊上,论文标题为“CAR T cells targeting Aspergillus fumigatus are effective at treating invasive pulmonary aspergillosis in preclinical models”。在这篇论文中,他们描述了对CAR-T细胞工程化过程进行改进的情况。
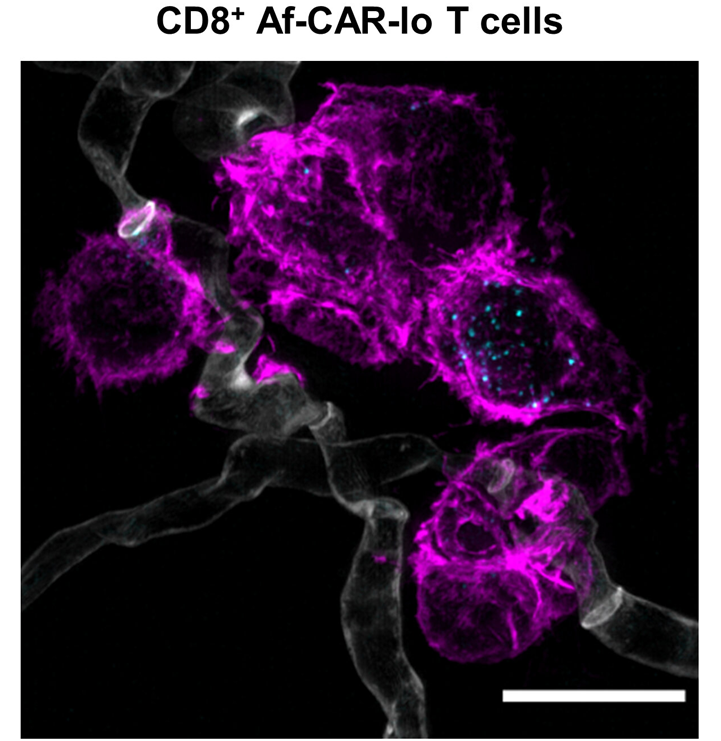
CAR-T细胞与烟曲霉菌丝共培养时形成的免疫突触(粉红色)。图片来自Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abh1209。
经过基因改造的CAR-T细胞可以附着在癌细胞抗原上,帮助身体消除肿瘤。CAR-T细胞是通过从患者身上采集T细胞,然后经过基因改造使之表达一种识别癌细胞的嵌合抗原受体(CAR)而设计出来的。随后,将CAR-T细胞重新输注到相同的患者身上。传统上,CAR T细胞被设计用来对抗癌症,但在这项新的研究中,这些作者改进了这一过程,构建出能够对付烟曲霉菌-----一种可能导致免疫力低下的患者或接受化疗的患者感染从而导致侵袭性肺曲霉病的真菌---的CAR-T细胞。近期,人们发现,患有COVID-19感染的人也更容易受到这种肺部感染的影响。
这项新的研究密切模拟了用于构建对抗癌症的CAR-T细胞的过程。但是,他们没有添加一种靶向癌细胞抗原的CAR受体,而是添加了一种靶向烟曲霉菌细胞壁的CAR受体。
这些作者首先在培养皿中测试了他们新设计的CAR-T细胞,并发现它们能够识别多种菌株的烟曲霉菌。他们还发现,他们的CAR-T细胞能够通过释放穿孔素和颗粒酶B来阻碍这种真菌生长,从而杀死它们。他们随后在实验室小鼠身上测试了他们的CAR-T细胞。他们发现,CAR-T细胞直接移动到感染部位,并且在附着在真菌上时,降低了真菌的数量,这反过来又帮助免疫系统消除了这种真菌感染。
10.Blood:在异基因造血干细胞移植后,利用表达ADR受体的T细胞有望阻止移植物抗宿主病和癌症复发
doi:10.1182/blood.2022016052
在一项新的研究中,来自美国贝勒医学院和波士顿儿童医院等研究机构的研究人员对称为T细胞的免疫细胞进行基因改造来控制通常在用异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)治疗白血病后出现的两大威胁生命的并发症:移植物抗宿主病(graft-vs-host disease, GvHD)和癌症复发。他们在动物模型中的研究结果支持进一步开展研究,以确定使用这种方法降低死亡率和改善患者预后的可行性。相关研究结果近期发表在Blood期刊上,论文标题为“Engineering T cells to suppress acute GvHD and leukemia relapse after allogeneic hematopoietic stem cell transplantation”。
用于移植的造血干细胞通常含有少量称为T细胞的供者免疫细胞,它们能将受者的正常器官和组织识别为外来物,并发起类似免疫排斥的过程,从而引起移植物抗宿主病(GvHD)。论文通讯作者、贝勒医学院病理学与免疫学助理教授Maksim Mamonkin博士及其研究团队希望在保护患者免受GvHD和癌症复发的同时,不消除他们的正常免疫力,这种免疫力有助于对抗白血病,但也能保护他们免受严重的致病病毒感染,比如巨细胞病毒(CMV)、爱泼斯坦-巴尔病毒(EBV)和腺病毒,这些病毒经常在这些脆弱的患者接受造血干细胞移植后出现。
Mamonkin解释说,“我们的目标是有选择地去除导致GvHD发生的T细胞,同时保留身体对抗其他疾病的能力。为此,我们需要找到一种方法来识别这些细胞---一种主要在介导GvHD的T细胞表面上而不是在其他细胞中表达的标志物。经过广泛的搜索,我们发现蛋白OX40是一种很有希望的候选标志物。”
为了验证这种靶蛋白,该团队联系了来自波士顿儿童医院的在非人类灵长类动物模型中研究GvHD的的合作者。他们证实OX40在急性GvHD期间在浸润到猕猴靶器官中的T细胞表面上大量存在。这些作者随后设计了一种名为异体免疫防御受体(alloimmune defense receptor, ADR)的受体,使之在治疗性T细胞表面上表达,从而使得它们能够识别和杀死表达OX40蛋白的T细胞。在实验室和动物模型中用治疗性T细胞进行的测试表明,表达ADR的T细胞(下称ADR T细胞)非常有效地抑制了介导GvHD的T细胞,并保护动物免受这种致命的并发症。与此同时,Mamonkin说,ADR T细胞并没有对控制病毒感染的“良好”T细胞造成太大的损害,“这让我们相信这种疗法一般不会有免疫抑制作用”。(生物谷 Bioon.com)
相关生物谷新闻:
CAR-T细胞疗法研究进展(第32期)
https://news.bioon.com/article/1cc9e41516ed.html
CAR-T细胞疗法研究进展(第31期)
https://news.bioon.com/article/18a5e37253a6.html
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


