2020年4月CRISPR/Cas研究进展
来源:本站原创 2020-04-29 07:24
2020年4月29日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。 图片来自Thoma
2020年4月29日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
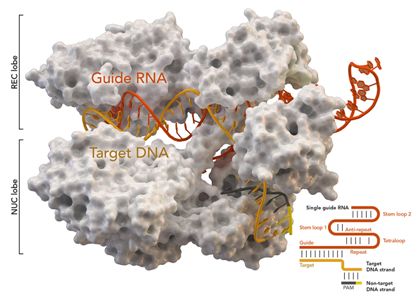
2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的4月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Cell:开发出利用CRISPR抵抗流感病毒和SARS-CoV-2的新型抗病毒策略
doi:10.1016/j.cell.2020.04.020
虽然大多数正在进行的疫苗临床试验通过诱导人类免疫系统识别冠状病毒蛋白或减毒病毒并减少病毒进入细胞来发挥作用,但是,在一项新的研究中,来自美国斯坦福大学等多家研究机构的研究人员提出一种替代性抗病毒方法,它依赖于一种基于CRISPR的系统,用于识别和降解细胞内病毒基因组及其产生的病毒mRNA(图1B)。靶向正义基因组和病毒mRNA以同时降解用于病毒复制和基因表达的病毒基因组模板,这将有望稳健地限制病毒复制。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza”。

在这项新的研究中,这些研究人员在人细胞中开发出一种预防性抗病毒CRISPR策略(Prophylactic Antiviral CRISPR in huMAN cells,简称PAC-MAN)。作为一种基因干预的形式,PAC-MAN靶向SARS-CoV-2和IAV,并且可能靶向所有冠状病毒。他们构建出一种生物信息学管道,在许多测序的SARS-CoV-2基因组中确定高度保守的区域,并利用CRISPR-Cas13d靶向这些保守性区域以进行病毒序列降解。
这些研究人员证实这种方法能够切割SARS-CoV-2片段,并减少人肺上皮细胞中的病毒RNA数量。他们的生物信息学分析揭示出6个crRNA能够靶向91%的已被测序的冠状病毒,以及22个crRNA能够靶向所有已被测序的冠状病毒。通过使用靶向同一病毒的不同区域或者不同冠状病毒毒株的crRNA文库,这种方法可能会对冲病毒进化和逃逸,也可能用来抵御未来出现的相关致病病毒。虽然这一策略在临床上应用之前还有一些障碍需要克服,但PAC-MAN有可能成为一种新的抗病毒策略。
2.Nat Biomed Eng:深度剖析!基于CRISPR–Cas13的新技术有望简单快速检测肾脏移植患者的感染风险和排斥反应!
doi:10.1038/s41551-020-0546-5
日前,一项刊登在国际杂志Nature Biomedical Engineering上题为“A CRISPR-based assay for the detection of opportunistic infections post-transplantation and for the monitoring of transplant rejection”的研究报告中,来自麻省理工学院等机构的科学家们通过研究基于CRISPR开发出了一种新型诊断技术来检测器官移植后患者的感染风险,同时监测患者对移植器官的排斥反应。
在器官移植过程中,感染和排斥是引发移植失败的主要原因,其是通过免疫抑制的状态联系到一起的,为了能够尽可能早地诊断并且治疗这些情况,并改善患者的长期预后,研究人员就需要对接受器官移植的患者进行持续性监测;这项研究中,研究人员基于CRISPR–Cas13开发出了一种快速廉价的检测方法,其能准确检测来自病人机体血液和尿液样本中BK多瘤病毒(BKV)和巨细胞病毒(CMV)的DNA,以及经历急性肾移植排斥反应患者尿液中水平升高的CXCL9 mRNA(移植物排斥的标志物);BKV、CMV和CXCL9 mRNA在急性细胞肾移植排斥反应中的表达水平会升高。
这项研究中,研究人员CRISPR–Cas13技术开发出了一种检测试剂盒,在对100多名感染BKV和CMV的患者的临床样本在不同病毒载量范围内进行检测后,研究者发现了这种检测手段具有较高的诊断效率;这种试剂盒能够使用两步法,首先其能对尿液样本中的病毒靶向DNA进行扩增,以便于仅有单分子存在的情况下CRISPR也能检测到靶标;随后研究人员使用了一种称之为SHERLOCK的特殊CRISPR–Cas13步骤来优化病毒DNA的检测过程,检测过程就好像使用一般的测孕试纸海洋,当将检测试剂条浸润到样本中时,如果检测条出现一条线就表明结果是阴性,如果是两条线就证明存在病毒感染。此外,研究人员还利用试剂盒对排斥标志物CXCL9进行检测,作为mRNA,其能被分离并且扩增,随后利用CRISPR-Cas13对其进行靶点检测。对于非常低的目标浓度,检测试纸条也会出现不能确定的第二条条带,这或许就会导致研究人员对结果产生误判,基于此,研究人员开发出了一款智能手机app,其能客观地分析试纸条带的结果,并给出准确的结果判读。
快速有效的POCT(即时检测)技术能帮助患者在资源匮乏的环境中进行疾病的早期诊断成为可能,同时还能帮助患者实现疾病的自我监测,这项研究中,研究人员基于CRISPR-Cas13开发的新型诊断试剂盒就能对器官移植受体患者样本中的CMV和BKV进行检测,同时研究者还运用SHERLOCK步骤成功实现了对患者样本中CXCL9 mRNA的检测;这种新型工具或有望作为器官移植患者移植后发现进行早期排斥反应和监测的工具。
3.Cell综述深度解读!基于CRISPR治疗性基因编辑领域的研究现状及未来展望!
doi:10.1016/j.cell.2020.03.023
日前,一项刊登在国际杂志Cell上题为“CRISPR-Based Therapeutic Genome Editing:Strategies and In Vivo Delivery by AAV Vectors”的综述文章中,来自马赛诸塞大学医学院等机构的科学家们描述了以CRISPR为基础的改善人类健康的策略,其重点是通过利用AAV载体将CRISPR疗法直接导入人体,此外,研究人员还讨论了目前广泛应用基于CRISPR疗法所要面临的挑战,并强调了持续的研究和技术革新对于推动基于CRISPR疗法在人类疾病研究中的重要性。
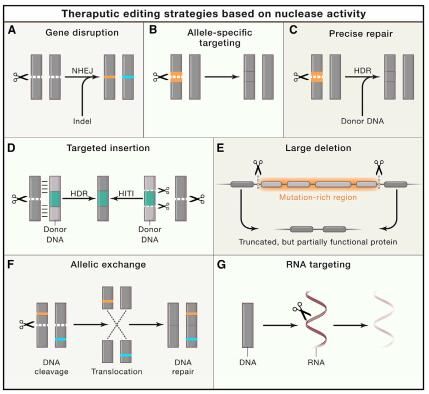
目前应用基于CRISPR的治疗性手段能直接应用于患者体内,有望治疗多种人类疾病,尽管基于CRISPR的工具箱能够对DNA和RNA编辑及基因表达调节进行多种操作,但其药物的运输仍然是该疗法发展的瓶颈,目前,腺相关病毒(AAV)载体是进行体内基因治疗的主要载体;AAV非常安全,其能将单链DNA(ssDNA)载体基因组运输到多个组织和细胞类型中,而且仅在一定剂量范围内具有轻度的免疫原性;尽管载体基因组在宿主细胞内大部分处于游离状态,但通过共分化和环化来介导有丝分裂后细胞内长期的转基因表达,就能使其稳定下来并产生持久的治疗效果,AAV载体在运输基因疗法到疾病动物模型和患者中推动了基于CRISPR疗法在治疗多种疾病中的应用。
4.Cell:利用CRISPR-CasRx技术将神经胶质细胞转换为神经元或有望减缓神经性疾病的症状
doi:10.1016/j.cell.2020.03.024
日前,一项刊登在国际杂志Cell上题为“Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice”的研究报告中,来自中科院上海生命科学研究院等机构的科学家们通过研究发现,利用CRISPR-CasRx技术将神经胶质细胞转换为神经元细胞,或能有效减缓小鼠机体神经性疾病的症状。
这项研究中,研究人员指出,利用体内病毒递送的RNA靶向CRISPR-CasRx技术来下调单一RNA结合蛋白—Ptbp1(多聚嘧啶序列结合蛋白1)或能导致Muller胶质细胞高效转化为视网膜神经节细胞(RGCs,retinal ganglion cells),从而就能减缓与RGC缺失相关的疾病症状。
本文研究的主要结果包括:1)敲除Ptbp1或能将Muller胶质细胞转化为成熟视网膜组织中的视网膜神经节细胞;2)转化后的视网膜神经节细胞的中央投射或会恢复机体的视觉反应;3)在帕金森小鼠模型中揭示了具有多巴胺能特征的神经元诱导特性;4)诱导的神经元或能减缓帕金森小鼠机体的运动功能障碍。
研究者表示,这种方法还能诱导大脑纹状体中产生具有多巴胺能特性的神经元,同时还会减缓帕金森疾病小鼠模型机体中的运动缺陷;因此,基于CRISPR-CasRx技术所介导的Ptbp1基因敲除所引发的胶质细胞向神经元细胞的转换或能在体内作为一种遗传性手段来帮助治疗因神经元功能缺失所引发的一系列神经性障碍。
5.Nat Biotechnol:开发出能同时对多个基因组位点进行编辑的超强基因编辑工具—CHyMErA
doi:10.1038/s41587-020-0437-z
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自多伦多大学等机构的科学家们通过研究开发了一种新技术能同时对基因组中多个位点进行编辑,从而就有望帮助研究不同DNA的组合与人类健康和疾病的关联。基于CRISPR的DNA编辑技术能通过对任何人类基因进行精确剔除来研究其功能,从而就能彻底改变科学家们对人类基因组的研究,但目前研究人员仍然面临众多挑战,比如如何在相同细胞中同时移除多个基因或基因片段,这种类型的基因组“手术”对于科学家们而言,了解基因组不同部分在正常生理和疾病状况下是如何协同发挥作用的似乎更为重要。
如今研究人员开发了一种名为CHyMErA(Cas Hybrid for Multiplexed Editing and Screening applications)的新技术,其能应用到任何哺乳动物细胞中,同时系统性地靶向作用多个位点的DNA片段,CRISPR剪刀能通过导向RNA分子将DNA切割酶运送到基因组上的预想位点中,而使用最为广泛的DNA切割酶就是Cas9酶,自Cas9问世以来,科学家们一直寻找其它具有独特特性的Cas酶,以寻求改进和扩展该技术的应用;与CRISPR-Cas9技术不同的是,ChyMErA技术能将Cas9和Cas12a两种不同的DNA切割酶进行结合,从而实现多种用途,Cas12a酶是一种能用来在相同细胞中产生多个导向RNA分子的关键酶类,而这是同时进行DNA编辑的关键。
研究者Thomas Gonatopoulos-Pournatzis表示,我们花费了多年来开发能同时检测Cas9和Cas12a酶的组合性基因编辑技术,随后我们将这些酶类进行结合开发出了ChyMErA系统;研究人员尝试了多种方法来诱导基因片段缺失,但并没有哪一种手段会比ChyMErA更加有效;研究者发现,ChyMErA能够成功剔除基因片段,随后研究者在大规模筛查中利用该技术来系统性地分析基因如何进行结合来发挥作用。在ChyMErA技术的帮助下,研究人员就能够使用两种酶中最好的酶类来进行基因编辑,Cas9已经被广泛改进拥有较高的编辑效率,而Cas12a则能允许多种导向RNAs的使用,因此其在寻找能在基因组中进行位点切割上具有更大的灵活性。
6.Nature子刊重大突破:纳米颗粒实现器官特异性基因编辑!
doi:10.1038/s41565-020-0669-6
在最新一期Nature Nanotechnology上,Qiang Cheng等人提出了一种称为选择性器官靶向(SORT)的方法,通过生物工程将含有核酸疗法的LNPs诱导肝脏、脾脏和肺特异性基因调控。LNP系统通常由磷脂、胆固醇、聚乙二醇(PEG)脂质和可电离的阳离子脂质组成。每个LNP成分及其摩尔比都已被优化,以确保高效的核酸递送到肝细胞。特别是,合理设计和筛选可电离的阳离子脂质(或类脂质)文库对于实现临床应用相关剂量的肝基因沉默至关重要。最有效的电离阳离子脂质,其特征是明显的pKa值在6.2和6.5之间,具有三种功能:(1)在LNP生产期间,酸性pH值下质子化的叔胺脂质头部促进其与带负电荷的核酸结合,(2)在生理的pH值,附近无电荷的脂质确保净中性表面电荷,以减少免疫反应和循环时间延长和(3)细胞摄取后进入酸化的内体中,正电荷脂质促进膜融合和有效的胞质递送。
在这种SORT方法中,作者添加五分之一脂质成分来通过静脉注射递送功能信使核糖核酸或基因编辑复合物道特定组织。使用一个快速的混合过程,这种SORT脂质 (永久的阳离子和阴离子或可质子化的阳离子)和不同摩尔比的其他材料生成一个脂质体文库,包载mRNA编码荧光素酶进行体内筛选。通过增加永久性阳离子脂质1,2-二烯烃-3-三甲氨基丙烷(DOTAP)的摩尔百分比(0-100%),可使荧光素酶的表达在静脉注射后从肝脏转移到脾脏和肺。LNPs中加入10-40%的永久性阴离子脂质1,2-二烯醇化酶-sn-甘油-3-磷酸(18PA)可在脾脏中特异性表达荧光素酶。加入20%的其他可电离的阳离子脂类,如1,2-二烯酰-3-二甲基氨基甲烷-丙烷(DODAP),不会改变生物分布,但增加了mRNA对肝脏的递送。该方法的普遍性通过将LNP与其他永久性带电或可电离的阳离子脂类功能化而得到证实,这导致了器官表达的类似变化,且表现出与脂类相关的方式。值得注意的是,SORT-LNP的疗效离不开可电离的阳离子脂质包合。给予肺、脾脏和肝脏特异性mRNA SORT-LNP的筛选结果表明,基于荧光素酶的筛选可产生持续的治疗性蛋白,且无明显毒性。重要的是,SORT方法还允许调节LNPs组织特异性荧光素酶的表达,使其与临床批准的Onpattro配方相同。
Cheng等人也报道了使用SORT-LNPs进行组织特异性CRISPR/Cas基因编辑。相对于治疗性基因沉默或表达,基于CRISPR/Cas的基因编辑需要(至少)两个组成部分:引导RNA (guide RNA, gRNA)识别目标DNA和Cas核酸酶进行双链断裂。作者生成了包含gRNA和Cas9 mRNA或gRNA/Cas9核糖核酸蛋白复合物的SORT-LNPs,并在肝外组织中进行了基因编辑。在红色荧光蛋白tdTomato报告小鼠中,不同种类的LNP剂型可选择性诱导肝、肺、脾特异性基因编辑。此外,作者还展示了内源性靶基因(PTEN)和治疗性靶基因(PCSK9)的组织特异性编辑。
7.Nat Cancer:Crispr技术揭示淋巴瘤弱点
doi:10.1038/s43018-020-0054-2
在最近一项研究中,美国加州大学圣地亚哥医学院和摩尔斯癌症中心的研究人员团队利用CRISPR技术鉴定出了侵袭性慢性骨髓性白血病的关键调节剂。

"我们利用CRISPR技术在白血病细胞中进行全基因组筛查,一次性阻断数千个基因。这是一个非常强大的工具,使我们能够识别出助长白血病生长的众多基因,并找到了可以在这种疾病中靶向治疗的新漏洞。"高级作者、药理学和医学系教授Tannishtha Reya博士说。"这项研究还首次表明,基于全基因组CRISPR的筛查实际上可以以更符合生理学的方式进行:使用原生癌细胞,并在原生微环境的环境中进行。"
在2020年4月20日的《Nature Cancer》杂志上发表的文章中,Reya及其同事确定了RNA结合蛋白是维持和保护耐药性白血病干细胞的一类关键蛋白。作者们重点研究了Staufen2(Stau2),这是RNA结合蛋白家族中一个相对较少研究的成员,以前只知道它能控制大脑和神经系统的发育。
该团队开发了一种小鼠模型,在该模型中,Stau2被基因删除。作者发现,丢失这种蛋白会导致白血病的癌细胞生长和繁殖能力大大降低,并明显提高了小鼠模型的整体存活率。Stau2也是白血病患者原代组织样本的持续生长所需要的,这表明在人类疾病中存在着保守的依赖性。
8.Mol Ther:研究表明基因疗法可以成功治疗青光眼
doi:10.1016/j.ymthe.2019.12.012
由布里斯托尔大学领导的一项新研究表明,一种常见的眼病--青光眼,可以通过单次注射的基因疗法成功治愈,这将改善许多患者的治疗方案、疗效和生活质量。他们测试了一种新的方法,可以提供额外的治疗选择和好处。他们的研究结果发表在《Molecular Therapy》杂志上。
研究人员设计了一种基因疗法,并利用实验性青光眼小鼠模型和人类供体组织进行了概念验证。该疗法针对眼睛的一部分称为睫状体的结构,睫状体产生的液体可以维持眼内的压力。利用最新的基因编辑技术CRISPR,作者能够使睫状体中的一种名为Aquaporin 1的基因失活,导致眼压降低。
文章作者,布里斯托尔医学院客座高级研究员Colin Chu博士说。"目前,青光眼还没有治愈的方法,如果不及早诊断和治疗,会导致视力下降。我们希望在不久的将来推进这种新疗法的临床试验。如果成功的话,可以通过单眼注射的方式长期治疗青光眼,这将改善许多患者的生活质量,同时节省时间和金钱。"
9.Science子刊:干细胞遗传修饰可改善糖尿病
doi:10.1126/scitranslmed.aax9106
根据最近一项研究,研究人员利用从一名患有罕见的胰岛素依赖型糖尿病(Wolfram综合症)的患者皮肤上提取的细胞诱导产生多能干细胞,并且将其转化为分泌胰岛素的细胞,通过基因编辑工具CRISPR-Cas9,纠正导致该综合症的基因缺陷。然后,他们将这些细胞植入小鼠体内,并治愈了这些小鼠的糖尿病。
这一来自华盛顿大学医学院圣路易斯分校的研究人员的研究结果表明,CRISPR-Cas9技术可能作为治疗糖尿病,特别是由单一基因突变引起的糖尿病的有力武器。该研究于4月22日在线发表在《Science Translational Medicine》杂志上。
"这是CRISPR首次被用于修复因基因缺陷引起的糖尿病,"共同研究者、华盛顿大学医学和生物医学工程助理教授Jeffrey R. Millman博士说。(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的4月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Cell:开发出利用CRISPR抵抗流感病毒和SARS-CoV-2的新型抗病毒策略
doi:10.1016/j.cell.2020.04.020
虽然大多数正在进行的疫苗临床试验通过诱导人类免疫系统识别冠状病毒蛋白或减毒病毒并减少病毒进入细胞来发挥作用,但是,在一项新的研究中,来自美国斯坦福大学等多家研究机构的研究人员提出一种替代性抗病毒方法,它依赖于一种基于CRISPR的系统,用于识别和降解细胞内病毒基因组及其产生的病毒mRNA(图1B)。靶向正义基因组和病毒mRNA以同时降解用于病毒复制和基因表达的病毒基因组模板,这将有望稳健地限制病毒复制。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza”。

图1.图片来自Cell, 2020, doi:10.1016/j.cell.2020.04.020。
在这项新的研究中,这些研究人员在人细胞中开发出一种预防性抗病毒CRISPR策略(Prophylactic Antiviral CRISPR in huMAN cells,简称PAC-MAN)。作为一种基因干预的形式,PAC-MAN靶向SARS-CoV-2和IAV,并且可能靶向所有冠状病毒。他们构建出一种生物信息学管道,在许多测序的SARS-CoV-2基因组中确定高度保守的区域,并利用CRISPR-Cas13d靶向这些保守性区域以进行病毒序列降解。
这些研究人员证实这种方法能够切割SARS-CoV-2片段,并减少人肺上皮细胞中的病毒RNA数量。他们的生物信息学分析揭示出6个crRNA能够靶向91%的已被测序的冠状病毒,以及22个crRNA能够靶向所有已被测序的冠状病毒。通过使用靶向同一病毒的不同区域或者不同冠状病毒毒株的crRNA文库,这种方法可能会对冲病毒进化和逃逸,也可能用来抵御未来出现的相关致病病毒。虽然这一策略在临床上应用之前还有一些障碍需要克服,但PAC-MAN有可能成为一种新的抗病毒策略。
2.Nat Biomed Eng:深度剖析!基于CRISPR–Cas13的新技术有望简单快速检测肾脏移植患者的感染风险和排斥反应!
doi:10.1038/s41551-020-0546-5
日前,一项刊登在国际杂志Nature Biomedical Engineering上题为“A CRISPR-based assay for the detection of opportunistic infections post-transplantation and for the monitoring of transplant rejection”的研究报告中,来自麻省理工学院等机构的科学家们通过研究基于CRISPR开发出了一种新型诊断技术来检测器官移植后患者的感染风险,同时监测患者对移植器官的排斥反应。
在器官移植过程中,感染和排斥是引发移植失败的主要原因,其是通过免疫抑制的状态联系到一起的,为了能够尽可能早地诊断并且治疗这些情况,并改善患者的长期预后,研究人员就需要对接受器官移植的患者进行持续性监测;这项研究中,研究人员基于CRISPR–Cas13开发出了一种快速廉价的检测方法,其能准确检测来自病人机体血液和尿液样本中BK多瘤病毒(BKV)和巨细胞病毒(CMV)的DNA,以及经历急性肾移植排斥反应患者尿液中水平升高的CXCL9 mRNA(移植物排斥的标志物);BKV、CMV和CXCL9 mRNA在急性细胞肾移植排斥反应中的表达水平会升高。
这项研究中,研究人员CRISPR–Cas13技术开发出了一种检测试剂盒,在对100多名感染BKV和CMV的患者的临床样本在不同病毒载量范围内进行检测后,研究者发现了这种检测手段具有较高的诊断效率;这种试剂盒能够使用两步法,首先其能对尿液样本中的病毒靶向DNA进行扩增,以便于仅有单分子存在的情况下CRISPR也能检测到靶标;随后研究人员使用了一种称之为SHERLOCK的特殊CRISPR–Cas13步骤来优化病毒DNA的检测过程,检测过程就好像使用一般的测孕试纸海洋,当将检测试剂条浸润到样本中时,如果检测条出现一条线就表明结果是阴性,如果是两条线就证明存在病毒感染。此外,研究人员还利用试剂盒对排斥标志物CXCL9进行检测,作为mRNA,其能被分离并且扩增,随后利用CRISPR-Cas13对其进行靶点检测。对于非常低的目标浓度,检测试纸条也会出现不能确定的第二条条带,这或许就会导致研究人员对结果产生误判,基于此,研究人员开发出了一款智能手机app,其能客观地分析试纸条带的结果,并给出准确的结果判读。
快速有效的POCT(即时检测)技术能帮助患者在资源匮乏的环境中进行疾病的早期诊断成为可能,同时还能帮助患者实现疾病的自我监测,这项研究中,研究人员基于CRISPR-Cas13开发的新型诊断试剂盒就能对器官移植受体患者样本中的CMV和BKV进行检测,同时研究者还运用SHERLOCK步骤成功实现了对患者样本中CXCL9 mRNA的检测;这种新型工具或有望作为器官移植患者移植后发现进行早期排斥反应和监测的工具。
3.Cell综述深度解读!基于CRISPR治疗性基因编辑领域的研究现状及未来展望!
doi:10.1016/j.cell.2020.03.023
日前,一项刊登在国际杂志Cell上题为“CRISPR-Based Therapeutic Genome Editing:Strategies and In Vivo Delivery by AAV Vectors”的综述文章中,来自马赛诸塞大学医学院等机构的科学家们描述了以CRISPR为基础的改善人类健康的策略,其重点是通过利用AAV载体将CRISPR疗法直接导入人体,此外,研究人员还讨论了目前广泛应用基于CRISPR疗法所要面临的挑战,并强调了持续的研究和技术革新对于推动基于CRISPR疗法在人类疾病研究中的重要性。

图片来源:Dan Wang,et al. Cell,doi:10.1016/j.cell.2020.03.023。
目前应用基于CRISPR的治疗性手段能直接应用于患者体内,有望治疗多种人类疾病,尽管基于CRISPR的工具箱能够对DNA和RNA编辑及基因表达调节进行多种操作,但其药物的运输仍然是该疗法发展的瓶颈,目前,腺相关病毒(AAV)载体是进行体内基因治疗的主要载体;AAV非常安全,其能将单链DNA(ssDNA)载体基因组运输到多个组织和细胞类型中,而且仅在一定剂量范围内具有轻度的免疫原性;尽管载体基因组在宿主细胞内大部分处于游离状态,但通过共分化和环化来介导有丝分裂后细胞内长期的转基因表达,就能使其稳定下来并产生持久的治疗效果,AAV载体在运输基因疗法到疾病动物模型和患者中推动了基于CRISPR疗法在治疗多种疾病中的应用。
4.Cell:利用CRISPR-CasRx技术将神经胶质细胞转换为神经元或有望减缓神经性疾病的症状
doi:10.1016/j.cell.2020.03.024
日前,一项刊登在国际杂志Cell上题为“Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice”的研究报告中,来自中科院上海生命科学研究院等机构的科学家们通过研究发现,利用CRISPR-CasRx技术将神经胶质细胞转换为神经元细胞,或能有效减缓小鼠机体神经性疾病的症状。
这项研究中,研究人员指出,利用体内病毒递送的RNA靶向CRISPR-CasRx技术来下调单一RNA结合蛋白—Ptbp1(多聚嘧啶序列结合蛋白1)或能导致Muller胶质细胞高效转化为视网膜神经节细胞(RGCs,retinal ganglion cells),从而就能减缓与RGC缺失相关的疾病症状。
本文研究的主要结果包括:1)敲除Ptbp1或能将Muller胶质细胞转化为成熟视网膜组织中的视网膜神经节细胞;2)转化后的视网膜神经节细胞的中央投射或会恢复机体的视觉反应;3)在帕金森小鼠模型中揭示了具有多巴胺能特征的神经元诱导特性;4)诱导的神经元或能减缓帕金森小鼠机体的运动功能障碍。
研究者表示,这种方法还能诱导大脑纹状体中产生具有多巴胺能特性的神经元,同时还会减缓帕金森疾病小鼠模型机体中的运动缺陷;因此,基于CRISPR-CasRx技术所介导的Ptbp1基因敲除所引发的胶质细胞向神经元细胞的转换或能在体内作为一种遗传性手段来帮助治疗因神经元功能缺失所引发的一系列神经性障碍。
5.Nat Biotechnol:开发出能同时对多个基因组位点进行编辑的超强基因编辑工具—CHyMErA
doi:10.1038/s41587-020-0437-z
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自多伦多大学等机构的科学家们通过研究开发了一种新技术能同时对基因组中多个位点进行编辑,从而就有望帮助研究不同DNA的组合与人类健康和疾病的关联。基于CRISPR的DNA编辑技术能通过对任何人类基因进行精确剔除来研究其功能,从而就能彻底改变科学家们对人类基因组的研究,但目前研究人员仍然面临众多挑战,比如如何在相同细胞中同时移除多个基因或基因片段,这种类型的基因组“手术”对于科学家们而言,了解基因组不同部分在正常生理和疾病状况下是如何协同发挥作用的似乎更为重要。
如今研究人员开发了一种名为CHyMErA(Cas Hybrid for Multiplexed Editing and Screening applications)的新技术,其能应用到任何哺乳动物细胞中,同时系统性地靶向作用多个位点的DNA片段,CRISPR剪刀能通过导向RNA分子将DNA切割酶运送到基因组上的预想位点中,而使用最为广泛的DNA切割酶就是Cas9酶,自Cas9问世以来,科学家们一直寻找其它具有独特特性的Cas酶,以寻求改进和扩展该技术的应用;与CRISPR-Cas9技术不同的是,ChyMErA技术能将Cas9和Cas12a两种不同的DNA切割酶进行结合,从而实现多种用途,Cas12a酶是一种能用来在相同细胞中产生多个导向RNA分子的关键酶类,而这是同时进行DNA编辑的关键。
研究者Thomas Gonatopoulos-Pournatzis表示,我们花费了多年来开发能同时检测Cas9和Cas12a酶的组合性基因编辑技术,随后我们将这些酶类进行结合开发出了ChyMErA系统;研究人员尝试了多种方法来诱导基因片段缺失,但并没有哪一种手段会比ChyMErA更加有效;研究者发现,ChyMErA能够成功剔除基因片段,随后研究者在大规模筛查中利用该技术来系统性地分析基因如何进行结合来发挥作用。在ChyMErA技术的帮助下,研究人员就能够使用两种酶中最好的酶类来进行基因编辑,Cas9已经被广泛改进拥有较高的编辑效率,而Cas12a则能允许多种导向RNAs的使用,因此其在寻找能在基因组中进行位点切割上具有更大的灵活性。
6.Nature子刊重大突破:纳米颗粒实现器官特异性基因编辑!
doi:10.1038/s41565-020-0669-6
在最新一期Nature Nanotechnology上,Qiang Cheng等人提出了一种称为选择性器官靶向(SORT)的方法,通过生物工程将含有核酸疗法的LNPs诱导肝脏、脾脏和肺特异性基因调控。LNP系统通常由磷脂、胆固醇、聚乙二醇(PEG)脂质和可电离的阳离子脂质组成。每个LNP成分及其摩尔比都已被优化,以确保高效的核酸递送到肝细胞。特别是,合理设计和筛选可电离的阳离子脂质(或类脂质)文库对于实现临床应用相关剂量的肝基因沉默至关重要。最有效的电离阳离子脂质,其特征是明显的pKa值在6.2和6.5之间,具有三种功能:(1)在LNP生产期间,酸性pH值下质子化的叔胺脂质头部促进其与带负电荷的核酸结合,(2)在生理的pH值,附近无电荷的脂质确保净中性表面电荷,以减少免疫反应和循环时间延长和(3)细胞摄取后进入酸化的内体中,正电荷脂质促进膜融合和有效的胞质递送。
在这种SORT方法中,作者添加五分之一脂质成分来通过静脉注射递送功能信使核糖核酸或基因编辑复合物道特定组织。使用一个快速的混合过程,这种SORT脂质 (永久的阳离子和阴离子或可质子化的阳离子)和不同摩尔比的其他材料生成一个脂质体文库,包载mRNA编码荧光素酶进行体内筛选。通过增加永久性阳离子脂质1,2-二烯烃-3-三甲氨基丙烷(DOTAP)的摩尔百分比(0-100%),可使荧光素酶的表达在静脉注射后从肝脏转移到脾脏和肺。LNPs中加入10-40%的永久性阴离子脂质1,2-二烯醇化酶-sn-甘油-3-磷酸(18PA)可在脾脏中特异性表达荧光素酶。加入20%的其他可电离的阳离子脂类,如1,2-二烯酰-3-二甲基氨基甲烷-丙烷(DODAP),不会改变生物分布,但增加了mRNA对肝脏的递送。该方法的普遍性通过将LNP与其他永久性带电或可电离的阳离子脂类功能化而得到证实,这导致了器官表达的类似变化,且表现出与脂类相关的方式。值得注意的是,SORT-LNP的疗效离不开可电离的阳离子脂质包合。给予肺、脾脏和肝脏特异性mRNA SORT-LNP的筛选结果表明,基于荧光素酶的筛选可产生持续的治疗性蛋白,且无明显毒性。重要的是,SORT方法还允许调节LNPs组织特异性荧光素酶的表达,使其与临床批准的Onpattro配方相同。
Cheng等人也报道了使用SORT-LNPs进行组织特异性CRISPR/Cas基因编辑。相对于治疗性基因沉默或表达,基于CRISPR/Cas的基因编辑需要(至少)两个组成部分:引导RNA (guide RNA, gRNA)识别目标DNA和Cas核酸酶进行双链断裂。作者生成了包含gRNA和Cas9 mRNA或gRNA/Cas9核糖核酸蛋白复合物的SORT-LNPs,并在肝外组织中进行了基因编辑。在红色荧光蛋白tdTomato报告小鼠中,不同种类的LNP剂型可选择性诱导肝、肺、脾特异性基因编辑。此外,作者还展示了内源性靶基因(PTEN)和治疗性靶基因(PCSK9)的组织特异性编辑。
7.Nat Cancer:Crispr技术揭示淋巴瘤弱点
doi:10.1038/s43018-020-0054-2
在最近一项研究中,美国加州大学圣地亚哥医学院和摩尔斯癌症中心的研究人员团队利用CRISPR技术鉴定出了侵袭性慢性骨髓性白血病的关键调节剂。

图片来源:Www.pixabay.com。
"我们利用CRISPR技术在白血病细胞中进行全基因组筛查,一次性阻断数千个基因。这是一个非常强大的工具,使我们能够识别出助长白血病生长的众多基因,并找到了可以在这种疾病中靶向治疗的新漏洞。"高级作者、药理学和医学系教授Tannishtha Reya博士说。"这项研究还首次表明,基于全基因组CRISPR的筛查实际上可以以更符合生理学的方式进行:使用原生癌细胞,并在原生微环境的环境中进行。"
在2020年4月20日的《Nature Cancer》杂志上发表的文章中,Reya及其同事确定了RNA结合蛋白是维持和保护耐药性白血病干细胞的一类关键蛋白。作者们重点研究了Staufen2(Stau2),这是RNA结合蛋白家族中一个相对较少研究的成员,以前只知道它能控制大脑和神经系统的发育。
该团队开发了一种小鼠模型,在该模型中,Stau2被基因删除。作者发现,丢失这种蛋白会导致白血病的癌细胞生长和繁殖能力大大降低,并明显提高了小鼠模型的整体存活率。Stau2也是白血病患者原代组织样本的持续生长所需要的,这表明在人类疾病中存在着保守的依赖性。
8.Mol Ther:研究表明基因疗法可以成功治疗青光眼
doi:10.1016/j.ymthe.2019.12.012
由布里斯托尔大学领导的一项新研究表明,一种常见的眼病--青光眼,可以通过单次注射的基因疗法成功治愈,这将改善许多患者的治疗方案、疗效和生活质量。他们测试了一种新的方法,可以提供额外的治疗选择和好处。他们的研究结果发表在《Molecular Therapy》杂志上。
研究人员设计了一种基因疗法,并利用实验性青光眼小鼠模型和人类供体组织进行了概念验证。该疗法针对眼睛的一部分称为睫状体的结构,睫状体产生的液体可以维持眼内的压力。利用最新的基因编辑技术CRISPR,作者能够使睫状体中的一种名为Aquaporin 1的基因失活,导致眼压降低。
文章作者,布里斯托尔医学院客座高级研究员Colin Chu博士说。"目前,青光眼还没有治愈的方法,如果不及早诊断和治疗,会导致视力下降。我们希望在不久的将来推进这种新疗法的临床试验。如果成功的话,可以通过单眼注射的方式长期治疗青光眼,这将改善许多患者的生活质量,同时节省时间和金钱。"
9.Science子刊:干细胞遗传修饰可改善糖尿病
doi:10.1126/scitranslmed.aax9106
根据最近一项研究,研究人员利用从一名患有罕见的胰岛素依赖型糖尿病(Wolfram综合症)的患者皮肤上提取的细胞诱导产生多能干细胞,并且将其转化为分泌胰岛素的细胞,通过基因编辑工具CRISPR-Cas9,纠正导致该综合症的基因缺陷。然后,他们将这些细胞植入小鼠体内,并治愈了这些小鼠的糖尿病。

图片来源:Www.pixabay.com。
这一来自华盛顿大学医学院圣路易斯分校的研究人员的研究结果表明,CRISPR-Cas9技术可能作为治疗糖尿病,特别是由单一基因突变引起的糖尿病的有力武器。该研究于4月22日在线发表在《Science Translational Medicine》杂志上。
"这是CRISPR首次被用于修复因基因缺陷引起的糖尿病,"共同研究者、华盛顿大学医学和生物医学工程助理教授Jeffrey R. Millman博士说。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


