CAR-T细胞疗法研究进展(第36期)
来源:生物谷原创 2023-04-30 05:46
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1. JCI:分泌IL-18的DLL3 CAR-T细胞有望治疗小细胞肺癌
doi:10.1172/JCI166028
在一项新的临床前研究中,来自美国罗斯威尔公园综合癌症中心和威尔康奈尔医学院的研究人员发现一种称为嵌合抗原受体(chimeric antigen receptor,CAR)T细胞(CAR-T)疗法的新方法显示出对小细胞肺癌(small cell lung cancer, SCLC)的巨大前景。这一发现为我们了解如何利用CAR-T细胞治疗实体瘤癌症提供了新的基础,并为在癌症患者身上开展进一步研究提供了支持。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“IL-18-secreting CAR T cells targeting DLL3 are highly effective in small cell lung cancer models”。
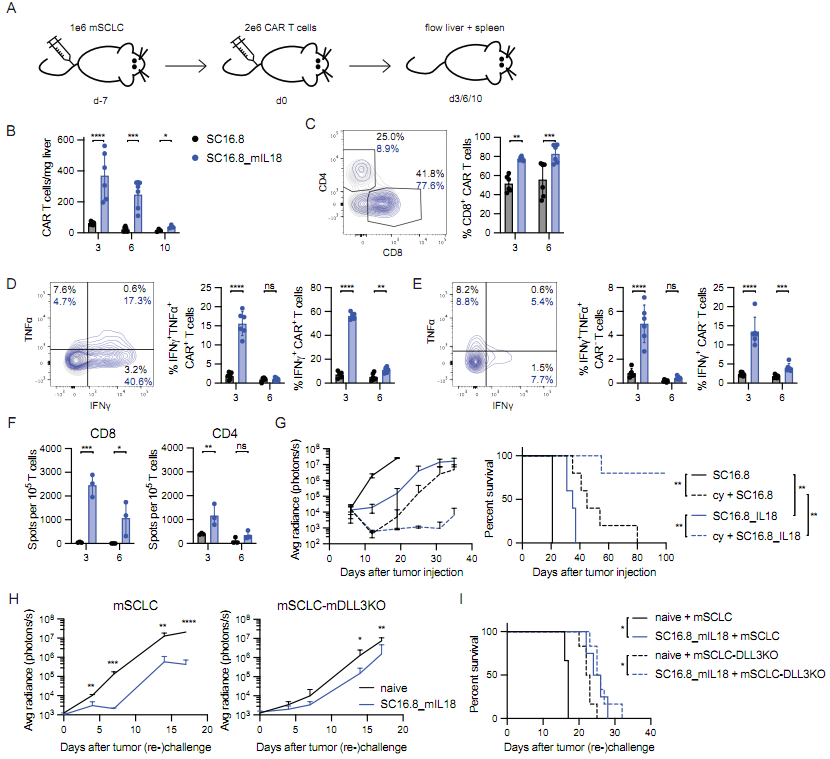
图片来自Journal of Clinical Investigation, 2023, doi:10.1172/JCI166028。
首先,他们开发的CAR-T细胞能够靶向delta-like ligand 3(DLL3),即一种在SCLC肿瘤细胞表面上发现的抗原。然后他们更进一步,将它们升级为能够表达另一种分子---白细胞介素-18(IL-18)---的“装甲型CAR-T细胞”,其中IL-18是一种由IL-18基因编码的蛋白,能够调节免疫系统对疾病的反应。
在SCLC的异种移植和小鼠模型中,这些分泌IL-18的CAR-T细胞靶向DLL3,极大地增加了抗肿瘤活性,由此产生的抗肿瘤反应比IL-12和IL-16(研究期间评估的另外两种白细胞介素分子)更强。IL-18还减少了T细胞衰竭,使靶向DLL3的CAR-T细胞(DLL3 CAR-T细胞)增殖并活得更久,并产生了更多能够“记住”DLL3抗原的T细胞,以便它们能够在未来继续进行靶向破坏。与此同时,IL-18激活了更多的肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocyte, TIL),即一类进入肿瘤进行杀伤的免疫细胞。
2. AACR2023:靶向CD70的异体CAR-T细胞有望治疗转移性透明细胞肾细胞癌
新闻:AACR: Novel allogeneic CAR T cell therapy delivers promising early results in patients with metastatic clear cell renal cell carcinoma
由来自美国德克萨斯大学MD安德森癌症中心的研究人员领导的1期临床试验结果显示靶向CD70的异体嵌合抗原受体(CAR)T细胞(CAR-T)疗法ALLO-316在转移性透明细胞肾细胞癌(clear cell renal cell carcinoma, ccRCC)患者中的反应率和疾病控制率令人鼓舞,并且在美国癌症研究协会2023年年会上公布。
这项正在进行的称为TRAVERSE的临床试验由德克萨斯大学MD安德森癌症中心干细胞移植与细胞治疗助理教授Samer Srour博士领导,是第一项在免疫检查点抑制剂和酪氨酸激酶抑制剂(TKI)均无效的转移性ccRCC患者中评估ALLO-316的人体研究。
在17名患者中,客观反应率(objective response rate, ORR)为18%,疾病控制率(disease control rate, DCR)为82%。对于9名确认患有CD70+转移性ccRCC的患者,ORR为33%,DCR为100%。
Srour说,“随着我们继续为患者确定ALLO-316的适当剂量,我们的结果不仅展示了可控的安全性,而且还展示了非常令人鼓舞的抗肿瘤活性。在这项临床试验中,我们使用的是异体‘现成的’CAR-T细胞产品,这为我们的患者提供了额外的好处,因为我们能够更快地将这种新的治疗方法提供给我们的患者。”
经过基因改造后,ALLO-316靶向CD70,其中CD70在多种实体瘤癌症中表达,在ccRCC(一种肾癌亚型)中高度表达。为了减少移植物抗宿主疾病(graft-versus-host disease, GVHD)的风险,ALLO-316细胞中的T细胞受体α也被破坏。此外,CD52基因被敲除,以允许使用ALLO-647,即一种可剔除宿主T细胞并改善异体CAR-T细胞持久性的抗CD52单克隆抗体。
3.Nat Immunol:发现负责引导CAR-T细胞迁移到肿瘤中的蛋白分子
doi:10.1038/s41590-023-01498-x
免疫疗法,特别是治疗癌症的CAR-T细胞疗法,正在延长许多患者的生命。但有时这种疗法中的CAR-T细胞会随机迁移到它不应该去的地方,塞进肺部或其他非癌变组织,并导致毒副作用。在一项新的研究中,来自美国罗切斯特大学等研究机构的研究人员发现了负责引导T细胞迁移到肿瘤中的分子,从而为科学家们改进这一突破性疗法创造了条件。相关研究结果于2023年4月17日在线发表在Nature Immunology期刊上,论文标题为“ST3GAL1 and βII-spectrin pathways control CAR T cell migration to target tumors”。

hHER2 CAR-T细胞检测及体内分布。图片来自Nature Immunology, 2023, doi:10.1038/s41590-023-01498-x。
这些作者通过“无偏见的基因组筛选”发现了表达ST3GAL1的关键迁移控制基因。他们使用前沿的CRISPR技术对数千个在T细胞中表达的基因进行编辑,然后在近四年的时间里,在小鼠模型中逐一测试了这些基因的迁移控制能力。
论文通讯作者、罗切斯特大学医学中心威尔莫特癌症研究所的Minsoo Kim博士说,下一步是找到一种能够操纵关键T细胞蛋白ST3GAL1的药物。Kim说,如果研究按计划进行,可能能够将这样的药物添加到CAR -T细胞治疗方案中,以确保T细胞正确地靶向它们的靶标。他的实验室正在与罗切斯特大学医学中心威尔莫特癌症研究所的其他研究人员合作,筛选能够完成这一壮举同时也将威胁生命的副作用的风险降到最低的药物。
4.NEJM:临床研究表明CAR-T细胞疗法有望治疗神经母细胞瘤
doi:10.1056/NEJMoa2210859
在一项新的研究中,意大利研究人员发现一种使用增强免疫细胞的新疗法似乎对患有一种罕见癌症的儿童体内的肿瘤有效。他们报告说,27名儿童中有9人在接受这种治疗6周后没有癌症的迹象,尽管有两人后来出现癌症复发并死亡。相关研究结果发表在2023年4月6日的期刊上,论文标题为“GD2-CART01 for Relapsed or Refractory High-Risk Neuroblastoma”。
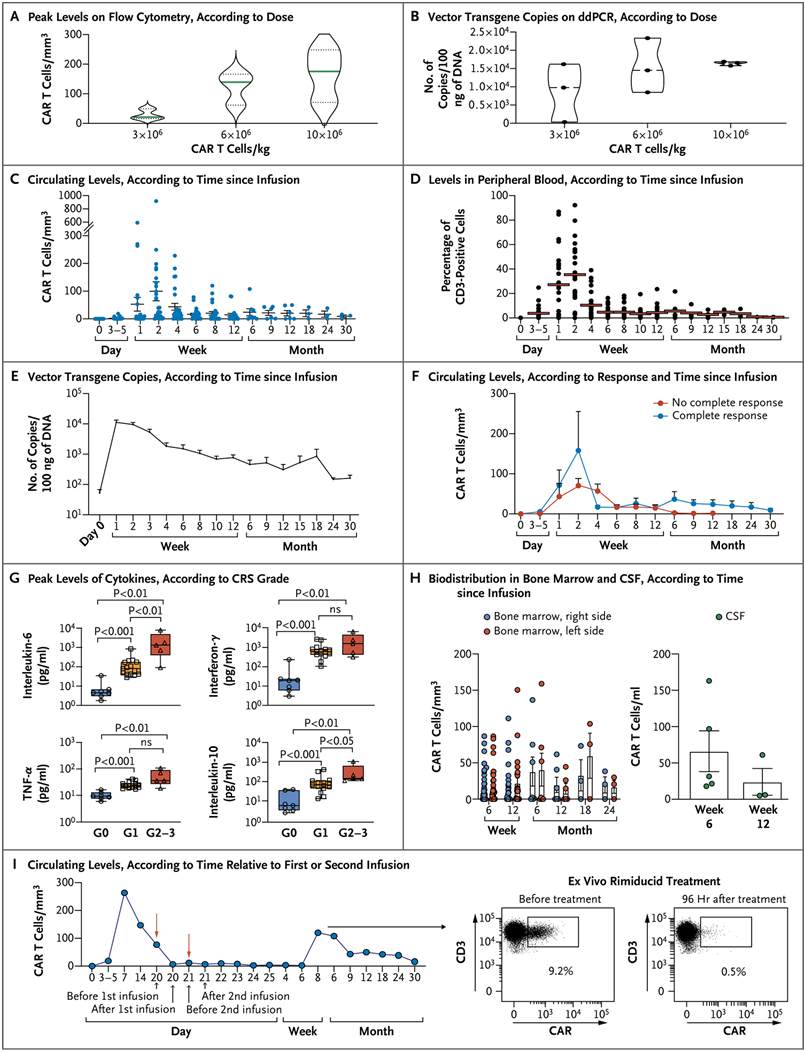
GD2-CART01的扩增、持久性和生物分布。图片来自NEJM, 2023, doi:10.1056/NEJMoa2210859。
这种称为CAR-T细胞疗法(GD2-CART01)的治疗方法已经被用来帮助免疫系统对抗血液中的白血病和其他癌症。该领域的专家们说,这是科学家们第一次在实体瘤中取得如此令人鼓舞的结果,并带来了它可以用来对付其他类型癌症的希望。
当这项为期三年的新研究结束时,有11名儿童还活着,其中包括一些对治疗只有部分反应的儿童,他们接受了重复剂量的经过基因修改的细胞治疗。美国宾夕法尼亚大学的Carl June博士(没有参与这项新的研究)说,“如果没有这种疗法,这些儿童注定都会死亡。从来没有患者有过这样的反应,因此我们只是不知道十年后会是什么样子。当然,基于这些令人兴奋的结果,如今将会有更多的临床试验。”
5.Blood Adv:探究成年恶性血液病患者在接受CAR-T细胞治疗后的生活质量和临床症状
doi:10.1182/bloodadvances.2022009117
一项新的研究显示,对于接受嵌合抗原受体(chimeric antigen receptor, CAR)T细胞(CAR-T)治疗的成年恶性血液病患者来说,生活质量会恶化,身体和心理症状会在输注CAR-T细胞一周后恶化,然后在输注六个月后得到改善。相关研究结果近期发表在Blood Advances期刊上,论文标题为“Longitudinal Patient-reported Outcomes in Patients Receiving Chimeric Antigen Receptor T-Cell Therapy”。
在这项新的研究中,美国麻省总医院的Patrick Connor Johnson博士及其同事们在基线、一周、一个月、三个月和六个月后对患有恶性血液病的成年人在输注CAR-T细胞后的生活质量、心理压力和身体症状进行了研究。2019年4月至2021年11月期间,共有100名患者入选。
这些作者发现,到一周时,生活质量和抑郁症状出现恶化,随后在CAR-T治疗后的六个月内得到改善。到六个月时,分别有18%、22%和22%的患者报告了临床显著的抑郁、焦虑和创伤后应激障碍症状。52%的患者在一周内出现了严重的身体症状,在CAR-T细胞输注后的六个月内下降到28%。在未经调整的模型中,较差的东部肿瘤协作组(Eastern Cooperative Oncology Group)表现、接受托珠单抗(tocilizumab)和接受皮质类固醇治疗细胞因子释放综合征和/或免疫效应细胞相关神经毒性综合征与较高的生活质量轨迹有关联。
6.Sci Transl Med:科学家开发出有望治疗人类实体瘤的新型CAR-T细胞疗法
doi:10.1126/scitranslmed.abk1900
由于CAR-T细胞扩张和持久性的增加,接受富含记忆T细胞的CAR-T细胞的患者往往疾病控制地更好。包括干细胞样的CD8+ 记忆T细胞祖细胞在内的人类记忆T细胞会成为功能性的干细胞样T细胞(TSTEM)或功能失调的T组细胞细胞(TPEX)。近日,一篇发表在国际杂志Science Translational Medicine上题为“T STEM -like CAR-T cells exhibit improved persistence and tumor control compared with conventional CAR-T cells in preclinical models”的研究报告中,来自墨尔本大学等机构的科学家们通过研究开发了一种新型的嵌合抗原受体细胞疗法(CAR-T细胞疗法),其或能帮助有效抵御实体瘤。
CAR-T细胞疗法是一种创新性的免疫疗法,其能利用机体自然发生的T细胞(形成机体免疫系统的必要部分)来靶向作用并摧毁所感染的细胞;这些T细胞能被收集起来并利用CAR受体重新改造,随后再一次性输注回患者体内来帮助抵御癌细胞。这项研究中,研究人员利用年轻干细胞样的T细胞而并不是常规的T细胞进行研究;在一种令人非常兴奋的发育过程中,称之为T细胞干细胞样CAR-T细胞在携带CAR受体时就能表现出强大的繁殖能力。
这项研究是朝着开发有效治疗人类实体瘤的新型CAR-T细胞疗法迈出的重要一步。研究者表示,由于CAR-T细胞疗法批准用于治疗多种类型的血液癌症,包括白血病、淋巴瘤和骨髓瘤,但其在实体瘤治疗中的成功依然非常有限,这或许是由于一些因素所造成的,包括CAR-T细胞扩张、持久性以及对抗肿瘤时的耗竭等因素。重要的是,在细胞培养物和四种临床前模型中,这些T细胞干细胞样CAR-T细胞或能改善抗肿瘤的功能,实际上,当与免疫检查点药物抗PD-1结合时其或许能完全清除已经存在的实体瘤。此外,其还能长期存在,这或许就表明,这些细胞拥有CAR-T细胞的所有标志特征。
这项研究中,研究人员首先创建了一种生产方案,能在短短的6天时间内(并非标准的14天)生产全部功能性的干细胞样CAR-T细胞,这或许就为后期实现更有成本效益和可扩展的过程打开了大门。这些重要的研究结果也支持了实施生产策略来产生用于临床的干细胞样CAR-T细胞的重要性。研究者Neeson教授说道,我们的目标是将这些细胞用于对疗法耐受的两种儿童白血病的治疗中,我们认为,这种新方法或能协调CAR-T细胞产品,使其具有一致的抗肿瘤功能和重要的持续能力。
7.Mol Cell:靶向mSWI/SNF复合物有望让CAR-T细胞减少衰竭,更持久地抗击癌症
doi:10.1016/j.molcel.2023.02.026
为攻击癌细胞而定制的CAR-T细胞疗法为人类癌症的治疗开辟了一个新时代,特别是在血液学恶性肿瘤方面。然而,它们往往表现出一个令人沮丧的特征,即从人体自身的T细胞中继承下来的抗癌能力的急剧丧失,这被称为“衰竭(exhaustion)”。衰竭不仅出现在抗癌的T细胞中,而且在病毒感染的情况下也很常见,比如人类免疫缺陷病毒(HIV)、乙型和丙型肝炎病毒(HBV、HCV)和新冠病毒(SARS-CoV-2)。
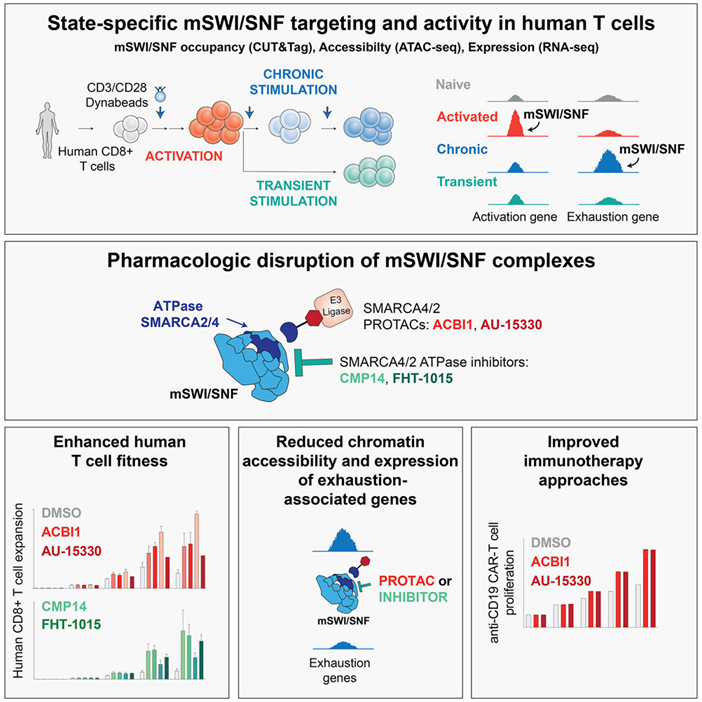
图片来自Molecular Cell, 2023, doi:10.1016/j.molcel.2023.02.026。
这种萎靡不振的状态削弱了CAR-T细胞疗法在一些患者中的有效性,并促使科学家们试图找到这种衰竭的来源。在一项新的研究中,来自美国丹娜-法伯癌症研究院和纽约大学格罗斯曼医学院的研究人员发现我们细胞核中的一组专门的蛋白---mSWI/SNF(或BAF)复合物---在激活T细胞攻击癌症和触发衰竭方面都发挥着指挥作用。这一发现表明,通过CRISPR等基因切割技术或使用靶向药物来靶向这些复合物中的某些复合物可以减少衰竭,使CAR-T细胞(以及一般来说,所有抗肿瘤的T细胞)拥有抗击癌症的持久力量。相关研究结果于2023年3月20日在线发表在Molecular Cell期刊上,论文标题为“Stepwise activities of mSWI/SNF family chromatin remodeling complexes direct T cell activation and exhaustion”。
论文共同通讯作者、丹娜-法伯癌症研究院的Cigall Kadoch博士说,“CAR-T细胞和其他由活细胞制成的疗法在治疗癌症和一系列其他疾病方面有巨大的潜力。然而,为了实现这一潜力,该领域曾与这种衰竭的问题进行过斗争。我们在这项新研究中的发现表明了解决这个问题的新的、临床上可操作的方法。”
8.NEJM:临床试验表明CAR-T细胞疗法Ide-cel 有望治疗复发的多发性骨髓瘤患者
doi:10.1056/NEJMoa2213614
3月是骨髓瘤宣传月(Myeloma Awareness Month)。在一项新的研究中,美国梅奥诊所综合癌症中心的血液学家/肿瘤学家Sikander Ailawadhi博士及其同事们分享了有关导致多发性骨髓瘤患者获得更好治疗结果的新进展的细节。相关研究结果发表在2023年3月16日的NEJM期刊上,论文标题为“Ide-cel or Standard Regimens in Relapsed and Refractory Multiple Myeloma”。
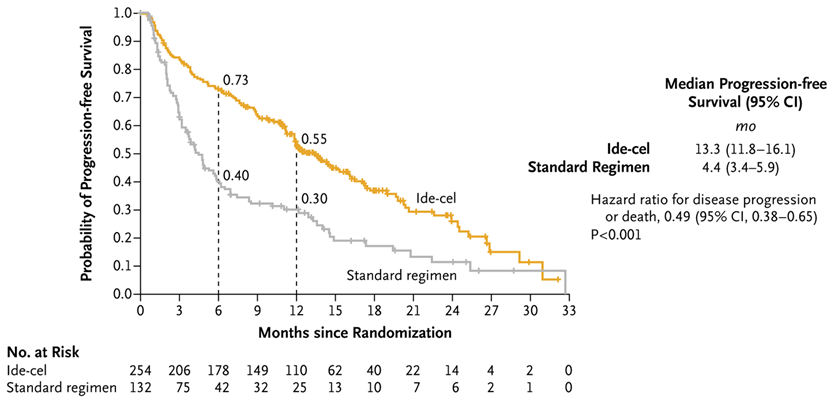
无进展生存期。图片来自New England Journal of Medicine, 2023, doi:10.1056/NEJMoa2213614。
在这项新的研究中,这些作者在之前接受过多发性骨髓瘤治疗但在治疗后疾病复发的多发性骨髓瘤患者中将CAR-T细胞疗法Ide-cel与目前可用的标准治疗方案进行了比较。他们测量了无进展生存期(progression-free survival),即患者在治疗期间和治疗后患病但病情没有恶化的时间。该研究显示,在18.6个月的中位患者随访中,接受CAR-T细胞治疗的组别中,患者的无进展生存期为13.3个月,而标准治疗组只有4.4个月。
Ailawadhi博士补充说,“这些发现表明,我们正朝着改变临床实践的研究方向前进,在复发多发性骨髓瘤患者的治疗过程中更早地提供CAR-T细胞疗法---这将有望成为未来的标准治疗。”
9.Nat Med:肠道微生物组在CAR-T细胞癌症免疫治疗中发挥关键作用
doi:10.1038/s41591-023-02234-6
在一项新的研究中,来自德国癌症研究中心(DKFZ)、以色列魏茨曼科学研究所、美国南佛罗里达大学和德克萨斯大学MD安德森癌症中心等研究机构的研究人员发现肠道微生物组可能调节对CAR-T细胞疗法在治疗B细胞淋巴瘤患者时的的疗效。在开始CAR-T细胞疗法治疗之前,从患者的肠道微生物组中获得的个性化肠道微生物组信息可以准确预测他们随后对这种治疗的反应性,但条件是这些患者没有预先进行广谱抗生素治疗。相关研究结果于2023年3月13日在线发表在Nature Medicine期刊上,论文标题为“A non-antibiotic-disrupted gut microbiome is associated with clinical responses to CD19-CAR-T cell cancer immunotherapy”。
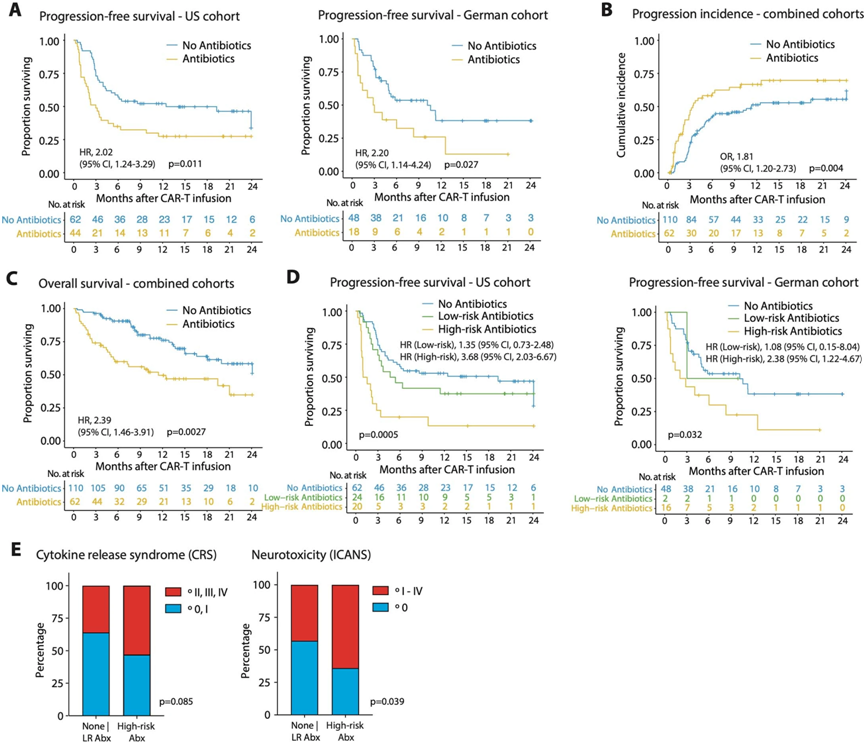
抗生素暴露对靶向CD19的CAR-T细胞治疗淋巴瘤患者生存结局和毒副作用产生的影响。图片来自Nature Medicine, 2023, doi:10.1038/s41591-023-02234-6。
来自人体研究和临床前实验的越来越多的证据表明,肠道微生物组可能会调节T细胞驱动的癌症免疫疗法(比如免疫检查点阻断)的疗效。靶向CD19的CAR-T细胞疗法(下称CD19 CAR-T细胞疗法)为某些形式的难治性和复发性B细胞白血病或淋巴瘤患者提供了新的治疗选择。但是这种免疫疗法因在反应性方面存在相当大的异质性而受到阻碍。最多只有40%的患者能获得完全和长期缓解。
在这项新的研究中,这些作者发现肠道微生物组可能调节CD19 CAR-T细胞疗法在治疗B细胞白血病和淋巴瘤患者时的的疗效。这项规模最大的前瞻性研究对172名先前多轮化疗失败的淋巴瘤患者进行了跟踪,从CAR-T细胞疗法启动前一直到启动两年后。有趣的是,20%接受诸如美罗培南(meropenem)、哌拉西林-他唑巴坦(piperacillin–tazobactam)或头孢吡肟(cefepime)之类的广谱(“高风险”)抗生素治疗的患者,与接受其他抗生素治疗的患者和治疗前未使用抗生素的患者相比,对随后的CAR-T细胞治疗的临床反应有所改变。
然而,这种与抗生素相关的CAR-T细胞疗法反应的降低并不是由抗生素本身的作用所驱动,而是由于在开始CAR-T细胞疗法之前接受“高风险”抗生素治疗的患者与未接受抗生素治疗的患者相比,往往具有更高的治疗前肿瘤负荷和系统性炎症。这些不利的治疗前条件使得随后的CAR-T细胞治疗效果不佳。
10.Nat Biotechnol:通过人工智能辅助分析,发现CAR-T细胞治疗急性髓系白血病的新靶标
doi:10.1038/s41587-023-01684-0
与其他形式的血癌不同,急性骨髓性白血病(AML)目前不能用CAR-T细胞疗法治疗。原因是缺乏某些免疫细胞能够特异性靶向AML细胞的特定分子靶标,这将使得免疫系统能够攻击癌症。如今在一项新的研究中,德国慕尼黑大学医院临床药理学系的Sebastian Kobold教授和Adrian Gottschlich博士及其研究团队与慕尼黑亥姆霍兹卫生人工智能研究所的Carsten Marr博士和Moritz Thomas及其研究团队成功发现了这样的分子靶标。相关研究结果于2023年3月13日在线发表在Nature Biotechnology期刊上,论文标题为“Single-cell transcriptomic atlas-guided development of CAR-T cells for the treatment of acute myeloid leukemia”。
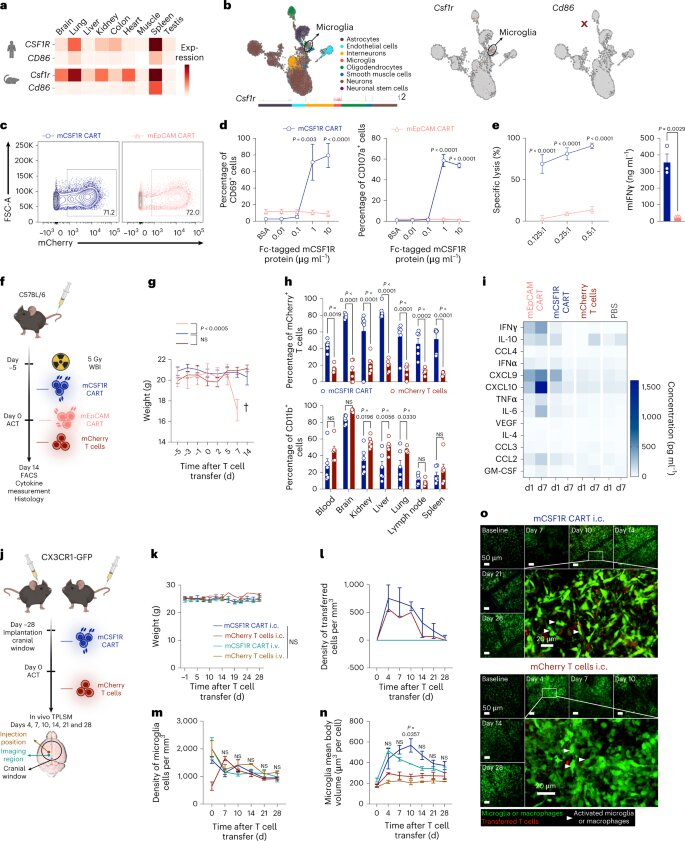
图片来自Nature Biotechnology, 2023, doi:10.1038/s41587-023-01684-0。
已获批准的针对CD19的CAR-T细胞并不适合AML,因为CD19(通常)不存在于AML细胞的表面。根据科学家们的说法,迄今为止,针对AML细胞其他表面分子的CAR-T细胞的临床结果是令人沮丧的。这是因为CAR-T细胞无法区分健康的细胞和退化的细胞,因而相应地引起了明显的副作用。
这些作者着手寻找理想情况下只在AML细胞表面发现的替代分子。在广泛的生物信息学分析的帮助下和通过整合来自50多万个细胞的表达数据,最终在25000种潜在的细胞表面分子中筛选出两种候选蛋白分子:CSF1R和CD86。Marr说,“几年前,这样的分析是不可能的,因为所需的单细胞数据是最近才产生的。”
这些作者在慕尼黑大学医院的实验室里生产了精确靶向这两种蛋白的CAR-T细胞。然后在不同的AML模型上测试了这些细胞,包括来自患者的AML细胞。根据Kobold的说法,结果很有希望:“一方面,这些CAR-T细胞对AML有效,另一方面,它们几乎不破坏健康细胞。”
11.JITC:让肿瘤血管正常化有望改善CAR-T细胞抗击胶质母细胞瘤等实体瘤的疗效
doi:10.1136/jitc-2022-005583
一种称为嵌合抗原受体(CAR)-T细胞疗法的免疫疗法已经彻底改变了多种血癌的治疗方法,但对胶质母细胞瘤--最致命的原发性脑癌---和其他实体瘤的疗效有限。在一项新的研究中,来自美国麻省总医院等研究机构的研究人员发现校正实体瘤血管异常的药物可以改善CAR-T细胞的递送和功能。相关研究结果于2023年3月10日在线发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“Anti-VEGF therapy improves EGFR-vIII-CAR-T cell delivery and efficacy in syngeneic glioblastoma models in mice”。
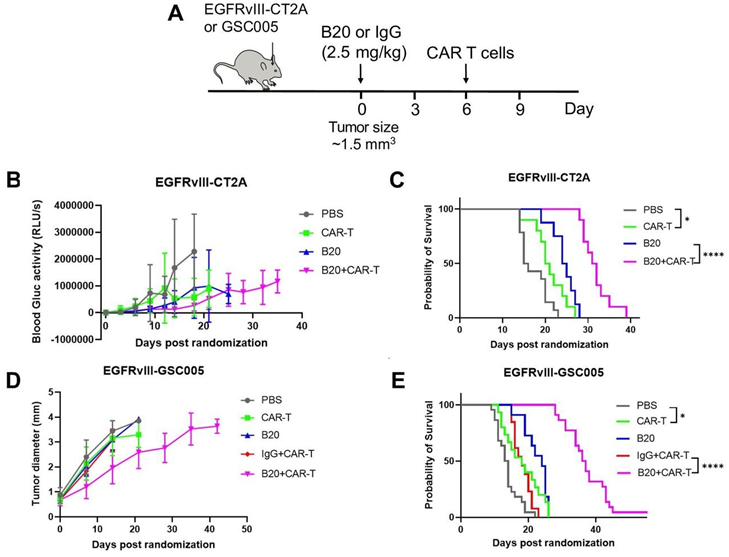
抗VEGF治疗提高了EGFRvIII-CAR-T细胞在小鼠GBM肿瘤模型中的疗效。图片来自Journal for ImmunoTherapy of Cancer, 2023, doi:10.1136/jitc-2022-005583。
论文通讯作者、麻省总医院肿瘤生物学实验室主任Rakesh K. Jain博士说,“CAR-T细胞疗法对实体瘤效果不佳的主要原因之一是,静脉给送的CAR-T细胞只能迁移到肿瘤的浸润性边缘或只能在肿瘤的有限区域迁移。另外,肿瘤在其周围创造了一种免疫抑制性微环境,保护它们免受CAR-T细胞疗法和其他通过血液供应静脉给送的抗癌治疗。”
Jain和他的同事们之前已指出利用最初是为了抑制新血管的生长而开发的抗血管生成药物(anti-angiogenesis drug)使肿瘤的血管“正常化”可以改善身体自然产生的免疫细胞的递送和抗癌功能。
Jain解释道,“因此,我们试图研究我们是否能够通过使用一种阻断重要的血管生成分子---血管内皮生长因子(VEGF)---的抗体使胶质母细胞瘤血管正常化,从而改善CAR-T细胞的浸润并克服异常的肿瘤微环境所带来的抵抗机制。”
12.Adv Mater:中国科学家开发出了基于磁声驱动的CAR-T细胞微型机器人 有望帮助开发精准化的新型抗肿瘤免疫疗法
doi:10.1002/adma.202211509
近日,一篇发表在国际杂志Advanced Materials上题为“Magnetic‐acoustic Sequentially Actuated CAR T cell Microrobots for Precision Navigation and in‐situ Antitumour Immunoactivation”的研究报告中,来自中国科学院深圳先进技术研究院等机构的科学家们通过研究开发出了一种基于CAR-T细胞的微型机器人(M-CAR T),该机器人具有磁—声顺序驱动功能,能通过使用单击共轭技术对CAR-T细胞装饰免疫磁珠,从而自主导航到肿瘤位点并进行相应的细胞免疫治疗。
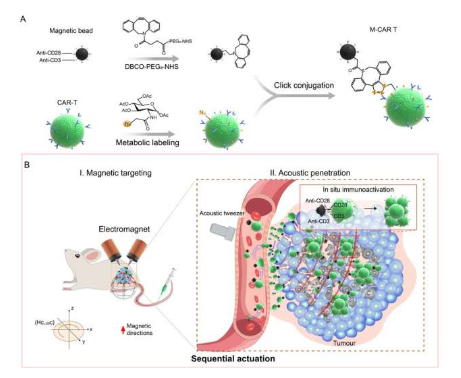
中国科学家开发出了基于磁声驱动的CAR-T细胞微型机器人 有望帮助开发精准化的新型抗肿瘤免疫疗法。图片来源:Advanced Materials (2023). DOI:10.1002/adma.202211509。
基于免疫磁珠工程学技术,这种M-CAR T机器人就能展示出可控的反流和躲避障碍的运动模式,并能在磁力引导下来保持按需路线,与此同时也能表现出独特的声学操控特性,并能发挥对CAT-T细胞的控制作用,还能在磁—声顺序驱动下来主动传统人工的肿瘤组织。研究者Cai教授说道,顺序驱动能使M-CAR Ts具有磁力驱动的反流和躲避障碍的能力,同时还使其拥有了声学驱动的肿瘤组织穿透力,这或许就能使其在人工肿瘤模型中能有效地迁移和积累。
在动物模型中,连续驱动的M-CAR Ts就能实现远距离靶向作用,并能在程序性的磁力引导下在肿瘤周围区域进行积累;随后,声学镊子(acoustic tweezers)所驱动的M-CAR Ts就能迁移到肿瘤深处,相比没有驱动的M-CAR Ts而言,驱动的M-CAR Ts所积累的外源性CD8+ CAR-T细胞增加了6.6倍。Pan Hong博士认为,巧妙的是,抗CD3/CD28免疫磁珠就能刺激所浸润的CAR-T细胞在原地进行增殖和激活,这就显著增强了其抗肿瘤的免疫效率。
M-CAR T能维持CAR-T细胞的生物活性特性,且能通过磁力推动空间靶向和声学驱动的肿瘤穿透,从而应对血管反流以及迁移到肿瘤深处所遭遇的障碍;当进入到肿瘤组织后,免疫磁珠就能在原位刺激CAR-T细胞来通过有效的扩张和激活克服机体的免疫抑制性肿瘤环境。综上,本文研究结果表明,诸如这种顺序驱动引导的细胞微型机器人能将智能机器人的自主定位和穿透性与T细胞的原位免疫激活的优点相结合,其或许就为实体瘤的临床精准化免疫治疗带来了极大的希望,并能在未来的精准化导航和癌症免疫疗法方面具有极大的应用前景。
13.PNAS:“组合拳”方法可使T细胞扩增至少10倍,有望提高CAR-T细胞治疗实体瘤的疗效
doi:10.1073/pnas.2218632120
在一项新的临床前研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员旨在提供一种帮助T细胞攻击实体瘤的“组合拳”方法。他们发现靶向两种控制与与炎症有关的基因功能的调节因子能够临床前模型中的T细胞扩增至少10倍,从而提高它们的抗肿瘤免疫活性和持久性。相关研究结果于2023年3月15日发表在PNAS期刊上,论文标题为“Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells”。
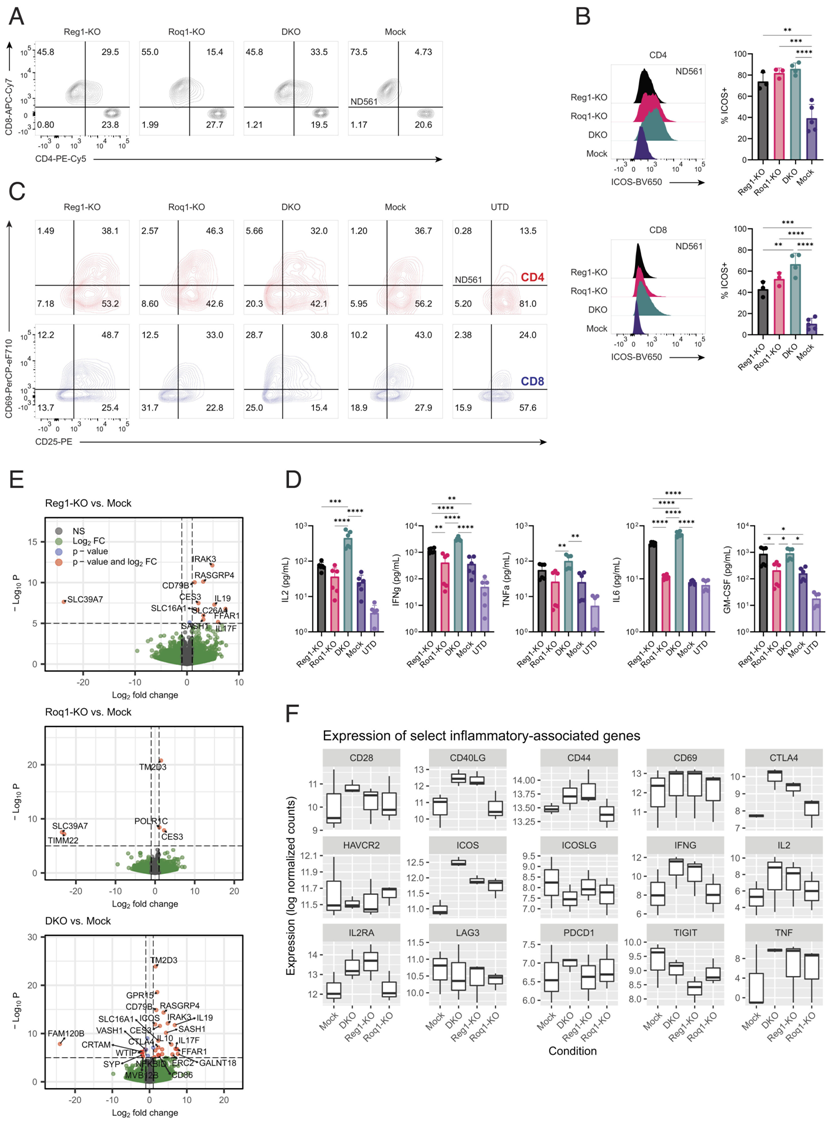
Regnase-1和Roquin-1双敲除改变静止性工程化T细胞的激活谱。图片来自PNAS, 2023, doi:10.1073/pnas.2218632120。
以前的观察性研究提示着炎症调节因子Regnase-1是间接克服T细胞衰竭影响的潜在靶标,因为它在T细胞中遭受破坏时能引起过度炎症,让它们重新激活产生抗肿瘤反应。这些作者假设同时靶向相关但独立的Roquin-1调节因子能够进一步提升抗肿瘤反应。
这些作者使用CRISPR-Cas9基因编辑技术单独或共同敲除了携带两种不同免疫受体---靶向间皮素(mesothelin)的M5 CAR(mesoCAR)和靶向NY-ESO-1的8F TCR(NYESO TCR)---之一的健康供者T细胞中的Regnase-1和Roquin-1,这些携带不同免疫受体的T细胞目前正在进行1期临床试验研究。这两种经过基因改造的T细胞产品都不靶向CD19,即大多数获批的CAR-T细胞疗法靶向识别的抗原,因为这种抗原不存在于实体瘤中。
在经过CRISPR-Cas9基因编辑之后,这些T细胞经扩增后被灌注到实体瘤小鼠模型中。这些作者观察到,与单独敲除Regnase-1相比,双重敲除Regnase-1和Roquin-1导致经过基因改造的T细胞数量至少扩增10倍,并且增加了这些经过基因改造的T细胞的抗肿瘤免疫活性和寿命。在一些小鼠中,它还导致了淋巴细胞的过度产生,引起了毒副作用。(生物谷 Bioon.com)
相关生物谷新闻:
CAR-T细胞疗法研究进展(第35期)
https://news.bioon.com/article/4b40e613612e.html
CAR-T细胞疗法研究进展(第34期)
https://news.bioon.com/article/4198e575451e.html
CAR-T细胞疗法研究进展(第33期)
https://news.bioon.com/article/c0b4e49733ba.html
CAR-T细胞疗法研究进展(第32期)
https://news.bioon.com/article/1cc9e41516ed.html
CAR-T细胞疗法研究进展(第31期)
https://news.bioon.com/article/18a5e37253a6.html
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


