罕见病新药!C3抑制剂pegcetacoplan:将成阵发性睡眠性血红蛋白尿症(PNH)临床护理新标准!
来源:本站原创 2020-12-11 20:53
pegcetacoplan将成为阵发性睡眠性血红蛋白尿症(PNH)新的护理标准!

2020年12月11日讯 /生物谷BIOON/ --Apellis Pharma是C3靶向疗法开发方面的领导者,致力于通过开创性的靶向C3方法开发首创和同类最佳疗法,用于治疗由补体级联反应的不受控或过度激活所驱动的广泛疾病,包括血液学、眼科学和肾脏学领域的疾病。
近日,该公司公布了III期PEGASUS研究的48周阳性顶线结果。该研究显示,接受pegcetacoplan(APL-2)治疗的阵发性睡眠性血红蛋白尿症(PNH)患者的血液学和临床状况持续改善。pegcetacoplan的安全性与先前报告的数据一致,没有发现新的安全信号。
目前,pegcetacoplan治疗PNH的新药申请(NDA)正在接受美国FDA的优先审查。此外,pegcetacoplan治疗PNH的营销授权申请(MAA)也正在接受欧洲药品管理局(EMA)的审查。在临床试验中,该药已被证实了提升PNH护理标准的潜力,有望重新定义PNH的治疗。
pegcetacoplan的NDA和MAA,均基于头对头3期PEGASUS研究(NCT03500549)的结果。该研究达到了主要终点,证明pegcetacoplan优于PNH标准护理药物Soliris(eculizumab):在16周时血红蛋白水平在统计学上有显著改善,溶血的关键标志物的正常化率更高,FACIT-疲劳评分具有临床意义的改善。在该研究中,pegcetacoplan的安全性与Soliris相当。
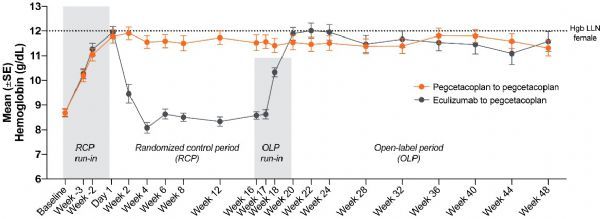
完成PEGASUS研究16周随机对照期的所有患者(n=77)进入开放标签期,从第17周至第48周接受pegcetacoplan治疗。数据显示,在第48周时,pegcetacoplan治疗的患者血红蛋白持续增加,与基线检查时的平均改善值2.7 g/dL相当,相当于pegcetacoplan治疗患者第16周时的平均增加值2.7 g/dL。此外,Soliris治疗的患者在开放标签期内改用pegcetacoplan治疗,其血红蛋白和其他血液学和临床指标持续改善,与随机对照期内接受pegcetacoplan单药治疗的患者相似。
除了血红蛋白持续改善外,接受pegcetacoplan治疗的患者在关键次要终点方面也保持改善。在整个48周研究期间,73%接受pegcetacoplan治疗的患者保持无输血。相比之下,25%患者在接受Soliris治疗时,在进入PEGASUS研究前一年中无需输血。其他疾病标志物的改善,如网织红细胞计数、乳酸脱氢酶(LDH)水平和慢性疾病治疗(FACT)疲劳评分的功能评估,都保持不变。总体而言,在整个48周研究期间,pegcetacoplan的安全性与先前报告的数据一致。
尽管有治疗方法,但许多PNH患者仍然表现持续性低血红蛋白,这可能导致需要频繁输血和使人虚弱的疲劳。PEGASUS研究的长期数据表明,如果pegcetcoplan获得批准,有潜力为这些医疗需求严重未得到满足的患者提供有意义和持久的治疗受益。
值得一提的是,pegcetacoplan是第一个在血红蛋白水平上显示出优于Soliris的研究性疗法,高达85%接受pegcetacoplan治疗的患者没有输血。而目前接受Soliris治疗的PNH患者中,大多数都患有持续性贫血。PEGASUS研究的结果显示,pegcetacoplan有潜力成为PNH患者的新护理标准。
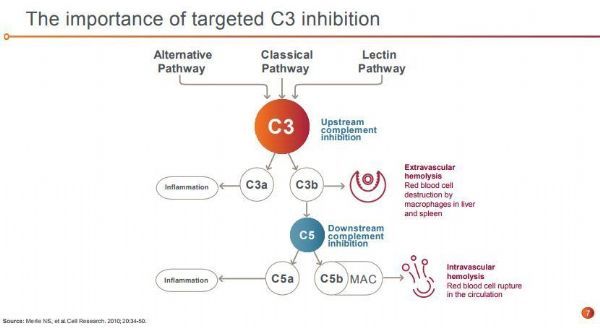
pegcetacoplan是一种研究性、靶向性C3抑制剂,旨在调节补体过度激活,这是导致许多严重疾病发生和发展的原因。pegcetacoplan是一种合成的环肽,与一种聚乙二醇聚合物结合,特异性地与C3和C3b结合。目前,pegcetacoplan正被开发用于治疗多种疾病,包括PNH、地图样萎缩(GA)和C3肾小球病。在美国,FDA已授予pegcetacoplan治疗PNH和GA的快速通道资格。
Soliris是Alexion公司销售的一款药物,这是一种首创的补体抑制剂,通过抑制补体级联反应终端部分的C5蛋白发挥作用。补体级联反应是免疫系统的一部分,其不受控激活在多种严重的罕见病和超级罕见病中发挥了重要作用。Soliris于2007年首次获准上市,之前已获批多种超级罕见病:PNH、非典型溶血尿毒症综合征(aHUS)、抗AchR抗体阳性全身性重症肌无力(gMG)、抗水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎谱系障碍(NMOSD)。
Soliris是全球最畅销的孤儿院之一,2018年销售额高达35.63亿美元。目前,Alexion公司也正在开发Soliris的升级版产品Ultomiris,后者已于2018年12月获得FDA批准PNH适应症。2019年10月,Ultomiris获FDA批准新适应症:治疗aHUS儿童和成人患者。Ultomiris是第一种也是唯一一种每8周给药一次的长效C5补体抑制剂,在治疗PNH的III期临床研究中,Ultomiris每2个月(8周)输注一次与Soliris每2周输注一次在全部11个终点方面均达到了非劣效性。(生物谷Bioon.com)
原文出处:Apellis, Sobi's pegcetacoplan shows positive action in rare blood disorder
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->