2020年双特异性抗体研究进展及其展望
来源:本站原创 2020-12-31 23:23
2020年12月31日讯/生物谷BIOON/---1960年,A. Nisonoff等人提出了双特异性抗体(bispecific antibodys)的这一概念。1986 年,Staerz 和Bevan 第一次利用双特异性抗体把细胞毒性T 淋巴细胞( CTL) 运用于癌细胞溶解实验。在此之后,随着基因工程和抗体工程等分子生物学技术不同取得突破,科学家们开发出
2020年12月31日讯/生物谷BIOON/---1960年,A. Nisonoff等人提出了双特异性抗体(bispecific antibodys)的这一概念。1986 年,Staerz 和Bevan 第一次利用双特异性抗体把细胞毒性T 淋巴细胞( CTL) 运用于癌细胞溶解实验。在此之后,随着基因工程和抗体工程等分子生物学技术不同取得突破,科学家们开发出100多种双特异性抗体构建模式,比如基于片段的双特异性抗体、对称模式的双特异性抗体和不对称模式的双特异性抗体。
双特异性抗体能够同时靶向两个抗原或者一个抗原的两个不同表位,能在靶细胞和功能分子或细胞之间架起桥梁应,激发具有导向性的免疫反应,是基因工程抗体的一种,现已成为抗体工程领域的热点。当前的许多研究都已表明双特异性抗体在治疗血癌、实体瘤、糖尿病、HIV等病原体感染和阿尔茨海默病等疾病中显示出巨大的治疗前景。此外,它们也在促进干细胞和祖细胞的靶向递送以改善组织再生方面也有巨大的应用前景。
目前大多是双特异性抗体都是针对癌症进行研究的,而且许多双特异性抗体正在进入临床试验。基于此,小编针对2020年双特异性抗体取得的进展,进行一番梳理,以飨读者。
1.利用双特异性抗体治疗多发性骨髓瘤
2020年12月,强生(JNJ)旗下杨森制药在第62届美国血液学会年会上公布了teclistamab(JNJ-64007957,JNJ-7957)I期首个人体剂量递增研究(NCT03145181)的最新结果。该研究评估了teclistamab治疗既往已过度预治疗(heavily-pretreated,指先前接受过多种方案治疗)的复发或难治性多发性骨髓瘤(RRMM)患者。
结果显示:在推荐的皮下(SC)2期剂量(RP2D)下,teclistamab治疗的总缓解率(ORR)为73%(n=16/22)。SC制剂的结果支持了关键2期注册试验的推荐剂量,该试验已经启动。此外,静脉(IV)制剂的最新结果证实了缓解的持久性。

teclistamab是一种以B细胞成熟抗原(BCMA)和T细胞CD3受体为靶点的双特异性抗体。BCMA在多发性骨髓瘤细胞上表达水平显著升高、CD3参与激活T细胞。teclistamab将CD3 T细胞重新定向到表达BCMA的骨髓瘤细胞,以诱导针对靶细胞的细胞毒作用。临床前研究结果表明,teclistamab可杀死来自过度预治疗患者的骨髓瘤细胞。
2020年12月,强生旗下杨森制药在第62届美国血液学会年会上公布了talquetamab(JNJ-64407564)治疗复发或难治性多发性骨髓瘤(R/R MM)I期首个人体剂量递增研究的初步数据。结果显示,在皮下(SC)给药推荐的2期剂量(RP2D)下,talquetamab治疗的总缓解率(ORR)达到了69%。
talquetamab是一种首创的(first-in-class)、唯一一个同时靶向GPRC5D(多发性骨髓瘤新颖靶标)和CD3(抗癌T细胞表面受体)的双特异性抗体。GPRC5D(G蛋白偶联受体C5家族亚型D)在多发性骨髓瘤上高度表达,CD3参与激活T细胞。小鼠模型的临床前研究结果表明,talquetamab通过招募和激活CD3阳性T细胞,诱导T细胞介导的GPRC5D阳性多发性骨髓瘤细胞的杀伤,并抑制肿瘤的形成和生长。
2020年12月,罗氏首次公布恶性血液学管线中第三款双特异性抗体cevostamab(BFCR4350A)的临床安全性和有效性数据:在有效剂量下,cevostamab治疗的总缓解率(ORR)为53%(n=18/34);值得注意的是,在高危患者中观察到了治疗反应,包括那些病情对5种不同类别的药物难治(五重难治性)的患者(ORR=41%,n=7/17)以及那些曾接受过抗BCMA疗法治疗的患者(ORR=63%,n=5/8);cevostamab的安全性是可控的,最常见的的治疗相关不良事件是细胞因子释放综合征(CRS,76%)。这些结果表明,在既往接受过多种疗法治疗的复发或难治性多发性骨髓瘤(R/R MM)患者中,cevostamab表现出显著疗效,并具有可控的安全性。
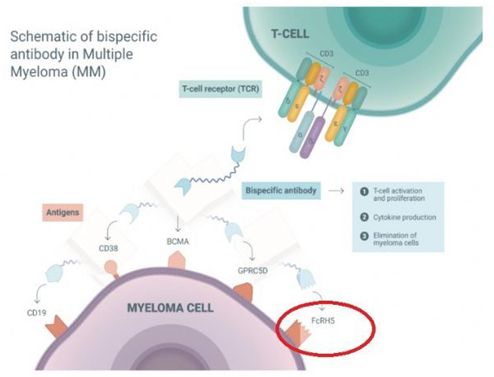
cevostamab是一种首创的(first-in-class)FcRH5xCD3 T细胞结合双特异性抗体,通过同时靶向骨髓瘤细胞上的FcRH5和T细胞表面的CD3发挥作用。FcRH5是一个独特的差异化靶点,在几乎100%的骨髓瘤细胞上表达。
2020年12月,罗氏在第62届美国血液学会年会上公布了2款在研T细胞结合CD20xCD3双特异性抗体mosunetuzumab和glofitamab的新数据。结果显示,这2款抗体药物在多种类型血液癌症中表现出令人鼓舞的活性,完全缓解率在50-80%。
mosunetuzumab和glofitamab(前称CD20-TCB)均为CD20xCD3双特异性抗体,通过同时结合2种不同细胞上的2个不同靶点(恶性B细胞表面的CD20,T细胞表面的CD3)来发挥作用。这种双重靶向作用可激活和重新定向患者现有的内源性T细胞,结合并通过向目标B细胞内释放毒性蛋白来消除这些恶性B细胞。这种双重靶向疗法,为包括非霍奇金淋巴瘤(NHL)和多发性骨髓瘤(MM)在内的血液癌症提供了一种创新的治疗方法。
2020年12月,辉瑞(Pfizer)近日在第62届美国血液学会(ASH)年会上公布了PF-06863135治疗复发或难治性多发性骨髓瘤(R/R MM)I期研究(NCT03269136)的安全性和临床应答结果。PF-06863135是一款在研的、靶向BCMA和CD3的双特异性抗体。来自30例R/R MM患者的数据显示,PF-06863135在所有皮下注射剂量水平的安全性都是可控的,没有观察到剂量限制性毒性。在最高剂量水平下,有83%的患者实现临床应答。
PF-06863135是一种BCMAxCD3双特异性抗体,旨在结合多发性骨髓瘤细胞表面高度表达的B细胞成熟抗原(BCMA)和抗癌T细胞表面的CD3受体,将它们连接在一起以激活免疫反应。PF-06863135对BCMA和CD3的结合亲和力得到了优化,使T细胞介导的抗骨髓瘤活性更强。皮下注射PF-06863135的目的是允许比静脉注射更高的剂量,而不会增加不良事件。
2.利用双特异性抗体治疗淋巴瘤
2020年7月,罗氏(Roche)近日宣布,美国食品药物管理局(FDA)已授予mosunetuzumab突破性药物资格(BTD),该药是一种T细胞结合CD20xCD3双特异性抗体,用于治疗先前至少接受过2种系统疗法治疗的复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。
FDA授予mosunetuzumab BTD,基于在I/Ib期GO29781研究(NCT02500407)中观察到的令人鼓舞的疗效结果。该研究是一项多中心、开放标签、剂量递增I/Ib期研究,评估了mosunetuzumab在复发或难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)患者中的安全性和药代动力学。该研究入组的患者包括接受CAR-T细胞疗法后病情复发或对CAR-T细胞疗法有抵抗力的患者,这类患者的治疗选择有限。研究的目的是评估最佳客观缓解率(ORR,采用修订的国际工作组标准评估)、最大耐受剂量和耐受性。
2020年6月,罗氏(Roche)近日在欧洲血液学协会(EHA)第25届年会上公布了在I期剂量递增NP30179研究(NCT03075696)中,CD20xCD3 T细胞结合双特异性抗体glofitamab(前称CD20-TCB)治疗复发或难治性(R/R)非霍奇金淋巴瘤(NHL)患者的最新数据:在先前接受过中位数为3种治疗方案的过度预治疗(heavily pre-treated)患者中,glofitamab固定疗程12个周期(21天/周期)治疗显示出持久的完全缓解(CR)。
3.利用双特异性抗体治疗白血病
2020年10月,Robin Foà等在II期单组临床试验中,考察了第二代酪氨酸激酶抑制剂达沙替尼(dasatinib)、糖皮质激素联合blinatumomab对费城染色体阳性的急性淋巴细胞白血病(Ph+ ALL)成人患者分子应答的影响。达沙替尼和blinatumomab在治疗Ph+ ALL成人患者时显示出卓越的疗效和安全性。作为一线治疗,在中位随访期达到18个月时,患者的总生存率和无疾病生存率高达95%和88%。
blinatumomab是由安进(Amgen)公司开发的双特异性抗体,它的一端与B细胞表面的CD19抗体结合,另一端与T细胞表面的CD3受体结合,通过将T细胞募集到白血病细胞附近并激活T细胞,达到杀伤白血病细胞的作用。
4.利用双特异性抗体治疗实体瘤
2020年10月,中国国家药监局药品审评中心最新公示,信达生物申报的1类生物新药IBI323首次获得临床试验默示许可,拟开发用于治疗晚期实体瘤和血液肿瘤。IBI323是一款新型的可以同时靶向LAG-3和PD-L1的LAG-3/PD-L1双特异性抗体。临床前数据显示IBI-322比单特异性抗CD47抗体具有更良好的体内功效、肿瘤富集分布以及更高的安全性。
2020年12月,强生旗下杨森制药宣布,已向美国食品和药物管理局(FDA)提交了一份生物制品许可申请(BLA),寻求批准amivantamab(JNJ-61186372,JNJ-6372),用于治疗在接受含铂化疗期间或之后病情进展、表皮生长因子受体(EGFR)基因第20号外显子有插入突变的转移性非小细胞肺癌(NSCLC)患者。
此次BLA,基于I期CHRYSALIS研究(NCT02609776)的结果。数据显示,在携带EGFR外显子20插入突变的晚期NSCLC患者中,amivantamab治疗显示出持久的缓解:(1)在所有可评估患者中,总缓解率(ORR)为36%、中位缓解持续时间(DOR)为10个月、临床受益率(≥部分缓解[PR]+疾病稳定≥12周)为67%;(2)在先前接受含铂化疗的可评估患者中,ORR为41%、中位DOR为7个月、临床受益率为72%。
amivantamab是一种在研的全人EGFR-间质表皮转化因子(MET)双特异性抗体,具有免疫细胞导向活性,靶向携带激活和耐药EGFR及MET突变及扩增的肿瘤。
2020年6月,Janelle C. Waite等人研究了两种双特异性抗体,它们都靶向一种称为CD28的T细胞蛋白。与此同时,他们还分析了两种肿瘤特异性抗原。这两种双特异性抗体同时结合T细胞和癌症抗原,从而增强了T细胞杀死癌细胞的潜力。此外,他们发现这两种双特异性抗体增强了抗PD-1免疫检查点阻断在小鼠模型中的治疗效果。他们还表示,这种组合治疗使得之前有抵抗力的肿瘤也变得敏感。这些双特异性抗体几乎没有毒性迹象,也没有引发T细胞的危险性全身反应。
2020年1月,Dimitris Skokos等人描述了两种称为TSAxCD28的新型双特异性抗体:一种TSAxCD28双特异性抗体对卵巢癌抗原具有特异性,另一种TSAxCD28双特异性抗体对前列腺癌抗原具有特异性。这些TSAxCD28双特异性抗体在基因人源化的免疫功能小鼠模型或灵长类动物中单独使用时,显示出有限的活性且无毒副作用。
但是,当与TSAxCD3双特异性抗体组合使用时,这些TSAxCD28双特异性抗体可以增强T细胞与其靶细胞之间的人工突触,增强T细胞活化,并在多种异基因肿瘤模型和同基因肿瘤模型中显著提高TSAxCD3双特异性抗体的抗肿瘤活性,而且没有显示出毒副作用。
5.小结
相比于仅靶向一种肿瘤抗原表位的单克隆抗体药物,双特异性抗体同时靶向两个抗原或者一个抗原的两个不同表位,可提高结合特异性,增强对靶细胞的杀伤作用,降低肿瘤耐药性产生,与此同时降低脱靶毒性等副作用发生。这种具有双功能的重组抗体作为治疗肿瘤的药物拥有比单抗药物更高的疗效。
然而,我们也要看到尽管有如此多的制药企业投入大量资金开发抗肿瘤双特异性抗体药物,但是最终获得批准上市的少之又少。虽然在1984年,人们就已开始利用双特异性抗体把细胞毒性T 淋巴细胞用于癌细胞溶解实验,但是直到在2009年欧洲药品管理局(EMA)才批准靶向CD3和EpCAM的双特异性抗体catumaxomab在在欧洲上市治疗恶性腹水,但是由于上市后表现欠佳,catumaxomab于2017年退市停产。2014年12 月,FDA批准双特异性抗体药物blinatumomab用于治疗复发性或难治性的费城染色体阴性( Ph-) 前B 细胞急性淋巴细胞白血病。这说明现有的双特异性抗体开发成功率仍然较低,有待进一步提高。随着科学研究技术的发展,科学家们可以通过改变双特异性抗体的结构、相对分子质量和化合价来改善其血浆清除率、组织渗透率和药物代谢动力学等,进而提高其成药稳定性和临床疗效。
尽管与单克隆抗体相比,双特异性抗体的复杂性增加,在发现和开发的不同阶段会带来额外的挑战,但双特异性抗体为新型药物的设计与开发提供了令人兴奋的机会。从疾病领域来看,目前的数据显示,业界对双特异性抗体治疗癌症更加期待。科学家们预计,双特异性抗体的持续发展将对癌症等疾病的治疗带来持久的影响。(生物谷 Bioon.com)
参考资料:
1.Aran F. Labrijn et al. Bispecific antibodies: a mechanistic review of the pipeline. Nature Reviews Drug Discovery, 2019, doi:10.1038/s41573-019-0028-1.
2.BCMAxCD3双特异性抗体!强生teclistamab皮下注射治疗复发/难治多发骨髓瘤:总缓解率73%!
https://news.bioon.com/article/6781821.html
3.首创FcRH5xCD3双特异性抗体!罗氏cevostamab治疗高危难治多发性骨髓瘤:总缓解率53%!
https://www.bioon.com/article/6781926.html
4.GPRC5DxCD3双特异性抗体!强生talquetamab治疗复发或难治性多发性骨髓瘤:总缓解率69%!
https://news.bioon.com/article/6781780.html
5.CD20xCD3双特异性抗体!罗氏mosunetuzumab/glofitamab治疗多种淋巴瘤:完全缓解率50-80%!
https://news.bioon.com/article/6781763.html
6.BCMA-CD3双特异性抗体!辉瑞PF-0686315每周一次皮下注射治疗多发性骨髓瘤:总缓解率83%!
https://news.bioon.com/article/6781762.html
7.CD20xCD3双特异性抗体!罗氏mosunetuzumab获美国FDA突破性药物资格,治疗滤泡性淋巴瘤(FL)
https://news.bioon.com/article/6758689.html
8.CD20xCD3双特异性抗体!罗氏glofitamab治疗复发/难治性非霍奇金淋巴瘤(NHL)展现强劲疗效!
https://www.bioon.com/article/6757226.html
9.Robin Foà et al. Dasatinib-Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. NEJM, 2020, doi:10.1056/NEJMoa2016272.
10.EGFR-MET双特异性抗体!强生amivantamab申请上市:治疗EGFR外显子20插入突变肺癌(NSCLC)!
https://www.bioon.com/article/6781585.html
11.Janelle C. Waite et al. Tumor-targeted CD28 bispecific antibodies enhance the antitumor efficacy of PD-1 immunotherapy. Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aba2325.
12.袁庆云等. 双特异性抗体药物在抗肿瘤治疗中的应用. 药物生物技术[J]. 2017(6):541-544.
13.Dimitris Skokos et al. A class of costimulatory CD28-bispecific antibodies that enhance the antitumor activity of CD3-bispecific antibodies. Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aaw7888.
双特异性抗体能够同时靶向两个抗原或者一个抗原的两个不同表位,能在靶细胞和功能分子或细胞之间架起桥梁应,激发具有导向性的免疫反应,是基因工程抗体的一种,现已成为抗体工程领域的热点。当前的许多研究都已表明双特异性抗体在治疗血癌、实体瘤、糖尿病、HIV等病原体感染和阿尔茨海默病等疾病中显示出巨大的治疗前景。此外,它们也在促进干细胞和祖细胞的靶向递送以改善组织再生方面也有巨大的应用前景。
目前大多是双特异性抗体都是针对癌症进行研究的,而且许多双特异性抗体正在进入临床试验。基于此,小编针对2020年双特异性抗体取得的进展,进行一番梳理,以飨读者。
1.利用双特异性抗体治疗多发性骨髓瘤
2020年12月,强生(JNJ)旗下杨森制药在第62届美国血液学会年会上公布了teclistamab(JNJ-64007957,JNJ-7957)I期首个人体剂量递增研究(NCT03145181)的最新结果。该研究评估了teclistamab治疗既往已过度预治疗(heavily-pretreated,指先前接受过多种方案治疗)的复发或难治性多发性骨髓瘤(RRMM)患者。
结果显示:在推荐的皮下(SC)2期剂量(RP2D)下,teclistamab治疗的总缓解率(ORR)为73%(n=16/22)。SC制剂的结果支持了关键2期注册试验的推荐剂量,该试验已经启动。此外,静脉(IV)制剂的最新结果证实了缓解的持久性。

多种靶向BCMA的多发性骨髓瘤免疫疗法,图片来源文献—PMID:31277554。
teclistamab是一种以B细胞成熟抗原(BCMA)和T细胞CD3受体为靶点的双特异性抗体。BCMA在多发性骨髓瘤细胞上表达水平显著升高、CD3参与激活T细胞。teclistamab将CD3 T细胞重新定向到表达BCMA的骨髓瘤细胞,以诱导针对靶细胞的细胞毒作用。临床前研究结果表明,teclistamab可杀死来自过度预治疗患者的骨髓瘤细胞。
2020年12月,强生旗下杨森制药在第62届美国血液学会年会上公布了talquetamab(JNJ-64407564)治疗复发或难治性多发性骨髓瘤(R/R MM)I期首个人体剂量递增研究的初步数据。结果显示,在皮下(SC)给药推荐的2期剂量(RP2D)下,talquetamab治疗的总缓解率(ORR)达到了69%。
talquetamab是一种首创的(first-in-class)、唯一一个同时靶向GPRC5D(多发性骨髓瘤新颖靶标)和CD3(抗癌T细胞表面受体)的双特异性抗体。GPRC5D(G蛋白偶联受体C5家族亚型D)在多发性骨髓瘤上高度表达,CD3参与激活T细胞。小鼠模型的临床前研究结果表明,talquetamab通过招募和激活CD3阳性T细胞,诱导T细胞介导的GPRC5D阳性多发性骨髓瘤细胞的杀伤,并抑制肿瘤的形成和生长。
2020年12月,罗氏首次公布恶性血液学管线中第三款双特异性抗体cevostamab(BFCR4350A)的临床安全性和有效性数据:在有效剂量下,cevostamab治疗的总缓解率(ORR)为53%(n=18/34);值得注意的是,在高危患者中观察到了治疗反应,包括那些病情对5种不同类别的药物难治(五重难治性)的患者(ORR=41%,n=7/17)以及那些曾接受过抗BCMA疗法治疗的患者(ORR=63%,n=5/8);cevostamab的安全性是可控的,最常见的的治疗相关不良事件是细胞因子释放综合征(CRS,76%)。这些结果表明,在既往接受过多种疗法治疗的复发或难治性多发性骨髓瘤(R/R MM)患者中,cevostamab表现出显著疗效,并具有可控的安全性。

FcRH5xCD3,图片来源于文献:PMID 32659909。
cevostamab是一种首创的(first-in-class)FcRH5xCD3 T细胞结合双特异性抗体,通过同时靶向骨髓瘤细胞上的FcRH5和T细胞表面的CD3发挥作用。FcRH5是一个独特的差异化靶点,在几乎100%的骨髓瘤细胞上表达。
2020年12月,罗氏在第62届美国血液学会年会上公布了2款在研T细胞结合CD20xCD3双特异性抗体mosunetuzumab和glofitamab的新数据。结果显示,这2款抗体药物在多种类型血液癌症中表现出令人鼓舞的活性,完全缓解率在50-80%。
mosunetuzumab和glofitamab(前称CD20-TCB)均为CD20xCD3双特异性抗体,通过同时结合2种不同细胞上的2个不同靶点(恶性B细胞表面的CD20,T细胞表面的CD3)来发挥作用。这种双重靶向作用可激活和重新定向患者现有的内源性T细胞,结合并通过向目标B细胞内释放毒性蛋白来消除这些恶性B细胞。这种双重靶向疗法,为包括非霍奇金淋巴瘤(NHL)和多发性骨髓瘤(MM)在内的血液癌症提供了一种创新的治疗方法。
2020年12月,辉瑞(Pfizer)近日在第62届美国血液学会(ASH)年会上公布了PF-06863135治疗复发或难治性多发性骨髓瘤(R/R MM)I期研究(NCT03269136)的安全性和临床应答结果。PF-06863135是一款在研的、靶向BCMA和CD3的双特异性抗体。来自30例R/R MM患者的数据显示,PF-06863135在所有皮下注射剂量水平的安全性都是可控的,没有观察到剂量限制性毒性。在最高剂量水平下,有83%的患者实现临床应答。
PF-06863135是一种BCMAxCD3双特异性抗体,旨在结合多发性骨髓瘤细胞表面高度表达的B细胞成熟抗原(BCMA)和抗癌T细胞表面的CD3受体,将它们连接在一起以激活免疫反应。PF-06863135对BCMA和CD3的结合亲和力得到了优化,使T细胞介导的抗骨髓瘤活性更强。皮下注射PF-06863135的目的是允许比静脉注射更高的剂量,而不会增加不良事件。
2.利用双特异性抗体治疗淋巴瘤
2020年7月,罗氏(Roche)近日宣布,美国食品药物管理局(FDA)已授予mosunetuzumab突破性药物资格(BTD),该药是一种T细胞结合CD20xCD3双特异性抗体,用于治疗先前至少接受过2种系统疗法治疗的复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。

图片来自npj Systems Biology and Applications, 2020, doi:10.1038/s41540-020-00145-7。
FDA授予mosunetuzumab BTD,基于在I/Ib期GO29781研究(NCT02500407)中观察到的令人鼓舞的疗效结果。该研究是一项多中心、开放标签、剂量递增I/Ib期研究,评估了mosunetuzumab在复发或难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)患者中的安全性和药代动力学。该研究入组的患者包括接受CAR-T细胞疗法后病情复发或对CAR-T细胞疗法有抵抗力的患者,这类患者的治疗选择有限。研究的目的是评估最佳客观缓解率(ORR,采用修订的国际工作组标准评估)、最大耐受剂量和耐受性。
2020年6月,罗氏(Roche)近日在欧洲血液学协会(EHA)第25届年会上公布了在I期剂量递增NP30179研究(NCT03075696)中,CD20xCD3 T细胞结合双特异性抗体glofitamab(前称CD20-TCB)治疗复发或难治性(R/R)非霍奇金淋巴瘤(NHL)患者的最新数据:在先前接受过中位数为3种治疗方案的过度预治疗(heavily pre-treated)患者中,glofitamab固定疗程12个周期(21天/周期)治疗显示出持久的完全缓解(CR)。
3.利用双特异性抗体治疗白血病
2020年10月,Robin Foà等在II期单组临床试验中,考察了第二代酪氨酸激酶抑制剂达沙替尼(dasatinib)、糖皮质激素联合blinatumomab对费城染色体阳性的急性淋巴细胞白血病(Ph+ ALL)成人患者分子应答的影响。达沙替尼和blinatumomab在治疗Ph+ ALL成人患者时显示出卓越的疗效和安全性。作为一线治疗,在中位随访期达到18个月时,患者的总生存率和无疾病生存率高达95%和88%。

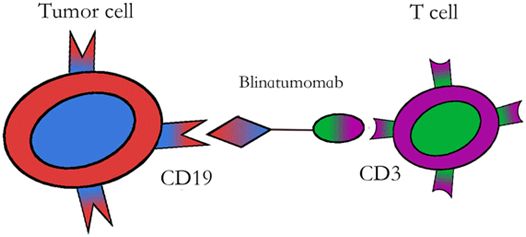
双特异性抗体blinatumomab的作用机制,图片来自Journal of Hematology & Oncology, 2015, doi:10.1186/s13045-015-0195-4。
blinatumomab是由安进(Amgen)公司开发的双特异性抗体,它的一端与B细胞表面的CD19抗体结合,另一端与T细胞表面的CD3受体结合,通过将T细胞募集到白血病细胞附近并激活T细胞,达到杀伤白血病细胞的作用。
4.利用双特异性抗体治疗实体瘤
2020年10月,中国国家药监局药品审评中心最新公示,信达生物申报的1类生物新药IBI323首次获得临床试验默示许可,拟开发用于治疗晚期实体瘤和血液肿瘤。IBI323是一款新型的可以同时靶向LAG-3和PD-L1的LAG-3/PD-L1双特异性抗体。临床前数据显示IBI-322比单特异性抗CD47抗体具有更良好的体内功效、肿瘤富集分布以及更高的安全性。
2020年12月,强生旗下杨森制药宣布,已向美国食品和药物管理局(FDA)提交了一份生物制品许可申请(BLA),寻求批准amivantamab(JNJ-61186372,JNJ-6372),用于治疗在接受含铂化疗期间或之后病情进展、表皮生长因子受体(EGFR)基因第20号外显子有插入突变的转移性非小细胞肺癌(NSCLC)患者。

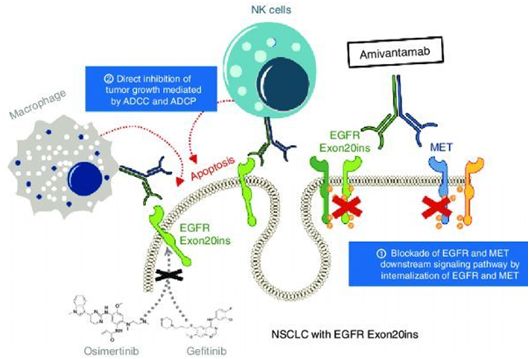
amivantamab作用机制,图片来自doi:10.1158/2159-8290.CD-20-0116。
此次BLA,基于I期CHRYSALIS研究(NCT02609776)的结果。数据显示,在携带EGFR外显子20插入突变的晚期NSCLC患者中,amivantamab治疗显示出持久的缓解:(1)在所有可评估患者中,总缓解率(ORR)为36%、中位缓解持续时间(DOR)为10个月、临床受益率(≥部分缓解[PR]+疾病稳定≥12周)为67%;(2)在先前接受含铂化疗的可评估患者中,ORR为41%、中位DOR为7个月、临床受益率为72%。
amivantamab是一种在研的全人EGFR-间质表皮转化因子(MET)双特异性抗体,具有免疫细胞导向活性,靶向携带激活和耐药EGFR及MET突变及扩增的肿瘤。
2020年6月,Janelle C. Waite等人研究了两种双特异性抗体,它们都靶向一种称为CD28的T细胞蛋白。与此同时,他们还分析了两种肿瘤特异性抗原。这两种双特异性抗体同时结合T细胞和癌症抗原,从而增强了T细胞杀死癌细胞的潜力。此外,他们发现这两种双特异性抗体增强了抗PD-1免疫检查点阻断在小鼠模型中的治疗效果。他们还表示,这种组合治疗使得之前有抵抗力的肿瘤也变得敏感。这些双特异性抗体几乎没有毒性迹象,也没有引发T细胞的危险性全身反应。
2020年1月,Dimitris Skokos等人描述了两种称为TSAxCD28的新型双特异性抗体:一种TSAxCD28双特异性抗体对卵巢癌抗原具有特异性,另一种TSAxCD28双特异性抗体对前列腺癌抗原具有特异性。这些TSAxCD28双特异性抗体在基因人源化的免疫功能小鼠模型或灵长类动物中单独使用时,显示出有限的活性且无毒副作用。

图片来自Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aaw7888。
但是,当与TSAxCD3双特异性抗体组合使用时,这些TSAxCD28双特异性抗体可以增强T细胞与其靶细胞之间的人工突触,增强T细胞活化,并在多种异基因肿瘤模型和同基因肿瘤模型中显著提高TSAxCD3双特异性抗体的抗肿瘤活性,而且没有显示出毒副作用。
5.小结
相比于仅靶向一种肿瘤抗原表位的单克隆抗体药物,双特异性抗体同时靶向两个抗原或者一个抗原的两个不同表位,可提高结合特异性,增强对靶细胞的杀伤作用,降低肿瘤耐药性产生,与此同时降低脱靶毒性等副作用发生。这种具有双功能的重组抗体作为治疗肿瘤的药物拥有比单抗药物更高的疗效。
然而,我们也要看到尽管有如此多的制药企业投入大量资金开发抗肿瘤双特异性抗体药物,但是最终获得批准上市的少之又少。虽然在1984年,人们就已开始利用双特异性抗体把细胞毒性T 淋巴细胞用于癌细胞溶解实验,但是直到在2009年欧洲药品管理局(EMA)才批准靶向CD3和EpCAM的双特异性抗体catumaxomab在在欧洲上市治疗恶性腹水,但是由于上市后表现欠佳,catumaxomab于2017年退市停产。2014年12 月,FDA批准双特异性抗体药物blinatumomab用于治疗复发性或难治性的费城染色体阴性( Ph-) 前B 细胞急性淋巴细胞白血病。这说明现有的双特异性抗体开发成功率仍然较低,有待进一步提高。随着科学研究技术的发展,科学家们可以通过改变双特异性抗体的结构、相对分子质量和化合价来改善其血浆清除率、组织渗透率和药物代谢动力学等,进而提高其成药稳定性和临床疗效。
尽管与单克隆抗体相比,双特异性抗体的复杂性增加,在发现和开发的不同阶段会带来额外的挑战,但双特异性抗体为新型药物的设计与开发提供了令人兴奋的机会。从疾病领域来看,目前的数据显示,业界对双特异性抗体治疗癌症更加期待。科学家们预计,双特异性抗体的持续发展将对癌症等疾病的治疗带来持久的影响。(生物谷 Bioon.com)
参考资料:
1.Aran F. Labrijn et al. Bispecific antibodies: a mechanistic review of the pipeline. Nature Reviews Drug Discovery, 2019, doi:10.1038/s41573-019-0028-1.
2.BCMAxCD3双特异性抗体!强生teclistamab皮下注射治疗复发/难治多发骨髓瘤:总缓解率73%!
https://news.bioon.com/article/6781821.html
3.首创FcRH5xCD3双特异性抗体!罗氏cevostamab治疗高危难治多发性骨髓瘤:总缓解率53%!
https://www.bioon.com/article/6781926.html
4.GPRC5DxCD3双特异性抗体!强生talquetamab治疗复发或难治性多发性骨髓瘤:总缓解率69%!
https://news.bioon.com/article/6781780.html
5.CD20xCD3双特异性抗体!罗氏mosunetuzumab/glofitamab治疗多种淋巴瘤:完全缓解率50-80%!
https://news.bioon.com/article/6781763.html
6.BCMA-CD3双特异性抗体!辉瑞PF-0686315每周一次皮下注射治疗多发性骨髓瘤:总缓解率83%!
https://news.bioon.com/article/6781762.html
7.CD20xCD3双特异性抗体!罗氏mosunetuzumab获美国FDA突破性药物资格,治疗滤泡性淋巴瘤(FL)
https://news.bioon.com/article/6758689.html
8.CD20xCD3双特异性抗体!罗氏glofitamab治疗复发/难治性非霍奇金淋巴瘤(NHL)展现强劲疗效!
https://www.bioon.com/article/6757226.html
9.Robin Foà et al. Dasatinib-Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. NEJM, 2020, doi:10.1056/NEJMoa2016272.
10.EGFR-MET双特异性抗体!强生amivantamab申请上市:治疗EGFR外显子20插入突变肺癌(NSCLC)!
https://www.bioon.com/article/6781585.html
11.Janelle C. Waite et al. Tumor-targeted CD28 bispecific antibodies enhance the antitumor efficacy of PD-1 immunotherapy. Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aba2325.
12.袁庆云等. 双特异性抗体药物在抗肿瘤治疗中的应用. 药物生物技术[J]. 2017(6):541-544.
13.Dimitris Skokos et al. A class of costimulatory CD28-bispecific antibodies that enhance the antitumor activity of CD3-bispecific antibodies. Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aaw7888.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


