科学家在铁死亡研究领域取得的新进展!
来源:生物谷原创 2024-07-30 09:34
铁死亡是一种受调控的氧化性细胞死亡形式,近年来其引起了科学家们极大的研究兴趣,其在标准的疗法耐受性和转移性癌症的治疗中表现出了一定的药理学可操控性。
铁死亡(Ferroptosis )是一种铁依赖性的,区别于细胞凋亡、细胞自噬的新型细胞程序性死亡方式。近些年来,科学家们在铁死亡研究领域进行了大量研究,本文中,小编整理了多篇文章,共同解读他们在该领域研究取得的新进展,分享给大家!
【1】Nat Cell Biol:利用铁死亡攻击迁移性的癌细胞,有望对抗侵袭性癌症
doi:10.1038/s41556-024-01464-1
近日,一篇发表在国际杂志Nature Cell Biology上题为“Zeb1 mediates EMT/plasticity-associated ferroptosis sensitivity in cancer cells by regulating lipogenic enzyme expression and phospholipid composition”的研究报告中,来自埃尔朗根-纽伦堡大学等机构的研究人员如今离治疗侵袭性癌症这一宏伟目标又近了一大步。他们攻击迁移性癌细胞的方法是利用铁死亡(ferroptosis)——一种在2012年才被发现的细胞死亡机制。他们使用实验室物质进行的实验很有希望,但在此基础上使用药物之前,还需要进一步的临床前研究和临床研究。化疗和免疫疗法的近期进展意味着癌症的治疗效果比以往任何时候都要好,而且近年来癌症患者的存活率也大幅提高。然而,对于诸如胰腺癌和某些类型的乳腺癌之类的侵袭性癌症,医生们仍然无能为力。
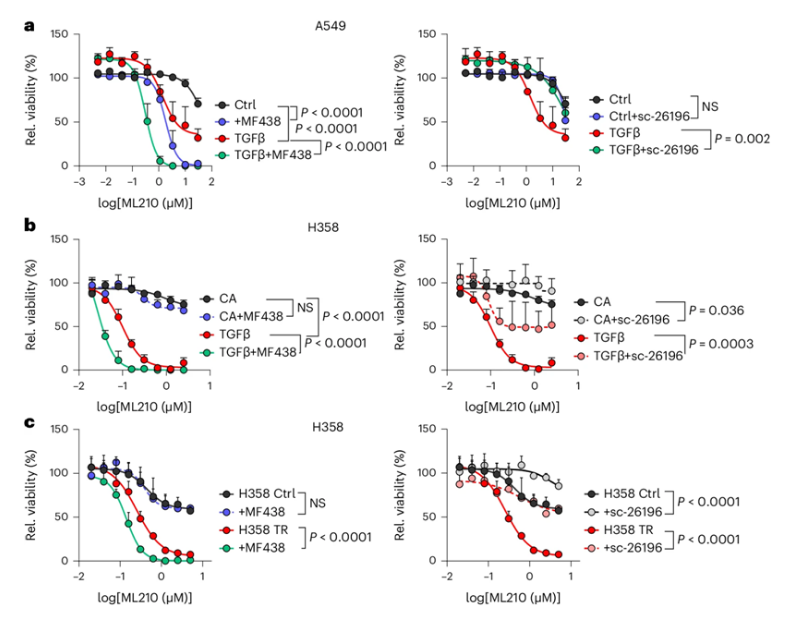
图片来源:Nature Cell Biology, 2024, doi:10.1038/s41556-024-01464-1
研究者Thomas Brabletz 教授解释说,“这些肿瘤在很早的阶段就发生了转移,但却往往没有被发现。这使得它们特别具有挑战性和致命性。”大约20年前,Brabletz发现肿瘤转移(metastasis)是由迁移的癌症干细胞引起的。要启动这一过程,单个上皮癌细胞(即紧凑型肿瘤的组成细胞)必须转变为具有间质特性的癌细胞。这样,具有间质特性的癌细胞可以迁移到全身各处,并通过变回上皮癌细胞而在不同部位形成转移瘤。Brabletz说,“我们将这种从一种细胞转变为另一种细胞的基本能力称为细胞可塑性(cell plasticity)。”
在这项新的研究中,这些作者发现了这些迁移性转移细胞的一个致命弱点:这些具有间质特性的癌细胞在变形过程中会改变代谢,并在细胞膜中储存高浓度的多不饱和脂肪酸。这使得细胞膜具有弹性,但也容易受到一种在2012年才被发现的至今仍未被完全理解的机制——铁死亡的影响。
doi:10.1016/j.cell.2024.01.030
近日,一篇发表在国际杂志Cell上题为“Phospholipids with two polyunsaturated fatty acyl tails promote ferroptosis”的研究报告中,来自美国哥伦比亚大学的研究人员发现,一类罕见的脂质是铁死亡(ferroptosis)的关键驱动因素,其中铁死亡是哥伦比亚大学教授Brent Stockwell发现的一种细胞死亡形式。
这些发现提供了细胞在铁死亡过程中如何死亡的新细节,并能加深人们对如何在铁死亡有害的情况(比如神经退行性疾病)下阻止它或者在铁死亡有用的情况(比如利用铁死亡杀死危险的癌细胞)下诱导它的理解。这项新的研究发现,一类罕见的具有两个多不饱和脂肪酰基尾部(polyunsaturated fatty acyl tail)的脂质——称为 diPUFA 磷脂(diPUFA phospholipid),存在于一系列发生铁死亡的环境中,包括衰老的大脑和受亨廷顿病影响的大脑组织。这一发现表明,这种脂质能有效促进铁死亡。
Stockwell是在2012年首次发现铁死亡的,当时他发现某些细胞会因为它们的脂质层塌陷而死亡——这是一种不寻常的细胞死亡形式,不同于最常见的细胞死亡形式。
【3】Nature:重大突破!新研究证实7-脱氢胆固醇可保护细胞免受铁死亡
doi:10.1038/s41586-023-06878-9
近日,一篇发表在国际杂志Nature上题为“7-Dehydrocholesterol is an endogenous suppressor of ferroptosis”的研究报告中,来自德国维尔茨堡大学等机构的科学家们通过研究证实一种胆固醇前体分子——7-脱氢胆固醇(7-dehydrocholesterol, 7-DHC),作为一种抗氧化剂发挥着至关重要的作用:它能整合到细胞膜中,并通过防止某种细胞死亡——称为铁死亡(ferroptosis),来保护细胞。
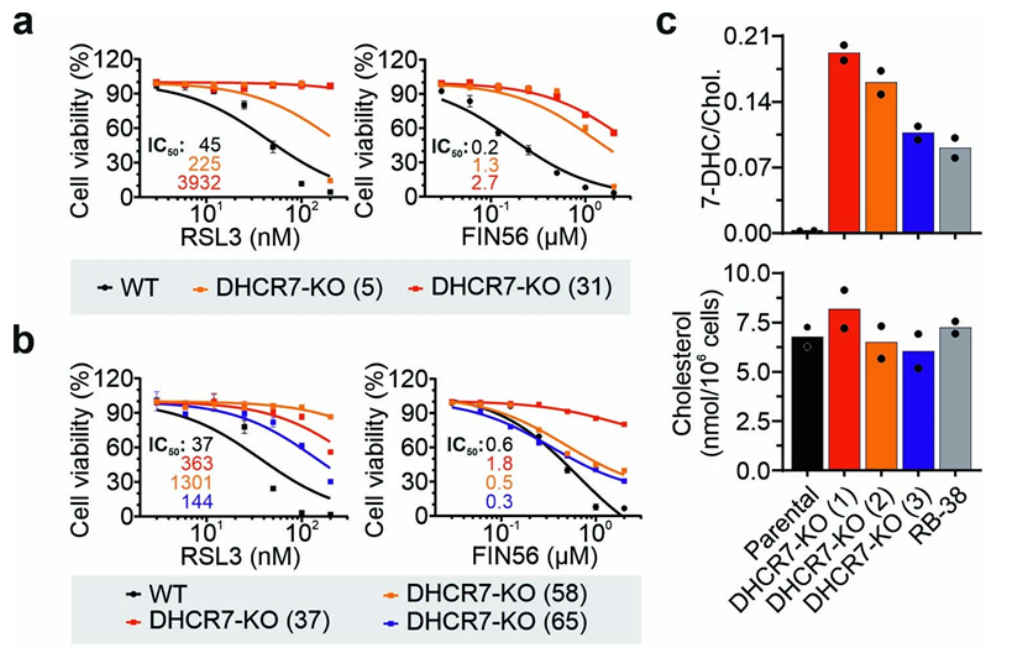
图片来源:Nature, 2024, doi:10.1038/s41586-023-06878-9
Friedmann Angeli说,“在此之前,7-DHC 的积累只与神经发育缺陷有关,如今我们发现它实际上增加了细胞的适应能力,并能促进伯基特淋巴瘤和神经母细胞瘤等癌症的侵袭行为。”这种新发现的 7-DHC 保护功能为进一步改善对癌症和其他与铁死亡相关疾病的治疗开辟了令人兴奋的前景。“它为我们提供了新的机会,使我们能够测试靶向胆固醇生物合成的潜在抑制剂,这些抑制剂已经在医疗实践中建立起来。”
在这一领域,7-DHC 作为一种抗氧化剂的发现开辟了新的可能性:对 7-DHC 含量变化的研究可能为了解这些疾病提供重要的新线索。此外,还应该研究特异性阻断 7-DHC 生成的药物与其他药物的结合,这可能会对某些癌症的治疗产生积极影响。
【4】Nature:科学家揭示促进癌细胞对铁死亡易感背后的特定分子机制
doi:10.1038/s41586-023-06269-0
近日,一篇发表在国际杂志Nature上题为“DHODH inhibitors sensitize to ferroptosis by FSP1 inhibition”的研究报告中,来自德国慕尼黑赫姆霍兹中心等机构的科学家们通过研究揭示了一种特殊机制,其或能通过药理性靶向作用一种铁死亡监测系统(ferroptosis surveillance system)来促进癌细胞发生死亡。
铁死亡是一种受调控的氧化性细胞死亡形式,近年来其引起了科学家们极大的研究兴趣,因为其在标准的疗法耐受性和转移性癌症的治疗中表现出了一定的药理学可操控性,因此,通过药理学靶向作用内源性的防御系统来调节细胞对铁死亡的敏感性如今渐渐成为了一种非常有前途的抗癌疗法策略。科学家们发现,二氢鸟嘌呤脱氢酶(DHODH,dihydroorotate dehydrogenase)抑制剂引起的铁死亡敏感效应是通过抑制铁死亡抑制蛋白-1(FSP1, ferroptosis suppressor protein-1)来发生的,FSP1是研究人员早先识别出的另一种铁死亡参与者,而并不是通过DHODH本身来发生的,这些研究发现证实了FSP1在癌细胞铁死亡监督过程中的重要角色,其或能推动FSP1抑制剂作为有效癌症疗法的未来发展和进步。
促使细胞敏感并经历以铁死亡形式的受调控细胞死亡或许是一种新型的抗癌疗法形式,尤其是考虑到标准疗法的耐受和转移性癌症;因此,目前研究人员正在深入研究能调节癌症铁死亡敏感性的新型细胞机制和化合物,2021年,DHODH就被描述为新型的铁死亡抑制剂。DHODH是一种定位于线粒体的特殊酶类,其因能通过氧化二氢乳清酸(dihydroorotate)同时减少线粒体中辅酶Q10(CoQ10)从而产生用于DNA合成的基本元件而闻名,基于最近的数据,DHODH的强效和选择性抑制剂(比如brequinar)能有效促使癌细胞对铁死亡敏感,因此其或能扮演铁死亡的抑制子。
【5】Nature:新突破!揭示FSP1的相分离促进铁死亡机制
doi:10.1038/s41586-023-06255-6
近日,一篇发表在国际杂志Nature上题为“Phase separation of FSP1 promotes ferroptosis”的研究报告中,来自德国亥姆霍兹慕尼黑中心等机构的研究人员通过研究发现了一种名为icFSP1的新型抗癌药物,它能使癌细胞对铁死亡(ferroptosis)敏感。铁死亡的特点是细胞膜的铁依赖性氧化破坏,这种破坏可被铁死亡抑制蛋白-1(ferroptosis suppressor protein-1, FSP1)抵消。尽管FSP1被认为是癌症治疗的一种有吸引力的药物靶标,但一直缺乏体内有效的FSP1抑制剂。为此,在这项新的研究中,这些作者仔细评估了从大约10000种小分子化合物中筛选出的命中率,并确定icFSP1为一种新的体内有效药物。
重要的是,他们发现了icFSP1的作用机制,该机制基于触发FSP1的相分离,其中相分离是细胞中类似于油和水分离的物理现象。事实上,icFSP1在体内强烈地抑制了肿瘤生长,肿瘤组织中有明显的FSP1凝聚物,从而提出了一种通过促进FSP1的相分离和铁死亡来对抗肿瘤的新概念。
对化疗的抵抗性或癌症转移是癌症的一个重要临床问题。值得注意的是,在去分化或代谢重建的过程中,某些恶性肿瘤细胞获得了对铁死亡的内在脆弱性。因此,靶向铁死亡作为一种癌症治疗方法已经显示出巨大的前景。2019年,与Conrad合作的一个研究小组已确定了第一种FSP1特异性抑制剂,被称为iFSP1。
【6】Redox Biology: 大麻素有助于神经保护,防止氧化性死亡/铁死亡
doi:10.1016/j.redox.2024.103138
神经系统疾病,包括阿尔茨海默病(AD)、帕金森病(PD)和亨廷顿病(HD),以及创伤性脑损伤(TBI),影响着全世界数百万人。这些疾病是极具破坏性的疾病,会导致进行性脑损伤和认知能力下降,往往会带来致命的后果。近日,来自美国索尔克生物研究所的研究者们在Redox Biology杂志上发表了题为“Fragment-based drug discovery and biological evaluation of novel cannabinol-based inhibitors of oxytosis/ferroptosis for neurological disorders”的文章,该研究基于片段的药物发现和基于大麻酚的神经系统疾病氧化性死亡/铁死亡抑制剂的生物学评价。
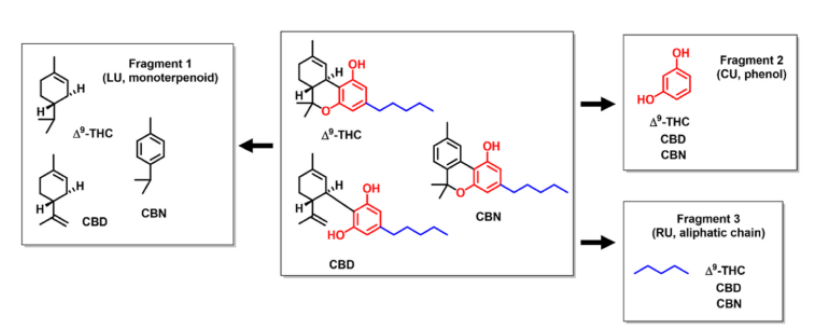
使用基于片段的药物发现(FBDD)方法对大麻素进行结构分析
图片来源:doi:10.1016/j.redox.2024.103138
氧化性死亡/铁死亡调节的细胞死亡途径是一个新兴的研究领域,因为它与广泛的神经系统疾病,包括阿尔茨海默病和帕金森病以及创伤性脑损伤的病理生理相关。开发新的神经疗法来抑制氧化性死亡/铁死亡,为这些和其他神经系统疾病的治疗提供了令人兴奋的机会。
之前,研究者发现大麻酚(CBN)是一种独特的,有效的抑制剂,通过靶向线粒体并调节其在神经元细胞中的功能来抑制氧化性死亡/铁死亡。为了进一步阐明哪些关键的药效团和化学空间对CBN的有益作用至关重要,研究者在这里引入了一种基于片段的药物发现策略,并结合基于细胞的表型筛选,使用氧化性死亡/铁死亡来确定CBN的结构-活性关系。
【7】Nature子刊:IRE 1α通过调节谷胱甘肽合成决定铁死亡敏感性
doi:10.1038/s41467-024-48330-0
细胞对铁死亡的防御主要通过四种机制发生,具有不同的亚细胞位置:Gpx4利用还原型谷胱甘肽(GSH)来解毒胞浆和线粒体中的脂质过氧化氢。FSP1和DHODH分别在质膜和线粒体内膜上将泛酚转化为泛酚,从而捕获脂质过氧化自由基。此外,GCH-1通过产生四氢生物蝶呤(BH4)抑制整个细胞的铁死亡,四氢生物蝶呤是另一种捕捉自由基的抗氧化剂。铁死亡诱导剂Erastin激活eIF2α-ATF4信号轴,在UPR过程中也通过PERK激活而被诱导。哺乳动物的UPR由多个信号分支组成,这些分支执行不同的尽管是冗余的细胞功能。然而,其他关键的UPR成分如何调节铁死亡的机制在很大程度上还不清楚。
近日,来自德克萨斯大学MD安德森癌症中心的研究者们在Nature Communications 杂志上发表了题为“IRE1α determines ferroptosis sensitivity through regulation of glutathione synthesis”的文章,该研究揭示了IRE 1α通过调节谷胱甘肽合成决定铁死亡敏感性。细胞对铁死亡的敏感性主要是通过调节脂质过氧化氢解毒的机制来调节的。研究者发现,肌醇需要酶1(IRE1α)是一种内质网(ER)驻留蛋白,对未折叠蛋白反应(UPR)至关重要,它也决定了细胞对铁死亡的敏感性。
缺失IRE1α的癌细胞和正常细胞对铁死亡的抵抗力增强,而IRE1α表达增强则提高了对铁死亡的敏感性。在机制上,IRE1α的S内切核酸酶活性切割和下调谷胱甘肽生物合成关键调节因子谷氨酸-半胱氨酸连接酶催化亚基和溶质载体家族7成员11(SLC7A11)的基因。
【8】Nat Commun:靶向SOX1克服胃癌铁死亡耐药性
doi:10.1038/s41467-024-48307-z
胃癌(GC)是世界上第五大最常见的癌症和第四大癌症相关死亡原因。尽管在胃癌管理方面取得了巨大的进步,晚期胃癌患者的预后仍然很差。以顺铂为基础的化疗仍是晚期胃癌的一线辅助或新辅助治疗,但对化疗耐药的认识仍是影响临床疗效的障碍。癌症免疫疗法,包括免疫检查点抑制剂,已经成为治疗各种癌症的有效疗法。然而,由于耐药,只有一小部分胃癌患者(约15%)对免疫治疗有反应。因此,需要进行更多的研究来阐明化疗和免疫耐药的机制。
铁死亡被认为是一种普遍存在的非凋亡性细胞死亡途径,最终导致代谢异常导致的过度脂质过氧化。铁死亡与多种抗癌疗法的疗效有关,包括放疗、化疗、靶向治疗和免疫疗法。Erastin是系统Xc-的强抑制剂,RSL3是典型的GPX4抑制剂。本研究对不同内源性铁死亡抑制系统进行了研究。因此,研究者选择它们进行后续实验。代谢重编程已被公认为癌症的标志之一,可能是一种治疗上可利用的策略来克服耐药性。在这项工作中,基于之前对癌症代谢的研究,研究者提出了一种潜在的代谢机制,赋予铁死亡,化疗和免疫治疗抗性,研究者证明了靶向SOX13/SCAF1抑制呼吸链超复合体(SCs)组装以克服嗜铁细胞介导的胃癌抗癌治疗耐药。
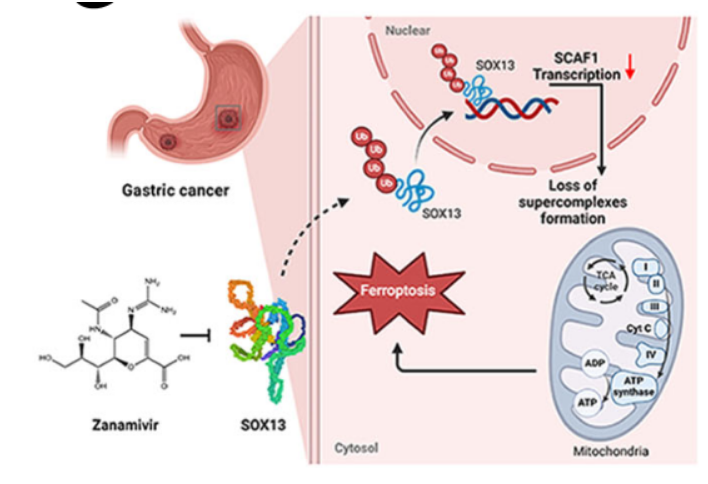
Sox13靶向复方扎那米韦的铁致敏机制图
图片来源:doi:10.1038/s41467-024-48307-z
近日,来自皖南医学院第一附属医院的研究者们在Nat Commun杂志上发表了题为“Targeting SOX13 inhibits assembly of respiratory chain supercomplexes to overcome ferroptosis resistance in gastric cancer”的文章,该研究证明SOX13直接靶向SCAF1,并可能通过诱导NADPH的产生来抑制铁死亡,这是一种潜在的增加晚期胃癌患者的化疗敏感性治疗策略。治疗耐药是晚期胃癌(GC)治疗的瓶颈。铁死亡是一种非凋亡细胞死亡的铁依赖性形式,与抗癌治疗效果有关,需要进一步调查以澄清潜在的机制。
【9】Redox Biology: 线粒体GPX4乙酰化参与镉诱导的肾细胞铁死亡
doi:10.1016/j.redox.2024.103179
急性肾损伤(AKI)是指急性肾功能不全并伴有严重肾小管损伤。一般认为细菌感染引起的脓毒症、各种原因引起的急性肾缺血、药物引起的急性中毒是临床AKI的主要原因。近年来,大量研究表明,环境应激源是AKI的重要诱因。镉(Cd)是一种众所周知的环境应激因子,广泛存在于污染的水体、大气、土壤和食物中。Cd具有剧毒,不可生物降解,半衰期为10-30年。大量研究表明,环境镉暴露可导致睾丸、肝脏、肾脏、骨骼和肺部等多器官的损伤。肾脏确实是镉的主要蓄积器官,已有研究表明,长期接触镉可引发肾功能障碍。几项动物研究表明,接触Cd会导致急性AKI。人们普遍认为坏死和凋亡是AKI发病过程中肾细胞死亡的主要方式。另一方面,自噬是AKI的一种保护机制。多项研究表明,缺血-再灌注急性肾损伤引起的AKI部分参与了坏死性铁死亡。铁死亡是一种以细胞内游离铁超载和膜脂过氧化为特征的新型调节性细胞死亡。膜结构中活性氧(ROS)介导的脂质过氧化过多会引发铁死亡。近年来,大量研究表明防御机制的失效,包括谷胱甘肽过氧化物酶4 (GPX4)和铁死亡抑制蛋白1 (FSP1)是铁死亡的重要原因。有研究表明,急性Cd暴露可导致肾细胞铁死亡。然而,cd诱导铁死亡的潜在机制尚不完全清楚。
近日,来自安徽医科大学毒理学教研室的研究者们在Redox Biol杂志上发表了题为“Mitochondrial GPX4 acetylation is involved in cadmium-induced renal cell ferroptosis”的文章,该研究揭示了线粒体GPX4乙酰化参与镉诱导的肾细胞铁死亡。越来越多的证据表明,环境应激是急性肾损伤(AKI)的重要诱因。本研究旨在探讨暴露于环境应激源Cd对肾细胞铁死亡的影响。
转录组学分析显示,Cd暴露导致小鼠肾脏中花生四烯酸(ARA)代谢途径被破坏。靶向代谢组学显示Cd暴露小鼠肾氧化ARA代谢物增加。在Cd暴露的小鼠肾脏中,肾4-HNE、MDA和ACSL4上调。与动物实验一致,体外实验显示Cd暴露的HK-2细胞线粒体氧化脂质升高。超微结构显示Cd暴露小鼠肾脏线粒体膜破裂,Cd暴露小鼠肾脏线粒体嵴相应减少。
【10】Cancer Res:肠道微生物群介导结直肠癌发展中的铁死亡抵抗
doi:10.1158/0008-5472.CAN-24-0275
结直肠癌(CRC)是美国第三大最常诊断的癌症。结直肠癌的发展受到多种因素的影响,包括内在基因改变,如大肠腺瘤性息肉病(APC)突变,以及来自微环境的外在因素。值得注意的是,随着我们的理解不断发展,肠道微生物组在结直肠癌中的作用已经成为一个活跃的研究课题。虽然所涉及的确切机制是复杂的,尚未完全理解,但传统观点认为某些细菌可能引发炎症反应,影响免疫反应,产生可以促进或抑制癌症发展的代谢物,甚至诱导DNA损伤和突变。
近日,来自美国德克萨斯州西南医学中心的研究者们在Cancer Res杂志上发表了题为“Gut Microbiome Mediates Ferroptosis Resistance for Colorectal Cancer Development”的文章,该研究表明,针对厌氧杆菌介导的铁下死亡耐药性是对抗CRC发展的一种有希望的策略。结直肠癌在美国是一种常见的癌症类型,男女皆有影响,受遗传和环境因素的影响。肠道微生物组在结直肠癌发展和治疗反应中的作用是一个新兴的研究领域。
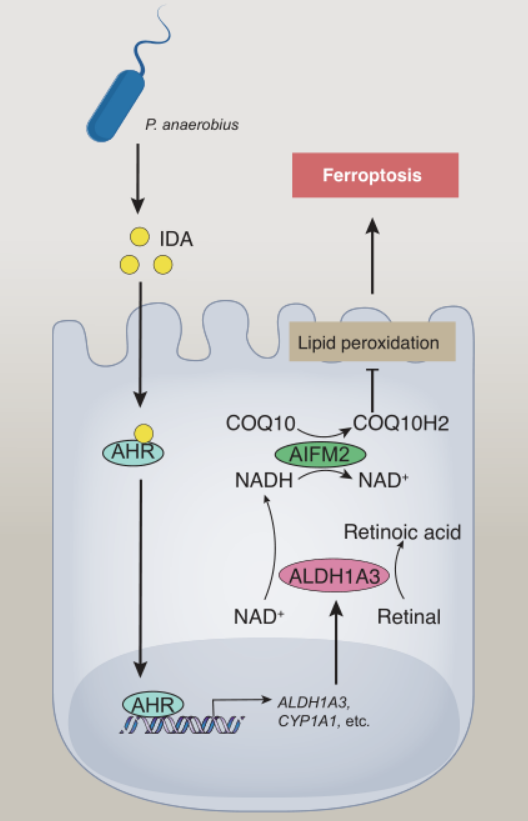
肠道微生物群介导结直肠癌发展中的铁死亡抵抗
图片来源: https://pubmed.ncbi.nlm.nih.gov/38276975/
最近的一项研究发现,反式3-吲哚丙烯酸(IDA)是厌氧菌的一种微生物代谢物,通过抑制铁死亡(一种由无限制的脂质过氧化和随后的膜损伤驱动的非凋亡性细胞死亡)来促进结直肠癌。IDA激活芳烃受体(AHR)这一核转录因子,导致醛脱氢酶1家族成员A3 (ALDH1A3)的表达。ALDH1A3具有醛解毒作用,也通过产生还原性烟酰胺腺嘌呤二核苷酸(NADH)来促进铁中毒抵抗,NADH对凋亡诱导因子线粒体相关2 (AIFM2,也称为FSP1)合成还原性辅酶Q10 (COQH10)至关重要。敲除AHR、AIFM2或ALDH1A3可逆转IDA对铁死亡和IDA介导的肿瘤生长的抑制作用。值得注意的是,厌氧菌在结直肠癌患者中富集,补充IDA或P。在自发或原位小鼠模型中,厌氧菌加速CRC进展。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


