2021年5月CRISPR/Cas研究进展
来源:本站原创 2021-05-31 23:47
2021年5月31日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。2020年10月,德国马克斯-普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士因在CRISPR-Cas9基因编辑方面做
2021年5月31日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。2020年10月,德国马克斯-普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士因在CRISPR-Cas9基因编辑方面做了的贡献荣获2020年诺贝尔化学奖。
CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的5月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nat Commun:利用CRISPR/Cas9介导的A2AR基因缺失可显著增强CAR-T细胞抵抗一系列癌症的疗效
doi:10.1038/s41467-021-23331-5
在CAR-T细胞疗法中,先收集患者自身的免疫细胞,并对它们进行基因改造,然后将它们输注回患者体内以对抗他们体内的癌症。世界各地的科学家们正在开发一种潜在的新方法,使得CAR-T细胞疗法对乳腺癌和其他实体癌更加有效。
腺苷(adenosine)是一种限制抗肿瘤免疫反应的免疫抑制因子,通过激活腺苷A2A受体(adenosine A2A receptor, A2AR)来抑制包括T细胞在内的多种免疫细胞亚群。在一项新的研究中,澳大利亚研究人员通过使用小鼠和人类CAR-T细胞,发现利用临床相关的CRISPR/Cas9策略靶向A2AR,可显著提高这些细胞的体内疗效,从而改善小鼠的生存。相关研究结果于2021年5月28日发表在Nature Communications期刊上,论文标题为“CRISPR/Cas9 mediated deletion of the adenosine A2A receptor enhances CAR T cell efficacy”。
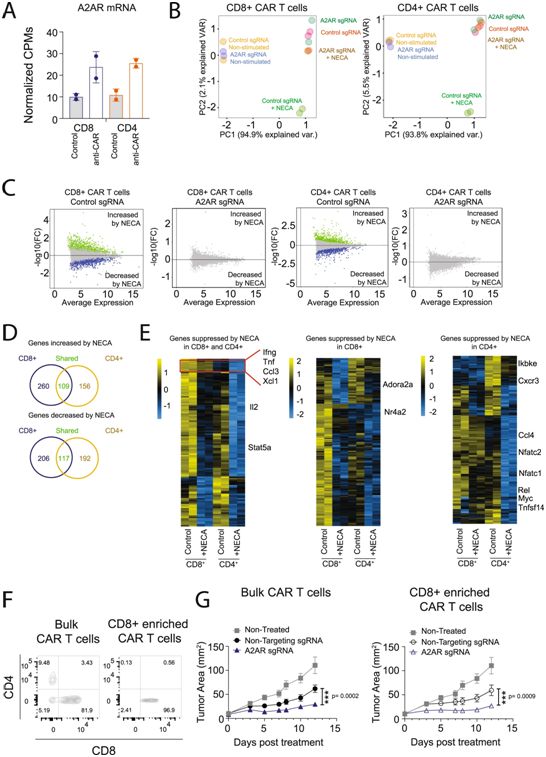
CRISPR/Cas9靶向A2AR可增强CD8+和CD4+CAR-T细胞的作用。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-23331-5。
这些结果表明,与shRNA介导的A2AR敲降或与A2AR药物拮抗剂相结合相比,使用CRISPR/Cas9诱导A2AR的完全敲除是一种增强CAR-T细胞功能的卓越治疗方法。鉴于经过CRISPR/Cas9基因编辑的CAR-T细胞正在用于临床试验,这种方法很容易转化为临床应用。此外,通过CRISPR/Cas9介导的基因编辑靶向A2AR适用于CAR-T细胞治疗包括乳腺癌、卵巢癌、肺癌、急性髓系白血病、多发性骨髓瘤和非霍奇金淋巴瘤在内的多种肿瘤类型,在这些肿瘤类型中,人们已发现腺苷信号可抑制抗肿瘤免疫反应。
2.Science子刊:利用两种基因编辑策略精确校正DMD外显子缺失突变,可恢复97%的dystrophin蛋白产生
doi:10.1126/sciadv.abg4910
杜兴氏肌肉萎缩症(Duchenne muscular dystrophy, DMD,也译为杜兴氏肌肉营养不良症)是儿童中的一种最常见的致命性遗传疾病。DMD在男孩中的发病率为1/5000。它导致肌肉和心脏衰竭,并导致在30岁出头时过早死亡。当患者的肌肉退化时,他们被迫坐在轮椅上,而且当他们的横膈膜减弱时,他们最终依赖呼吸器进行呼吸。尽管科学家们几十年来已知抗肌萎缩蛋白(dystrophin)编码基因发生让这种蛋白不能表达的突变导致这种疾病,但是迄今为止还没有一种有效的治疗方法存在着。 虽然科学家们已鉴定出导致DMD的数千种不同突变,但是这些突变往往集中在dystrophin基因的某些部分上。其中的一些突变导致肌肉细胞产生短小、功能较差的dystrophin蛋白版本。
在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员成功地采用了一种新型的基因疗法来治疗DMD小鼠,独特地利用基于CRISPR-Cas9的工具来恢复在许多DMD患者中缺失的一大部分dystrophin蛋白。这种方法可能会开发用于治疗DMD的方法,并为其他遗传性疾病的治疗提供参考。相关研究结果近期发表在Science Advances期刊上,论文标题为“Precise correction of Duchenne muscular dystrophy exon deletion mutations by base and prime editing”。
这些作者利用了这样一个事实,即dystrophin基因是由许多不同的称为外显子的片段组成的,其中的一些外显子是可有可无的。在大约8%的DMD男孩中,由于51号外显子中发生导致身体停止产生这种蛋白的缺失突变(∆Ex51),近一半的dystrophin蛋白缺失了。他们开发出多种成功的CRISPR-Cas9核苷酸基因编辑策略,以跳过这种错误的“停止”信号,恢复了97%的dystrophin蛋白产生。一些策略通过移除相邻的外显子而发挥作用,而其他策略则利用微小的基因增减来使这种蛋白的产生回到正轨。这意味着他们的方法的力量在于不需要为每个携带新突变的DMD患者采取新的基因编辑策略,相反可以采用一种综合的方法校正多种不同的突变。
当这些作者在携带dystrophin突变的小鼠身上使用这种新方法时,在三周内,dystrophin蛋白的功能性版本在所有腿部肌肉纤维的一半以上中恢复了。此外,他们发现,他们可以使用从患有DMD的小鼠或人类体内分离出的细胞,在治疗前测试该方法是否会在某个特定患者中取得成功。分离的细胞在体外经诱导后产生诱导性多能干细胞(iPS细胞),随后让ips细胞分化为心肌细胞。
具体而言,他们将腺嘌呤碱基编辑器(ABE)的一个优化版本(即ABEmax)包装到腺相关病毒9(AAV9)载体中,并作为split-intein反式剪接系统,通过肌肉内注射将携带ABEmax的AAV9递送到∆Ex51 DMD小鼠模型中,可恢复dystrophin蛋白表达。然后,他们验证了ABEmax通过靶向剪接供体位点(SDS)在DMD基因座上进行外显子跳读的功效,以及在人类ΔEx51 DMD ips细胞中进行外显子重构(exon reframing)的引导编辑(prime editing,即融合的逆转录酶通过扩展的向导RNA模板引入编辑)的功效。在培养皿中,他们可以观察这两种基因编辑方法是否有助于心肌细胞更好地发挥作用。他们指出利用来自DMD患者的ips细胞分化而来的心肌细胞,他们快速测试了他们的核苷酸基因编辑方法,并证实dystrophin蛋白成功恢复了。
3.Nature:在体内对PCSK9基因进行碱基编辑可将猴子体内的坏胆固醇降低约60%
doi:10.1038/s41586-021-03534-y
基因编辑技术,包括CRISPR-Cas核酸酶和CRISPR碱基编辑器,有可能永久性地修改患者体内的致病基因。在非人灵长类动物的靶器官中展示持久性的编辑是在临床试验中对患者进行体内基因编辑之前的关键一步。
在一项新的研究中,来自美国Verve治疗公司和宾夕法尼亚大学佩雷尔曼医学院的研究人员开发出一种CRISPR基因编辑技术,该技术降低了试验猴子血液中的胆固醇水平。相关研究结果发表在2021年5月20日的Nature期刊上,论文标题为“In vivo CRISPR base editing of PCSK9 durably lowers cholesterol in primates”。
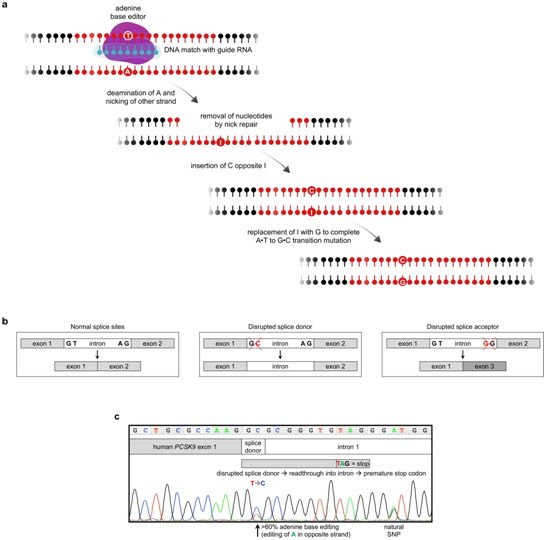
碱基编辑方法概述,图片来自Nature, 2021, doi:10.1038/s41586-021-03534-y。
在单剂注射后,这些作者定期测试食蟹猴的胆固醇水平。他们发现,仅仅一周之后,PCSK9蛋白的水平下降了约90%,低密度脂蛋白胆固醇(LDL-C)水平下降了约60%。他们还发现,这两种下降幅度至少保持了高达10个月的时间。
4.Nat Biotechnol:在体内利用腺嘌呤碱基编辑器让PCSK9发生单点突变,大幅和持续地降低坏胆固醇水平
doi:10.1038/s41587-021-00933-4
碱基编辑是一种新型的基因编辑方法,它可以精确地改变DNA序列中的单个核苷酸。在一项新的研究中,来自瑞士、加拿大、美国和荷兰的研究人员利用碱基编辑在一个特定的基因中产生这样的一个点突变,成功地持续降低了小鼠和猕猴血液中较高的低密度脂蛋白胆固醇(LDL-C)水平。这为治愈遗传性代谢性肝病患者提供了可能。相关研究结果于2021年5月19日在线发表在Nature Biotechnology期刊上,论文标题为“In vivo adenine base editing of PCSK9 in macaques reduces LDL cholesterol levels”。
在这项新的研究中,这些作者证实一种精确的基因编辑方法---腺嘌呤碱基编辑器(ABE)---能够大幅度地和持续地降低较高的LDL-C水平。他们利用ABE在一个编码PCSK9的基因中引入了一个单点突变。这种蛋白参与了LDL-C从血液到细胞的摄取。他们在小鼠和猕猴身上诱导的基因突变成功地阻断了PCSK9,这导致血液中的LDL-C浓度显著降低。这为患有家族性高胆固醇血症(一种遗传性的高胆固醇水平)的患者提供了一种潜在的疗法。
这些作者使用的基因编辑技术称为碱基编辑器。碱基编辑器可将DNA分子中的单个碱基转变为另一个碱基。比如,腺嘌呤碱基编辑器(ABE)将腺嘌呤(A)转换成鸟嘌呤(G)。碱基编辑器比以前的作为分子剪刀起作用的CRISPR-Cas核酸酶更精确地完成这一工作。为了控制这种碱基编辑工具递送到动物的肝脏中,他们采用了用于COVID-19 mRNA疫苗的RNA技术。然而,他们没有将编码SARS-CoV2刺突蛋白的RNA封装到脂质纳米颗粒中,而是将编码ABE的RNA封装到脂质纳米颗粒中。
这些作者将RNA-脂质纳米颗粒静脉注射到小鼠和猕猴体内,导致细胞对碱基编辑器工具的肝脏特异性摄取和短暂性产生。在小鼠中多达三分之二的PCSK9基因被编辑,而在非人类灵长类动物猕猴中多达三分之一的PCSK9基因被编辑,导致LDL-C水平大幅下降。此外,他们仔细评估了是否在不希望的位置发生了非特异性编辑,但没有发现这种脱靶事件的迹象。
5.Cell子刊:新研究利用CRISPR-Cas9成功地对人单核细胞进行基因编辑
doi:10.1016/j.celrep.2021.109105
自CRISPR-Cas9基因编辑技术问世以来的十年间,科学家们已经利用该技术剔除或改变了越来越多的细胞类型中的基因。如今,在一项新的研究中,来自美国格拉德斯通研究所和加州大学旧金山分校的研究人员将人类单核细胞---在免疫系统中发挥关键作用的白细胞---添加到了这一列表中。他们将CRISPR-Cas9应用于单核细胞,并展示了这种技术对了解人类免疫系统如何对抗病毒和细菌的潜在价值。这种技术为鉴定出对单核细胞功能最重要的人类基因以及针对一系列病原体提出新的治疗策略打开了大门,也为更多关于主要传染病和人类免疫细胞之间相互作用的研究奠定了基础。相关研究结果发表在2021年5月11日的Cell Reports期刊上,论文标题为“Efficient generation of isogenic primary human myeloid cells using CRISPR-Cas9 ribonucleoproteins”。
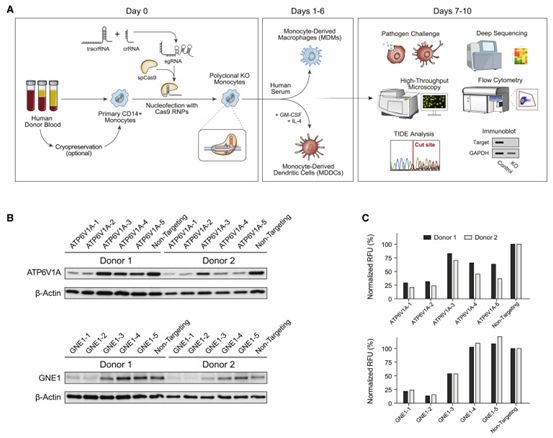
对人类髓系细胞进行CRISPR编辑的灵活平台,图片来自Cell Reports, 2021, doi:10.1016/j.celrep.2021.109105。
这些作者接下来发现,使用CRISPR-Cas9去除单核细胞中的基因SAMHD1---因此也去除所产生的巨噬细胞--使得这些细胞被HIV感染的几率提高了50倍以上。虽然已知SAMHD1可以保护人类细胞免受HIV感染,但该实验证实了他们在单核细胞中的基因编辑方法的成功,以及它在研究疾病方面的前景。
6.Science:利用源自宿主细胞的非典型crRNA可实现Cas9的多重RNA检测
doi:10.1126/science.abe7106; doi:10.1126/science.abi9335
CRISPR-Cas免疫系统通过CRISPR RNA(crRNA)的引导降解外来遗传物质。crRNA作为间隔重复序列单元被编码在这种系统的CRISPR阵列中。每个crRNA通常由对CRISPR阵列进行转录而来的前体进行加工而成,然后与这种系统的Cas效应核酸酶(比如Cas9)合作,直接裂解靶核酸。在作为Cas9核酸酶和许多CRISPR技术的来源的II型系统中,crRNA加工和随后Cas9的DNA靶向需要反式激活crRNA(trans-activating crRNA, tracrRNA)。tracrRNA与转录的CRISPR阵列中每个crRNA的“重复序列”部分杂交。然后,宿主的RNase III裂解形成的RNA茎,产生加工后的crRNA:tracrRNA双链,以供Cas9使用。目前还不清楚的是crRNA是否局限于CRISPR-Cas位点,还是可以从基因组的其他地方获得。
在一项新的研究中,来自德国维尔茨堡大学等研究机构的研究人员发现crRNA可以来自CRISPR-Cas位点以外的宿主RNA,这促进他们开一种新的基于Cas9的诊断平台,允许在一次测试中可扩展地检测多种生物标志物。相关研究结果于2021年4月27日在线发表在Science期刊上,论文标题为“Noncanonical crRNAs derived from host transcripts enable multiplexable RNA detection by Cas9”。
这些作者利用RIP-seq技术和MEME在线工具寻找揭示来自空肠弯曲菌(Campylobacter jejuni)的Cas9(CjeCas9)可以结合的细胞宿主RNA。他们发现两个显著的序列基序:基序#1和基序#2。基序#1与crRNA2引导部分的13个核苷酸互补。令人惊讶的是,基序#2与tracrRNA反重复结构域(anti-repeat domain)的21个核苷酸互补。由于作为crRNA生物发生的一部分,该结构域通常与crRNA重复序列杂交,基序#2提出了这些细胞RNA与tracrRNA杂交从而潜在地成为具有类似crRNA功能的RNA的有趣可能性。
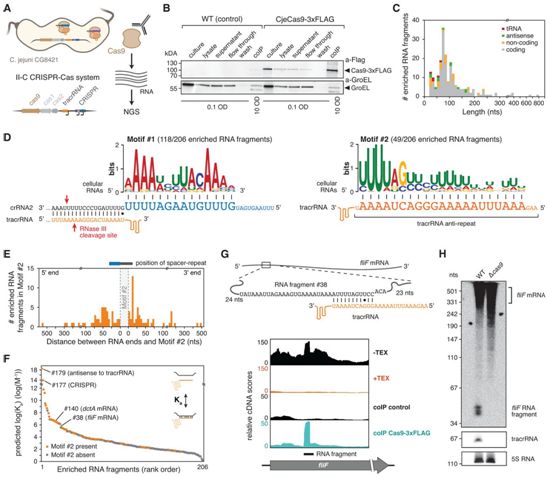
空肠弯曲菌中Cas9结合的细胞RNA片段类似于crRNA。图片来自Science, 2021, doi:10.1126/science.abe7106。
这些作者进一步证实,重编程的tracrRNA(reprogrammed tracrRNA, Rptr)可以将感兴趣的RNA的存在与Cas9的序列特异性DNA靶向联系起来。这种能力可以使Cas9在体内的应用(比如多重转录记录或转录依赖的编辑)成为可能。最直接的应用涉及通过LEOPARD(Leveraging Engineered tracrRNAs and On-target DNAs for PArallel RNA Detection, 利用工程tracrRNA和在靶DNA进行平行RNA检测)在体外进行多重RNA检测。
目前的CRISPR诊断主要依靠Cas12a或Cas13寻找样品中的双链DNA或RNA靶标,在此过程中,靶标识别引起非特异性的单链DNA或RNA裂解荧光报告分子。非特异性荧光读取实际上将一次测试限制为针对一个靶序列。相反,重编程tracrRNA将识别到的RNA转化为ncrRNA,这将引导Cas9靶向匹配的DNA。Cas9结合或裂解匹配的DNA序列将表明样品中存在识别到的RNA。由于每个DNA靶标的序列都是独一无二的,大量的靶序列可以在一次测试中被平行监测。这些作者将由此产生的诊断平台称为LEOPARD。
7.Nat Commun:全基因组CRISPR筛选揭示乳腺癌的易感性和mTOR/Hippo协同潜在靶向治疗策略
doi:10.1038/s41467-021-23316-4
三阴性乳腺癌(TNBC)与侵袭性病理特征相关,包括组织学评分高、有丝分裂指数高、更高的转移率和复发率、缺乏靶向治疗手段以及患者的预后不良等。TNBC作为一种异质性疾病,尽管已将其进行分类,但由于疾病的异质性,TNBC的发病机制的了解仍有限,这也使得有效治疗策略的开发成为了一项艰巨的挑战。
使用基因组编辑系统(如CRISPR/Cas9技术)进行全基因组范围的遗传筛选已成为系统表征癌症易感性的先进工具。尽管最近的一些研究揭示了体内全基因组CRISPR筛查在非小细胞肺癌和白血病中的作用,但其有效性仍有待进一步的研究。
在该研究中,研究人员采用了无偏倚的体内全基因组CRISPR敲除筛选的方式,以在全基因组水平分析TNBC的癌症易感性,并确定致癌和抑癌通路之间的相互作用。
该研究揭示了TNBC患者中mTOR信号通路和Hippo信号通路是调节肿瘤功能的必不可少的组成成分。通过分析药物基质协同模型和患者来源移植瘤模型,研究人员进一步的建立了该治疗相关性,药理学抑制mTORC1/2和癌蛋白YAP能够有效的降低TNBC的肿瘤发生。
分子水平研究显示,虽然维替泊芬(verteporfin)诱导的对YAP抑制作用会导致细胞凋亡的发生,但torin1介导的对mTORC1/2抑制作用却能够促进巨胞饮(macropinocytosis)作用。Torin1诱导的巨胞饮作用能够进一步的促进维替泊芬的摄取,并显著增强其在癌细胞中的促凋亡作用。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


