造血干细胞研究进展(第11期)
来源:生物谷原创 2022-09-30 03:58
造血干细胞的来源主要包括骨髓、外周血和脐带血。造血干细胞近年来可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
1.Science:揭示巨噬细胞在对新生的造血干细胞进行质量审查中起着关键性作用
doi:10.1126/science.abo4837
在一项新的研究中,来自美国波士顿儿童医院的研究人员利用活体成像和细胞条形码技术,瞥见了新的造血干细胞在产生后不久是如何接受质量审查的。这一发现可能对癌症和再生医学产生影响。相关研究结果发表在2022年9月23日的Science期刊上,论文标题为“Quality assurance of hematopoietic stem cells by macrophages determines stem cell clonality”。论文通讯作者波士顿儿童医院的Leonard Zon博士。论文第一作者为Zon实验室的博士生Sam Wattrus。

巨噬细胞特异性地与造血干/祖细胞相互作用。图片来自Science, 2022, doi:10.1126/science.abo4837。
这些作者利用斑马鱼模型观察造血干细胞的产生。他们发现当造血干细胞产生时,它们会到达一个特殊的位置,在那里,称为巨噬细胞的免疫细胞会与每个造血干细胞有亲密的物理接触。他们发现这就是审查发生的时候:显示出应激迹象(具有高水平的称为活性氧的有毒分子)的造血干细胞会被巨噬细胞吞噬和吃掉。相反,明显健康的造血干细胞被允许生存下来,并选择性地发生增殖。
Wattrus及其同事们进一步探索发现,遭受应激的造血干细胞表面携带一种特定的标志物,即一种作为“吃我”信号起作用的蛋白:钙网蛋白(calreticulin)。缺乏钙网蛋白或者只有少量钙网蛋白的造血干细胞就不会被吃掉,似乎还被鼓励发生增殖。巨噬细胞似乎从这些造血干细胞中清除了一些物质,而它们在这一相遇后继续增殖。
2.Nature:挑战常规!胚胎时期的造血祖细胞并不由造血干细胞产生
doi:10.1038/s41586-022-05203-0
在一项新的研究中,来自日本熊本大学、东京女子医科大学、东京大学和新加坡国立大学等研究机构的研究人员利用谱系追踪和HSC缺失的突变小鼠发现在胎儿发育期间,大多数造血祖细胞是直接由HSC前体细胞而不是HSC产生的。此外,谱系追踪还显示,胎儿HSC在出生前对造血祖细胞的产生贡献最小。他们认为这些发现表明,胚胎中的大多数血细胞是不依赖HSC的,并促使人们重新考虑干细胞在胚胎体形成中的作用。相关研究结果发表在2022年9月22日的Nature期刊上,论文标题为“Independent origins of fetal liver haematopoietic stem and progenitor cells”。
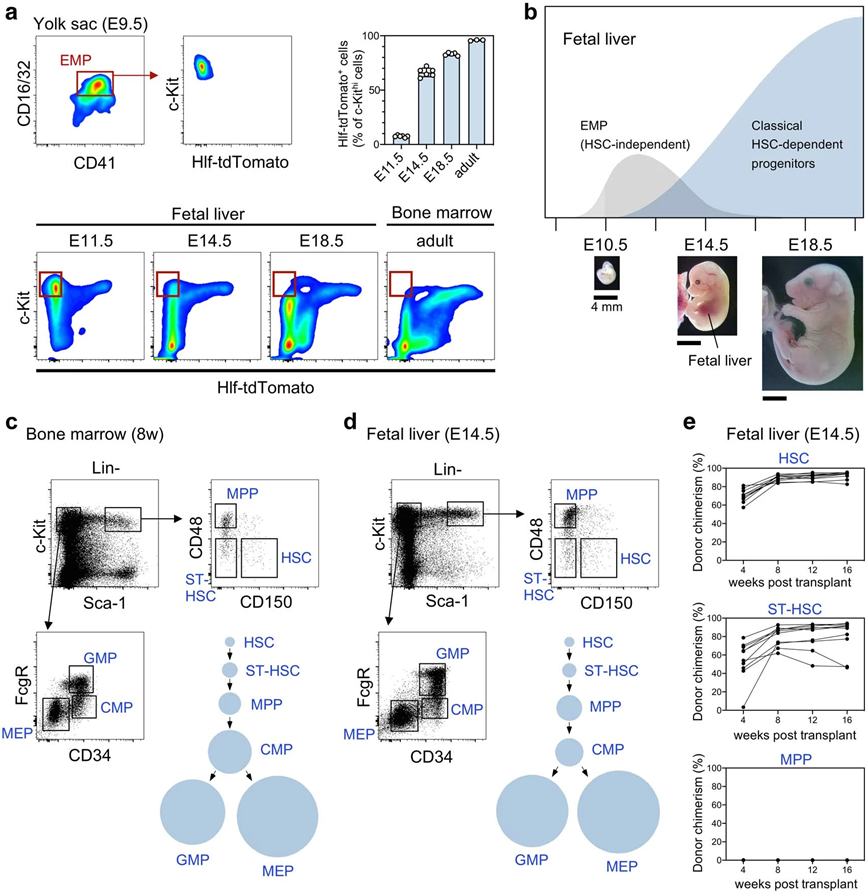
妊娠晚期胎儿肝脏中的造血干细胞和造血祖细胞。图片来自Nature, 2022, doi:10.1038/s41586-022-05203-0。
关于造血系统的形成,这些作者还解决了一个长期存在的问题,即HSC的起源。以前的移植实验结合体外培养提出,造血干细胞主要产生于胚胎内的主动脉-性腺-中期肾(aorta-gonad-mesonephros, AGM)区域。然而,由于缺乏明确的分子和体内证据,这一发现一直存在争议。如今,这项新的研究首次发现转录因子Evi1在胚胎内动脉中特异性表达,并且是造血干细胞产生的必要条件和充分条件。
具体而言,这些作者利用小鼠体内的遗传追踪来分析来自胚胎动脉内造血集群的HSC和造血祖细胞的形成,这些胚胎动脉内造血集群含有HSC前体细胞并表达转录因子肝脏白血病因子(hepatic leukaemia factor, HLF)。通过动力学研究,他们观察到HSC和特定的造血祖细胞---以前被认为是HSC的后代---从HLF+前体细胞群体中同时形成,随后在胎儿肝脏中以一种与HSC无关的方式迅速形成造血细胞群体的层次结构。转录因子EVI1在HSC前体细胞群体中异质表达:EVI1较高表达的HSC前体细胞主要定位在胚胎内的动脉,并优先产生HSC。通过遗传操纵EVI1的表达,他们能够改变体内来自HSC前体细胞的HSC和造血祖细胞输出。利用命运追踪,他们还证实了胎儿HSC在妊娠晚期慢慢被用来产生短期HSC(short-term HSC)。这些数据表明,胎儿HSC在出生前对造血祖细胞和功能性血细胞的产生贡献很小。
3.Cell Stem Cell:新发现!炎症或会加速机体造血系统的衰老从而诱发多种人类疾病!
doi:10.1016/j.stem.2022.06.012
近日,一篇发表在国际杂志Cell Stem Cell上题为“Inflammatory exposure drives long-lived impairment of hematopoietic stem cell self-renewal activity and accelerated aging”的研究报告中,来自德国癌症研究中心等机构的科学家们通过研究发现,在小鼠机体中,早中期的炎症或许会导致功能性造血干细胞功能的永久性下降,当机体遭受炎性挑战后,造血干细胞再生的能力就会被抑制至少一年时间,这或许就表明,感染和炎症或许充当了组织中年龄相关的功能下降的突出驱动因素的角色,早年间暴露于诸如上述挑战的小鼠则会出现临床上相关的衰老特征,这些特征也经常在老年人机体中被观察到。
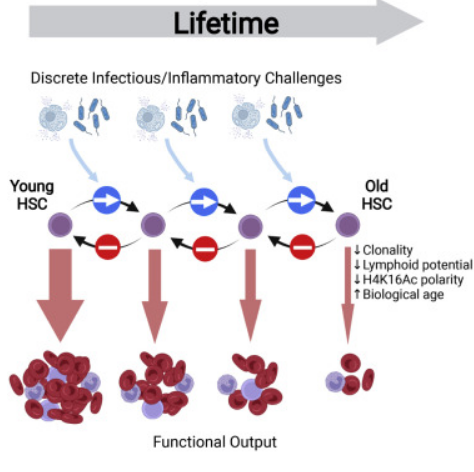
炎症或会加速机体造血系统的衰老从而诱发多种人类疾病。图片来源:Cell Stem Cell (2022). DOI:10.1016/j.stem.2022.06.012。
据研究者介绍,年龄相关的造血系统功能丧失的原因就是称之为炎性衰老的慢性低级别炎性状况,其仅会在玩年间发生,并会损害患者机体造血干细胞的功能。研究者Mick Milsom说道,然而,我们想要回答的问题就是是否早年间的炎症和感染会永久性地损伤造血干细胞的功能,从而促进机体血液系统的衰老。为此,研究人员进行了耗时的实验来确定他们如何观察感染和炎症后机体干细胞功能的抑制性效应,同时他们得出了一个令人惊讶的结论,即他们并未观察到干细胞恢复的任何证据,这就表明,这一过程或许是一项长期甚至可能是不可逆的过程。
研究者表示,小鼠会多次遭受促炎性物质或细菌的挑战,两次注射时间间隔为4周,每轮挑战之间都缺乏干细胞的恢复,这意味着,这些疗法最终就会导致额外的抑制性效应,这或许就支持了一种能解释年龄相关的组织功能异常和疾病发生的模型,即独立的感染或炎症实例或许会对干细胞的功能产生累积性的抑制效应,即使是相隔数月或数年。
随后研究人员识别出了机体造血功能异常的原因,当造血干细胞被驱动分裂以对炎性刺激产生反应时,其往往无法进行自我更新,而缺乏自我更新的长期后果就是造血系统的枯竭,研究人员表示,在小鼠机体中的这一观察结果或许与普通学说相矛盾,此前他们认为,当经历炎症挑战后,造血干细胞就会恢复到所谓的休眠状态,从而保持自身自我更新的能力,本文研究或许得到了意外的发现。
4.JEM: 核因子-κB信号调控顺式造血干细胞H3K9me3基因表达
doi:10.1084/jem.20211356
近日,来自法国的研究者们在J. Exp. Med.杂志上发表了题为“NF-κB signaling controls H3K9me3 levels at intronic LINE-1 and hematopoietic stem cell genes in cis”的文章,该研究揭示了肿瘤坏死因子-α/核因子-κB/H3K9me3/L1Md轴对于维持造血干细胞,同时允许免疫基因在髓系再生或损伤诱导的骨髓移植中的表达可能是重要的。
电离辐射(IR)改变了造血干细胞(HSC)的长期功能,但这些影响的机制仍不清楚。研究者最近发现IR诱导L1Md的去表达,L1Md是LINE-1/L1逆转录元件的小鼠年轻亚家族。L1对基因调控网络有贡献。然而,L1MD如何被解压以及对HSC基因表达的影响尚不清楚。
在这里,研究者表明IR触发全基因组H3K9me3的减少,主要发生在L1Md。H3K9me3在含有NF-κB结合位点基序的内含子L1Md上的丢失,而在启动子上没有丢失,与HSC特异性基因的抑制有关。这与NFKB1抑制子表达减少有关。在体内,肿瘤坏死因子-α治疗挽救了所有这些效应,防止了IR诱导的肝星状细胞功能丧失。
本研究表明L1MD中的NF-κB结合位点可能由于免疫连锁的维持而被活跃地选择在关键的肝干细胞基因的内含子中。这种调节可能通过将更多的基因,包括肝星状细胞维持基因整合到核因子-κB调控网络中来扩大核因子-α和肿瘤坏死因子-κ活性。
5.Acta Pharm Sin B:造血干细胞体外扩增小分子的研究进展
doi:10.1016/j.apsb.2021.12.006
近日,来自中国药科大学的研究者们在Acta Pharmaceutica Sinica B杂志上发表了题为“Development and clinical advancement of small molecules for ex vivo expansion of hematopoietic stem cell”的综述性文章。研究者对HSC的生物学、小分子的发现和药物化学发展、HSC扩增的天然产物及其临床研究进展以及HSC扩增的潜在蛋白质靶点等方面的研究进展进行综述。
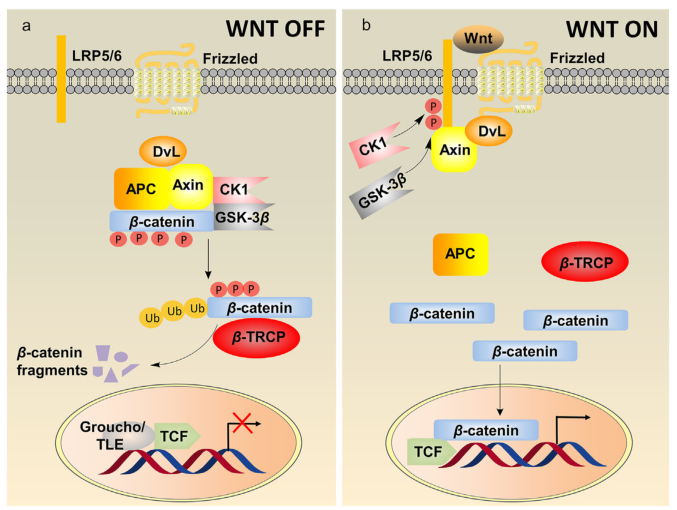
经典的Wnt/b-catenin信号通路。图片来源: https://doi.org/10.1016/j.apsb.2021.12.006
造血干细胞(HSC)移植是治疗许多疾病的唯一疗法。脐带血来源的造血干细胞比骨髓来源的造血干细胞具有许多优点。然而,单个CB单元中的HSC剂量有限,限制了其广泛使用。在过去的二十年里,用小分子体外扩增HSC已经成为获得足够HSC的有效方法。
到目前为止,已有几个小分子化合物进入I/II期试验,显示出安全和良好的药理作用。近年来,随着HSC扩增成为一个热门话题,许多新发现的小分子以及HSC扩增的新的生物学机制将有助于解决这一具有挑战性的问题。
6.Cell Rep:骨髓增生异常综合征(MDS)细胞通过细胞外囊泡损害抑制正常的造血功能
doi:10.1016/j.celrep.2022.110805
近日,东京大学的研究者们在“Cell Report”杂志上发表了题为“MDS cells impair osteolineage differentiation of MSCs via extracellular vesicles to suppress normal hematopoiesis”的文章,该研究揭示了新的MDS EV-MSC轴在无效造血中的作用。
骨髓增生异常综合征(MDS)是一种造血干细胞(HSCs)的克隆性疾病,以无效造血和频繁进展为白血病为特征。MDS细胞的增殖能力较弱,它如何抑制正常的造血并最终主导骨髓空间,长期以来一直没有解决。尽管有几项研究表明间充质基质或干细胞(MSCs)在抑制正常造血中起作用,但这一过程背后的分子机制仍不清楚。
在这里,研究者证明了人和小鼠的MDS细胞都通过抑制MSCs的骨线分化来扰乱骨代谢,从而削弱了MSCs支持正常HSCs的能力。增强的MSC分化挽救了体内和体外MDS模型中被抑制的正常造血。有趣的是,这种抑制效应是可逆的,并由来自MDS细胞的细胞外小泡(EVS)介导。
7.Nat Med:慢病毒造血干细胞/祖细胞基因疗法治疗Wiskott Aldrich综合征的长期安全性和有效性
doi:10.1038/s41591-021-01641-x
近来A. Magnani教授及其团队研究包括单倍体相同的 HSCT 和通过输注基因校正的自体造血干细胞 (HSC) 进行的基因治疗,旨在发现对于缺乏合适HSCT 供体的Wiskott-Aldrich 综合征 (WAS)患者的治疗方案。
本实验纳入7 名严重 WAS 儿童患者,这是一项非随机、开放标签、I/II 期基因治疗临床研究(基于慢病毒基因治疗载体)。收集了这些患者的全面、长期随访疗效和安全性数据(基因治疗后 4-9 年;中位数为 7.6 年)。定期收集有关一系列临床和实验室变量的数据:免疫重建、分类的骨髓和淋巴群体中的 VCN 和 WASp 表达,以及整合位点概况。使用 sjTREC 的实时定量 PCR 测定评估 T 细胞水平,并使用 NGS 评估 TCR 库。
通过分析试验样本,评估 HSC 基因治疗对 WAS 患者的疗效,基于以下参数中有至少一项的临床改善(取决于研究开始时的患者症状特征):湿疹状态、感染的频率和严重程度、瘀伤和出血事件、自身免疫性疾病和与疾病相关的住院天数。次要目标是评估 HSC 基因治疗对 WAS 患者的安全性、HSC 基因治疗对微血小板减少症进展的疗效及其治疗的必要性,以及对其他血液学变量(包括 WASp 表达和重组)的疗效及体液和细胞介导的免疫。中期结果显示考虑到基因修正细胞稳定移植,且没有发生严重的治疗相关不良事件,本研究符合主要结果测试标准。总的来说,严重的感染和湿疹得到了解决。尽管血小板室只有部分矫正,但自身免疫性疾病和出血发作的发生率显著降低。
8.Nat Commun:神经粘连蛋白1调节骨髓血管再生和造血重建
doi:10.1038/s41467-021-27263-y
电离辐射和化疗会耗尽造血干细胞,并破坏造血干细胞所在的血管壁龛。造血干细胞再生需要来自完整的骨髓(BM)血管生态位的信号,但控制BM血管生态位再生的机制却知之甚少。作者报道骨髓血管内皮细胞分泌信号素3A(Semaphorin 3A,SEMA3A),SEMA3A通过其受体Neuropilin 1(Nrp1)和细胞周期蛋白依赖性激酶5(Cyclin Dependent Kinase 5)激活,诱导p53介导的骨髓内皮细胞凋亡。
造血干细胞的维持需要造血干细胞与其骨髓微环境或生态位之间复杂的相互作用,包括来自血管周围基质细胞、血管内皮细胞、交感神经系统、巨噬细胞和巨核细胞的信号。造血干细胞再生是血液系统在化疗、放疗、感染和慢性炎症等相关医学损伤后恢复所必需的过程。造血干细胞再生的机制尚不清楚,但已证明骨髓内皮细胞是骨髓抑制后造血干细胞再生所必需的。
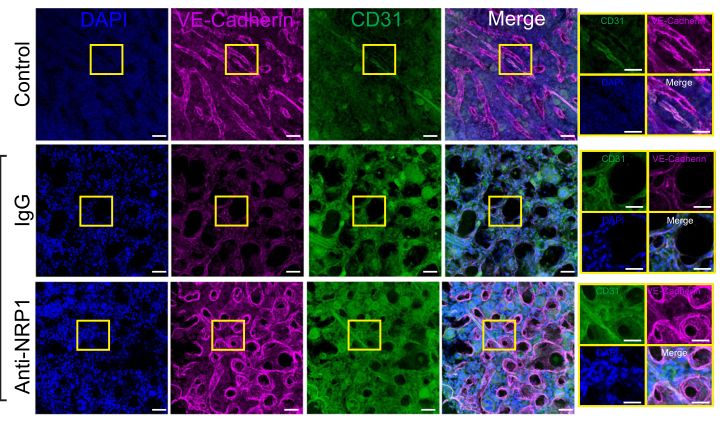
抑制Nrp1促进化疗后骨髓血管和造血再生。图片来源:https://doi.org/10.1038/s41467-021-27263-y
作者还发现骨髓内皮细胞分泌生长因子,包括多营养素和表皮生长因子,这是全身照射(Tbi)后造血干细胞再生所必需的。化疗和放疗也严重损害骨髓血管系统,骨髓清除术后骨髓血管再生的机制尚不完全清楚。
作者最近发现骨髓内皮细胞在颅脑损伤后96小时内增加了编码信号素(SEMA)蛋白的基因的表达,包括分泌的III类SEMA蛋白。Semas是一种细胞外信号蛋白,具有共同的富含半胱氨酸的胞外区,最初被描述为轴突引导分子。在发育过程中,sema蛋白指导神经嵴细胞的迁移和分离,控制皮质神经元和小脑神经元的迁移,并在中枢和外周神经系统之间建立边界。在发育过程中,3类SEMA蛋白已被证明调节背主动脉和胚胎心脏的形成,而SEMA4D促进植入的鸡胚中的血管生成。
指导血管构型和血管生成的内皮尖端细胞也表达SEMA蛋白的NRP和网织蛋白受体。此外,在鸡胚绒毛尿囊膜实验中,3型SIMs还被证明可以抑制血管生成,并通过体外实验调节血管通透性。神经粘连蛋白-1已被证实在骨髓基质细胞系中表达,但信号素信号在调节骨髓血管生成或正常造血中的作用尚不清楚。
doi:10.1172/JCI145501
对于难以治疗的白血病、淋巴瘤和其他血癌,造血干细胞移植是治疗的黄金标准。该方法涉及用供者的造血干细胞替换患者自身的造血干细胞,并在此过程中根除患者血液、淋巴结和骨髓中的癌细胞。但是许多患有这类致命血癌的患者太脆弱了,无法接受造血干细胞移植。这是因为患者自身的造血干细胞首先必须被高强度化疗所摧毁,有时还必须在给供者注入造血干细胞之前进行全身放疗。这种所谓的调理疗法(conditioning regimen)为即将注入的供者造血干细胞提供了空间,有助于清除残留在体内的癌细胞,并耗尽患者自身的免疫系统,使其无法攻击供者的造血干细胞。然而,这种调理疗法引起的毒性作用和免疫系统抑制,使患者处于感染、器官损伤和其他威胁生命的副作用的高风险中。
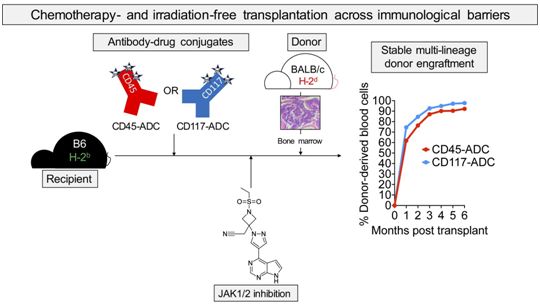
图片来自Journal of Clinical Investigation, 2021, doi:10.1172/JCI145501。
如今,在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员通过研究小鼠,开发出一种不需要放疗或化疗的造血干细胞移植方法。该策略采取了免疫治疗方法,将有针对性地消除骨髓中的造血干细胞与免疫调节药物相结合,从而阻止免疫系统排斥新注入的供者造血干细胞。通过这种新技术,小鼠成功接受了来自无亲缘关系小鼠供者的造血干细胞移植,没有出现危险的低血细胞计数,而传统治疗方案经常出现这一点。这些数据还表明,这种造血干细胞移植可以有效对抗白血病。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“Antibody-drug conjugates plus Janus kinase inhibitors enable MHC-mismatched allogeneic hematopoietic stem cell transplantation”。
这项新的研究为更安全的造血干细胞移植打开了大门,这意味着更多不同类型的血癌患者可能能够接受这种潜在的治愈性治疗,并且可能考虑将其作为其他对生命的威胁较小的疾病的治疗方法,如镰状细胞性贫血或其他遗传性疾病。
10.JCO:新研究有望扩大为血癌患者提供造血干细胞移植的供者范围
doi:10.1200/JCO.21.02286
长期以来,癌症医生对利用来自患有一种称为克隆性造血(clonal hematopoiesis, CH)的无症状血液病的供者的造血干细胞进行移植是否让受者面临后续健康问题的风险产生分歧。这种担忧甚至促使一些移植中心排除这些人作为供者。
在一项新的研究中,来自美国丹娜-法伯癌症研究所的研究人员发现,在大多数情况下,这种移植是安全和有效的。令他们惊讶的是,他们还发现,如果移植的造血干细胞带有特定的基因突变,受者的复发风险往往比供者没有CH的情形时要低。这一发现可能能够扩大潜在受者的范围。相关研究结果于2021年11月18日在线发表在Journal of Clinical Oncology期刊上,论文标题为“Donor Clonal Hematopoiesis and Recipient Outcomes After Transplantation”。
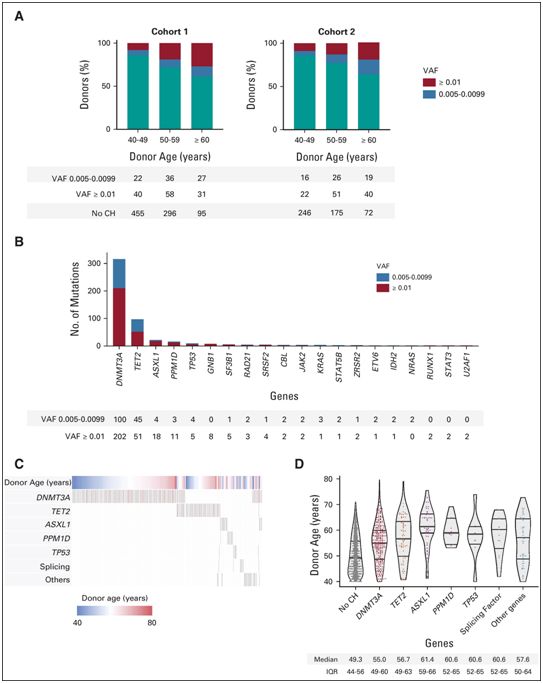
40岁及以上移植供者克隆性造血的特征,图片来自Journal of Clinical Oncology, 2021, doi:10.1200/JCO.21.02286。
这些作者从来自1727名40岁及以上的供者的造血干细胞样本开始研究。在每个样本中,他们分析了46个基因的突变,这些突变通常在CH中发现。他们发现,388名供者---整个供者群体的22.5%---存在CH。最常见的突变发生于基因DNMT3A(存在于14.6%的供者)和TET2(存在于5%的供者)。
这些作者随后评估了这些供者中102人的基因突变是否仍能在移植三个月后和移植一年后的受者中发现。Lindsley说,“我们发现85%来自供者的CH造血干细胞克隆成功定植。出乎意料的是,我们还发现,当至少1%的移植造血干细胞克隆有DNMT3A突变时,患者总体上比接受非CH造血干细胞移植的患者存活得更久,这种效果是由于疾病复发的几率较低。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


