2019年7月Science期刊不得不看的亮点研究
来源:本站原创 2019-07-31 22:34
2019年7月31日讯/生物谷BIOON/---2019年7月份即将结束了,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:南开大学曹雪涛团队揭示hnRNPA2B1识别病毒DNA并促进IFN-α/β产生doi:10.1126/science.aav0758通过模式识别受体(pattern recognition receptor, PRR)识
2019年7月31日讯/生物谷BIOON/---2019年7月份即将结束了,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:南开大学曹雪涛团队揭示hnRNPA2B1识别病毒DNA并促进IFN-α/β产生
doi:10.1126/science.aav0758
通过模式识别受体(pattern recognition receptor, PRR)识别病毒核酸可触发宿主对病毒的先天免疫应答。这导致促炎细胞因子和I型干扰素的产生,其中NF-κB信号转导调节促炎细胞因子的产生,干扰素调节因子(interferon regulatory factor, IRF)信号转导介导I型干扰素(IFN-I)的产生。通常而言,一旦DNA病毒进入宿主细胞,它们就会在宿主细胞核内释放并复制它们的基因组DNA。然而,在细胞核内识别源自病原体的DNA的过程仍然是个谜。
迄今为止,人们仅提出一种称为γ-干扰素诱导蛋白16(IFI16)的蛋白可识别细胞核内的DNA病毒并激活IFN-I的产生和炎症反应。鉴于宿主细胞在细胞核中经常遇到源自病原体的DNA,因此科学家们想要鉴定出细胞核中其他未被描述的促进IFN-1产生的起始因子。
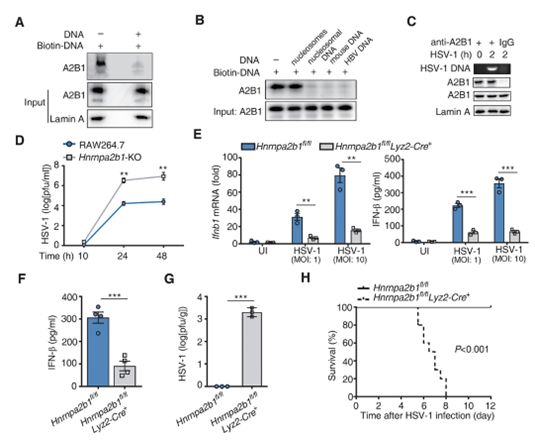
在一项新的研究中,中国南开大学曹雪涛(Xuetao Cao)院士及其团队研究了与单纯疱疹病毒-1(HSV-1)的基因组DNA结合的核蛋白,以及与在病毒感染后迁移到细胞质中的核蛋白。相关研究结果于2019年7月18日在线发表在Science期刊上,论文标题为“Nuclear hnRNPA2B1 initiates and amplifies the innate immune response to DNA viruses”。
曹雪涛团队发现hnRNPA2B1(heterogeneous nuclear ribonucleoprotein A2B1, 异质核核糖核蛋白A2B1)是限制DNA病毒感染的IFN-I产生的核起始因子。在细胞核中直接识别源自病原体的DNA后,hnRNPA2B1转移到细胞质中,从而引发先天性免疫反应。hnRNPA2B1随后同时促进诸如CGAS、IFI16和STING mRNA之类的mRNA进行核-质转移(nucleo-cytoplasmic translocation,即从细胞核转移到细胞质)并在细胞质中表达,这能够扩大抗病毒先天免疫信号转导。
这些研究人员报道hnRNPA2B1识别致病性DNA并扩大IFN-α/β产生。一旦遭受DNA病毒感染,位于细胞核中的hnRNPA2B1感知病毒DNA,发生同源二聚化,然后在精氨酸脱甲基酶JMJD6的作用下在Arg226位点发生去甲基化。这导致hnRNPA2B1从细胞核转移到细胞质中,在细胞质中,它激活TBK1-IRF3通路,从而导致IFN-α/β产生。
2.Science:基因编辑大牛张锋开发出RESCUE技术,可扩大RNA编辑能力
doi:10.1126/science.aax7063
基于CRISPR的工具彻底改变了我们靶向与疾病相关的基因突变的能力。CRISPR技术包括一系列不断增长的能够操纵基因及其表达的工具,包括利用酶Cas9和Cas12靶向DNA,利用酶Cas13靶向RNA。这一系列工具提供了处理突变的不同策略。鉴于RNA寿命相对较短,靶向RNA中与疾病相关的突变可避免基因组发生永久性变化。此外,使用CRISPR/Cas9介导的编辑难以对诸如神经元之类的某些细胞类型进行编辑,因而需要开发新策略来治疗影响大脑的破坏性疾病。
在一项新的研究中,美国麻省理工学院麦戈文脑科学硏究所研究员、布罗德研究所核心成员张锋(Feng Zhang)及其团队如今开发出一种称为RESCUE(RNA Editing for Specific C to U Exchange, C→U交换特异性的RNA编辑)的策略。相关研究结果于2019年7月11日在线发表在Science期刊上,论文标题为“A cytosine deaminase for programmable single-base RNA editing”。
RESCUE显著地扩展了CRISPR工具能够靶向的范围,包括蛋白中可修饰的位点,比如磷酸化位点。这些位点充当蛋白活性的开启/关闭开关,而且主要存在于信号分子和癌症相关通路中。
3.Science:靶向神经酰胺双键可改善胰岛素抵抗和脂肪肝
doi:10.1126/science.aav3722; doi:10.1126/science.aax6594
胰岛素抵抗和脂肪肝是糖尿病和心脏病的主要危险因素。在一项新的研究中,来自美国、巴西、澳大利亚和文莱的研究人员发现一种小的化学变化---改变两个氢原子的位置---使得健康的小鼠和具有胰岛素抵抗性和脂肪肝的小鼠之间存在差异。进行这种改变可以阻止摄入高脂肪饮食的小鼠出现这些症状,并且逆转肥胖小鼠中的前驱糖尿病(prediabetes)。相关研究结果于2019年7月4日在线发表在Science期刊上,论文标题为“Targeting a ceramide double bond improves insulin resistance and hepatic steatosis”。
这些研究人员通过让一种称为二氢神经酰胺去饱和酶1(dihydroceramide desaturase 1, DES1)的酶失活来改变代谢疾病的轨迹。这样做可阻止这种酶从称为神经酰胺的脂肪脂质中移除两个氢原子,因而具有降低体内神经酰胺总量的作用。DES1的作用是通常将一个保守的双键插入到神经酰胺和其他主要鞘脂类的主链中。
这一发现突出了神经酰胺在代谢健康中的作用,并指出DES1是一种“可被药物靶向的”靶标,可能能够用于开发治疗前驱糖尿病、糖尿病和心脏病等代谢紊乱的新方法。
4.Science:重磅!利用疫苗增强CAR-T细胞治疗实体瘤的疗效,可完全清除60%小鼠体内的实体瘤
doi:10.1126/science.aav8692; doi:10.1126/science.aax6331
一种有希望的治疗某些类型癌症的新方法是对患者自身的T细胞进行编程,使得它们能够破坏癌细胞。这种称为CAR-T细胞疗法的方法目前可用于抵抗某些类型的白血病,但是到目前为止它还不能很好地治疗实体瘤,如肺肿瘤或乳腺肿瘤。
如今,在一项新的研究中,来自美国麻省理工学院的研究人员开发出一种新的方法对这种疗法进行改进,使得它可用作一种抵抗几乎任何癌症类型的武器。具体而言,他们开发出一种疫苗,它可显著地增强抗肿瘤T细胞群体,并且允许这些T细胞大力地侵入实体瘤中。相关研究结果发表在2019年7月12日的Science期刊上,论文标题为“Enhanced CAR–T cell activity against solid tumors by vaccine boosting through the chimeric receptor”。
在一项针对小鼠的研究中,这些研究人员发现他们能够完全清除60%的在接受CAR-T细胞治疗的同时还接受了强化疫苗接种的小鼠体内的实体瘤。在治疗实体瘤时,这些接受基因改造的T细胞独自地几乎没有效果。
论文通讯作者、麻省理工学院科赫综合癌症研究所副主任Darrell Irvine说道,“通过添加一种疫苗,对存活没有影响的CAR-T细胞治疗经这种疫苗强化后可导致一半以上的小鼠发生完全缓解。”
5.Science:揭示哺乳动物两性存在性别偏好性的基因表达
doi:10.1126/science.aaw7317
在一项新的研究中,来自来自美国怀特黑德研究所、麻省理工学院和哈佛医学院的研究人员发现了雄性和雌性哺乳动物在基因表达上的全基因组差异。相关研究结果发表在2019年7月19日的Science期刊上,论文标题为“Conservation, acquisition, and functional impact of sex-biased gene expression in mammals”。
哺乳动物性别之间的生理差异通常很容易发现---除了涉及生殖的器官之外,还有骨骼和面部毛发的差异,以及身高差异。之前的研究和观察性证据也表明大脑的工作方式也可能存在一些差异。但是基因表达方面的差异呢?在这项新的研究中,这些研究人员报道这方面的研究很少,这是一个问题---近期的研究表明,存在许多基于性别的健康问题。比如,女性更容易患自身免疫疾病。男性更可能患上心血管疾病。

为了理解为何存在这种差异,医学科学家们需要更好地理解基因组中基于性别的差异。为了更多地了解基于性别的基因表达,这些研究人员对四种非人类哺乳动物---大鼠,小鼠,猕猴和狗---的两种性别的RNA进行了测序。作为他们的研究工作的一部分,他们测试了每种动物的不同组织,以确保每个胚层都得到代表。他们还对来自所有最重要器官的组织进行了测序。然后,他们将他们发现的数据与在基因型组织表达联盟(Genotype Tissue Expression Consortium)数据库中存储的从人类受试者中收集的类似数据进行比较。
这些研究人员在每种组织中发现了数百个保守的性别偏好性基因表达(gender-biased gene expression)的例子。仅举一个例子,他们发现与人类平均身高相关的12%的性别差异可归因于保守的性别偏好性基因表达。他们指出,这些发现很重要,这是因为它们证实基因表达中的性别偏好性能够直接导致性状差异。
6.Science:靶向白细胞中的IRE1α–XBP1信号通路抑制前列腺素合成,改善疼痛治疗
doi:10.1126/science.aau6499; doi:10.1126/science.aay2721
组织损伤触发由免疫细胞协调的快速局部反应,这决定了炎症的维持和消退,因而也就决定了是否从功能损伤和疼痛中恢复。这种炎症过程需要高水平的蛋白合成、折叠、修饰和运输,这些 事件都受到内质网(ER)的调节。过量的蛋白合成和处理可导致错误折叠的蛋白在内质网中积累,从而引起一种称为“内质网应激(ER stress)”的细胞状态和随后的未折叠蛋白反应(UPR )的激活。IRE1α–XBP1信号通路是UPR的一个进化上保守的分支,在维持内质网稳态的同时控制着各种免疫代谢过程。然而,在组织损伤和炎症期间,白细胞中IRE1α–XBP1信号转导的生理 学后果仍然在很大程度上未被探索。IRE1α–XBP1信号转导介导骨髓细胞中促炎细胞因子的快速诱导。这种信号通路还参与脂质代谢过程的调节,这些脂质代谢过程对于健康和疾病中的免疫 细胞功能进行编程是至关重要的。尽管如此,白细胞中的IRE1α–XBP1活化是否会调节由炎症过程引起的疼痛尚未得到研究。有效控制术后疼痛的药品稀缺促进了阿片类药物的使用,这进而 在美国引起阿片类药物危机。鉴定出赋予免疫细胞强有力的镇痛属性的关键分子途径可能会导致人们开发更有效和更安全的疼痛治疗策略。
在一项新的研究中,来自美国、西班牙、巴西和日本的研究人员研究了白细胞内在的IRE1α–XBP1信号转导是否控制参与炎症和疼痛产生的转录和代谢程序。相关研究结果发表在2019年7月19 日的Science期刊上,论文标题为“IRE1α–XBP1 signaling in leukocytes controls prostaglandin biosynthesis and pain”。对由模式识别受体激活的小鼠骨髓来源的树突细胞进行的 转录组学分析揭示出IRE1α对于参与类花生酸(eicosanoid)代谢的基因网络的最佳表达是必需的。IRE1α缺乏减弱了对激活的骨髓细胞中的前列腺素-内过氧化物合酶2(Ptgs2/Cox-2)和前 列腺素E合酶(Ptges/mPGES-1)的正常诱导。这反过来降低了骨髓细胞产生包括促疼痛脂质介质PGE2在内的多种前列腺素的能力。
这些研究人员确定,在通过IRE1α激活后,转录因子XBP1的功能形式与人PTGS2和PTGES基因结合,从而直接诱导它们的表达并实现稳健的PGE2产生。白细胞中IRE1α或XBP1的选择性丧失降低 在遭受促炎性刺激信号攻击时体内的PGE2生物合成,并且降低PGE2依赖性的内脏疼痛模型和术后疼痛模型中的疼痛相关行为。通过使用小分子抑制剂阻断IRE1α激活在所评估的这两种疼痛模 型中引起类似的镇痛作用。
7.Science:N-豆蔻酰化蛋白质量控制机制
doi:10.1126/science.aaw4912
人们早就知道蛋白的稳定性受其N-末端氨基酸残基的影响,并且在过去三十年中大量的研究工作已描述了一系列N-端规则(N-end rule)途径,这些途径通过N-末端的蛋白降解子基序让其所在的蛋白遭受降解。
近期,美国哈佛医学院的Itay Koren、Stephen J. Elledge及其团队开发出全局蛋白稳定性-多肽组(Global Protein Stability- peptidome)技术,并利用它描绘了一组位于蛋白C-末端的蛋白降解子。在一项新的研究中,这些研究人员采用这种方法来探究了人类N-末端组(N terminome)的稳定性,从而允许他们以一种无偏见的方式重新评估他们对蛋白降解子途径的理解。相关研究结果发表在2019年7月5日的Science期刊上,论文标题为“A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation”。
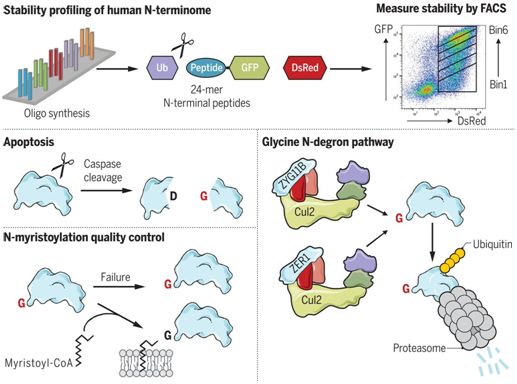
对人类N-末端组的稳定性分析取得两个主要发现:UBR家族E3连接酶的扩展库包括以在一个完整的起始蛋氨酸之后的精氨酸和赖氨酸开始的底物;更值得注意的是,位于N-末端的甘氨酸能够充当一种强大的蛋白降解子。
这些研究人员建立了人胚胎肾293T报告细胞系,在这种细胞系中,带有一种称为N-末端甘氨酸的蛋白降解子的不稳定肽与绿色荧光蛋白(GFP)融合在一起,随后进行CRISPR筛选以鉴定出所涉及的降解机制。这些筛选鉴定出两种由相关的底物衔接蛋白ZYG11B和ZER1定义的Cul2 Cullin-RING E3连接酶复合物,而且这两种复合物冗余地作用于具有N-末端甘氨酸的目标底物,从而让它们被蛋白酶体降解。此外,通过对作为例子加以说明的底物进行饱和诱变,他们确定了由ZYG11B和ZER1特异性识别的优选N-末端甘氨酸蛋白降解子的组成。
8.Science:内质网自噬让细胞保持健康
doi:10.1126/science.aau9263
内质网自噬(ER-phagy)靶向易聚集蛋白位于内质网中的结构域(即内质网结构域)并将它们押送到自噬体中以便将它们递送至液泡或溶酶体中进行降解。当诱导内质网自噬时,内质网自噬受体将它们的结合伴侣---酵母中的Atg8或哺乳动物中的LC3---招募到内质网的离 散位点上,从而促进自噬体形成。这些位点形成于高度动态的由Lnp1加以稳定的管状内质网网络上,其中Lnp1是一种位于管状内质网连接处的保守蛋白。尽管内质网自噬发生在连续内质网网络的离散位点上,但是将内质网装载到自噬体中的受体分散于这个内质网网络中 。内质网上的特定位点如何成为内质网自噬的靶标尚不清楚。
基于此,在一项新的研究中,来自美国加州大学圣地亚哥分校、匹兹堡大学、挪威奥斯陆大学和荷兰格罗宁根大学的研究人员推断细胞质组分可能与内质网自噬受体一起发挥功能以便确定这些位点。COPII包被亚基是这些因子的候选对象,这是因为已知它们将膜结构域与 剩下的占大部分的内质网结构域分离开来。注定要离开内质网的正确折叠蛋白被COPII包被货物衔接复合物(COPII coat cargo adaptor complex)Sec24-Sec23包装到从内质网出芽并运输到高尔基体的运输囊泡(transport vesicle)中。相关研究结果发表在2019年7月5 日的Science期刊上,论文标题为“A COPII subunit acts with an autophagy receptor to target endoplasmic reticulum for degradation”。
这些研究人员发现了COPII货物衔接复合物Lst1/SEC24C-Sec23在靶向内质网结构域进行自噬方面的非常规功能。Lst1/SEC24C介导的内质网自噬是由营养剥夺或者易聚集蛋白的表达所诱导的。在后一种情况下,内质网自噬阻止内质网中的蛋白聚集。含有Lst1/SEC24C- Sec23的内质网自噬位点(ER-phagy sites, ERPHS)的形成需要Lnp1加以稳定的内质网连接(ER junctions)。ERPHS不同于含有Sec24-Sec23的内质网出口位点(ER exit sites, ERES),其中后者从经典的COPII包被的运输囊泡上出芽。因此,这些研究结果表明COPII货 物衔接复合物将不同的货物(ER结构域或输出的蛋白)包装到膜中,随后被引导到不同的途径:内质网自噬或分泌途径。Lst1/SEC24C-Sec23和Sec24-Sec23货物衔接复合物能够通过与内质网跨膜蛋白---内质网自噬受体或输出的蛋白---的细胞质结构域发生相互作用来分 选不同的货物。这些不同的内质网运输途径受到各自的应激反应途径的调节。内质网自噬依赖于TOR依赖性自噬转录调节因子,而分泌途径中的蛋白稳态受到未折叠蛋白反应的调节。
9.Science:揭示哺乳动物卵母细胞中的非中心体纺锤体组装机制
doi:10.1126/science.aat9557
哺乳动物胚胎经常异常发育,从而导致流产和遗传性疾病,如唐氏综合症。胚胎发育异常的主要原因是卵子减数分裂过程中的染色体分离错误。与体细胞和雄性生殖细胞不同的是,卵子通过一种缺乏中心体的特化微管纺锤体分离染色体。典型的中心体由一对被中心粒周围材料包围的中心粒组成,并且是中心体纺锤体(centrosomal spindle)的主要微管组织中心。人们对哺乳动物卵子中的非中心体纺锤体(acentrosomal spindle)是如何组装的知之甚少。
尽管缺乏中心体,但哺乳动物卵子表达许多中心体蛋白。在一项新的研究中,德国研究人员着重系统性地探究了这些中心体蛋白如何定位到非中心体纺锤体,以便组装哺乳动物卵子中的微管。相关研究结果近期发表在Science期刊上,论文标题为“A liquid-like spindle domain promotes acentrosomal spindle assembly in mammalian oocytes”。
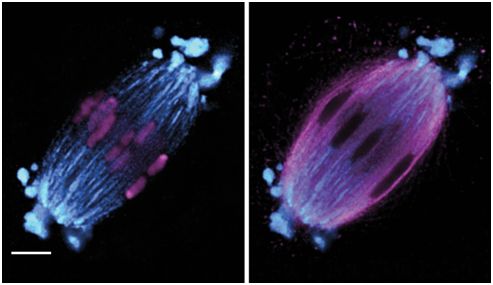
这些研究人员通过在活的和固定的小鼠卵子中联合使用高分辨率显微镜分析了70种中心体和纺锤体相关蛋白的定位。出乎意料的是,这些蛋白中的19种定位于一种纺锤体结构域(spindle domain),这种结构域渗透到纺锤体的大片区域并形成突出的球形突起。这些突起是动态的,彼此融合在一起,并且向外延伸远远超出纺锤体极。这种结构域包括中心体蛋白(AKAP450,CEP170和KIZ),中心粒卫星蛋白(CEP72,PCM1和LRRC36),负端结合蛋白(CAMSAP3和KANSL3),动力蛋白相关蛋白(HOOK3,NDE1,NDEL1和SPDL1)和控制微管成核和稳定性的蛋白(CHC17,chTOG,GTSE1,HAUS6,MCAK,MYO10和TACC3)。位于这种结构域内的蛋白是动态的,能够在整个纺锤体区域中快速地重新分布。通过开展体外和体内测定,他们发现这种结构域通过相分离形成并且表现类似于液体。因此,他们将它称为液体状减数分裂纺锤体结构域(liquid-like meiotic spindle domain, LISD)。LISD也存在于牛、羊和猪卵子的纺锤体中,因而是广泛保守的。许多LISD蛋白已在有丝分裂中得到广泛研究,但是在体细胞中还没有报道类似的结构,这表明LISD可能是卵母细胞中的非中心体纺锤体所独有的。
LISD的组装由具有调节作用的激酶极光A(kinase aurora A)控制并且依赖于激酶极光A的底物TACC3以及网格蛋白重链CHC17,CHC17与TACC3一起结合到微管上。通过不同方式破坏LISD将这种结构域内的微管调节因子释放到细胞质中并导致严重的纺锤体缺陷。纺锤体变得更小且更不稳定,需要较长时间才能分离染色体。微管生长速率显著下降,它们的总周转率显著增加。与染色体着丝点(着丝粒丝)结合的微管以及在纺锤体中央区(极间微管)中以反平行方式重叠的微管都出现严重的缺失。总之,这些数据证实LISD是微管高效组装和形成稳定的非中心体纺锤体所必需的。
10.两篇Science论文指出新的治疗性食品可促进营养不良儿童的肠道微生物组健康发育
doi:10.1126/science.aau4732; doi:10.1126/science.aau4735
在孟加拉国进行的一项初步临床试验中,一种专为修复营养不良儿童的肠道微生物组而设计的新型治疗性食品优于标准疗法。
来自美国华盛顿大学圣路易斯医学院和孟加拉国腹泻疾病研究国际中心等研究机构的一个跨学科研究团队采取了一种新方法来解决儿童营养不良这一紧迫的全球健康问题。他们的方法着重关注于通过使用负担得起的文化上可接受的食物中存在的成分选择性地促进关键的促生长的肠道微生物的健康发育。他们的研究支持这样一种观念,即婴儿和儿童的健康成长与他们出生后的肠道微生物群落的健康发育密不可分。相关研究结果发表在2019年7月12日的Science期刊上的两篇论文中,论文标题分别为“Effects of microbiota-directed foods in gnotobiotic animals and undernourished children”和“A sparse covarying unit that describes healthy and impaired human gut microbiota development”。
论文通讯作者、华盛顿大学圣路易斯医学院基因组科学与系统生物学中心主任Jeffrey I. Gordon博士说道,“我们发现与健康儿童相比,营养不良的儿童具有不完全形成的肠道微生物群落。因此,我们着手开发治疗性食品来修复这种[肠道微生物群落]不成熟现象,并确定这种修复是否会恢复健康生长。”(生物谷 Bioon.com)
1.Science:南开大学曹雪涛团队揭示hnRNPA2B1识别病毒DNA并促进IFN-α/β产生
doi:10.1126/science.aav0758
通过模式识别受体(pattern recognition receptor, PRR)识别病毒核酸可触发宿主对病毒的先天免疫应答。这导致促炎细胞因子和I型干扰素的产生,其中NF-κB信号转导调节促炎细胞因子的产生,干扰素调节因子(interferon regulatory factor, IRF)信号转导介导I型干扰素(IFN-I)的产生。通常而言,一旦DNA病毒进入宿主细胞,它们就会在宿主细胞核内释放并复制它们的基因组DNA。然而,在细胞核内识别源自病原体的DNA的过程仍然是个谜。
迄今为止,人们仅提出一种称为γ-干扰素诱导蛋白16(IFI16)的蛋白可识别细胞核内的DNA病毒并激活IFN-I的产生和炎症反应。鉴于宿主细胞在细胞核中经常遇到源自病原体的DNA,因此科学家们想要鉴定出细胞核中其他未被描述的促进IFN-1产生的起始因子。

图片来自Science, 2019, doi:10.1126/science.aav0758。
在一项新的研究中,中国南开大学曹雪涛(Xuetao Cao)院士及其团队研究了与单纯疱疹病毒-1(HSV-1)的基因组DNA结合的核蛋白,以及与在病毒感染后迁移到细胞质中的核蛋白。相关研究结果于2019年7月18日在线发表在Science期刊上,论文标题为“Nuclear hnRNPA2B1 initiates and amplifies the innate immune response to DNA viruses”。
曹雪涛团队发现hnRNPA2B1(heterogeneous nuclear ribonucleoprotein A2B1, 异质核核糖核蛋白A2B1)是限制DNA病毒感染的IFN-I产生的核起始因子。在细胞核中直接识别源自病原体的DNA后,hnRNPA2B1转移到细胞质中,从而引发先天性免疫反应。hnRNPA2B1随后同时促进诸如CGAS、IFI16和STING mRNA之类的mRNA进行核-质转移(nucleo-cytoplasmic translocation,即从细胞核转移到细胞质)并在细胞质中表达,这能够扩大抗病毒先天免疫信号转导。
这些研究人员报道hnRNPA2B1识别致病性DNA并扩大IFN-α/β产生。一旦遭受DNA病毒感染,位于细胞核中的hnRNPA2B1感知病毒DNA,发生同源二聚化,然后在精氨酸脱甲基酶JMJD6的作用下在Arg226位点发生去甲基化。这导致hnRNPA2B1从细胞核转移到细胞质中,在细胞质中,它激活TBK1-IRF3通路,从而导致IFN-α/β产生。
2.Science:基因编辑大牛张锋开发出RESCUE技术,可扩大RNA编辑能力
doi:10.1126/science.aax7063
基于CRISPR的工具彻底改变了我们靶向与疾病相关的基因突变的能力。CRISPR技术包括一系列不断增长的能够操纵基因及其表达的工具,包括利用酶Cas9和Cas12靶向DNA,利用酶Cas13靶向RNA。这一系列工具提供了处理突变的不同策略。鉴于RNA寿命相对较短,靶向RNA中与疾病相关的突变可避免基因组发生永久性变化。此外,使用CRISPR/Cas9介导的编辑难以对诸如神经元之类的某些细胞类型进行编辑,因而需要开发新策略来治疗影响大脑的破坏性疾病。
在一项新的研究中,美国麻省理工学院麦戈文脑科学硏究所研究员、布罗德研究所核心成员张锋(Feng Zhang)及其团队如今开发出一种称为RESCUE(RNA Editing for Specific C to U Exchange, C→U交换特异性的RNA编辑)的策略。相关研究结果于2019年7月11日在线发表在Science期刊上,论文标题为“A cytosine deaminase for programmable single-base RNA editing”。
RESCUE显著地扩展了CRISPR工具能够靶向的范围,包括蛋白中可修饰的位点,比如磷酸化位点。这些位点充当蛋白活性的开启/关闭开关,而且主要存在于信号分子和癌症相关通路中。
3.Science:靶向神经酰胺双键可改善胰岛素抵抗和脂肪肝
doi:10.1126/science.aav3722; doi:10.1126/science.aax6594
胰岛素抵抗和脂肪肝是糖尿病和心脏病的主要危险因素。在一项新的研究中,来自美国、巴西、澳大利亚和文莱的研究人员发现一种小的化学变化---改变两个氢原子的位置---使得健康的小鼠和具有胰岛素抵抗性和脂肪肝的小鼠之间存在差异。进行这种改变可以阻止摄入高脂肪饮食的小鼠出现这些症状,并且逆转肥胖小鼠中的前驱糖尿病(prediabetes)。相关研究结果于2019年7月4日在线发表在Science期刊上,论文标题为“Targeting a ceramide double bond improves insulin resistance and hepatic steatosis”。

图片来自Trevor Tippetts。
这些研究人员通过让一种称为二氢神经酰胺去饱和酶1(dihydroceramide desaturase 1, DES1)的酶失活来改变代谢疾病的轨迹。这样做可阻止这种酶从称为神经酰胺的脂肪脂质中移除两个氢原子,因而具有降低体内神经酰胺总量的作用。DES1的作用是通常将一个保守的双键插入到神经酰胺和其他主要鞘脂类的主链中。
这一发现突出了神经酰胺在代谢健康中的作用,并指出DES1是一种“可被药物靶向的”靶标,可能能够用于开发治疗前驱糖尿病、糖尿病和心脏病等代谢紊乱的新方法。
4.Science:重磅!利用疫苗增强CAR-T细胞治疗实体瘤的疗效,可完全清除60%小鼠体内的实体瘤
doi:10.1126/science.aav8692; doi:10.1126/science.aax6331
一种有希望的治疗某些类型癌症的新方法是对患者自身的T细胞进行编程,使得它们能够破坏癌细胞。这种称为CAR-T细胞疗法的方法目前可用于抵抗某些类型的白血病,但是到目前为止它还不能很好地治疗实体瘤,如肺肿瘤或乳腺肿瘤。
如今,在一项新的研究中,来自美国麻省理工学院的研究人员开发出一种新的方法对这种疗法进行改进,使得它可用作一种抵抗几乎任何癌症类型的武器。具体而言,他们开发出一种疫苗,它可显著地增强抗肿瘤T细胞群体,并且允许这些T细胞大力地侵入实体瘤中。相关研究结果发表在2019年7月12日的Science期刊上,论文标题为“Enhanced CAR–T cell activity against solid tumors by vaccine boosting through the chimeric receptor”。
在一项针对小鼠的研究中,这些研究人员发现他们能够完全清除60%的在接受CAR-T细胞治疗的同时还接受了强化疫苗接种的小鼠体内的实体瘤。在治疗实体瘤时,这些接受基因改造的T细胞独自地几乎没有效果。
论文通讯作者、麻省理工学院科赫综合癌症研究所副主任Darrell Irvine说道,“通过添加一种疫苗,对存活没有影响的CAR-T细胞治疗经这种疫苗强化后可导致一半以上的小鼠发生完全缓解。”
5.Science:揭示哺乳动物两性存在性别偏好性的基因表达
doi:10.1126/science.aaw7317
在一项新的研究中,来自来自美国怀特黑德研究所、麻省理工学院和哈佛医学院的研究人员发现了雄性和雌性哺乳动物在基因表达上的全基因组差异。相关研究结果发表在2019年7月19日的Science期刊上,论文标题为“Conservation, acquisition, and functional impact of sex-biased gene expression in mammals”。
哺乳动物性别之间的生理差异通常很容易发现---除了涉及生殖的器官之外,还有骨骼和面部毛发的差异,以及身高差异。之前的研究和观察性证据也表明大脑的工作方式也可能存在一些差异。但是基因表达方面的差异呢?在这项新的研究中,这些研究人员报道这方面的研究很少,这是一个问题---近期的研究表明,存在许多基于性别的健康问题。比如,女性更容易患自身免疫疾病。男性更可能患上心血管疾病。

图片来自Science, 2019, doi:10.1126/science.aaw7317。
为了理解为何存在这种差异,医学科学家们需要更好地理解基因组中基于性别的差异。为了更多地了解基于性别的基因表达,这些研究人员对四种非人类哺乳动物---大鼠,小鼠,猕猴和狗---的两种性别的RNA进行了测序。作为他们的研究工作的一部分,他们测试了每种动物的不同组织,以确保每个胚层都得到代表。他们还对来自所有最重要器官的组织进行了测序。然后,他们将他们发现的数据与在基因型组织表达联盟(Genotype Tissue Expression Consortium)数据库中存储的从人类受试者中收集的类似数据进行比较。
这些研究人员在每种组织中发现了数百个保守的性别偏好性基因表达(gender-biased gene expression)的例子。仅举一个例子,他们发现与人类平均身高相关的12%的性别差异可归因于保守的性别偏好性基因表达。他们指出,这些发现很重要,这是因为它们证实基因表达中的性别偏好性能够直接导致性状差异。
6.Science:靶向白细胞中的IRE1α–XBP1信号通路抑制前列腺素合成,改善疼痛治疗
doi:10.1126/science.aau6499; doi:10.1126/science.aay2721
组织损伤触发由免疫细胞协调的快速局部反应,这决定了炎症的维持和消退,因而也就决定了是否从功能损伤和疼痛中恢复。这种炎症过程需要高水平的蛋白合成、折叠、修饰和运输,这些 事件都受到内质网(ER)的调节。过量的蛋白合成和处理可导致错误折叠的蛋白在内质网中积累,从而引起一种称为“内质网应激(ER stress)”的细胞状态和随后的未折叠蛋白反应(UPR )的激活。IRE1α–XBP1信号通路是UPR的一个进化上保守的分支,在维持内质网稳态的同时控制着各种免疫代谢过程。然而,在组织损伤和炎症期间,白细胞中IRE1α–XBP1信号转导的生理 学后果仍然在很大程度上未被探索。IRE1α–XBP1信号转导介导骨髓细胞中促炎细胞因子的快速诱导。这种信号通路还参与脂质代谢过程的调节,这些脂质代谢过程对于健康和疾病中的免疫 细胞功能进行编程是至关重要的。尽管如此,白细胞中的IRE1α–XBP1活化是否会调节由炎症过程引起的疼痛尚未得到研究。有效控制术后疼痛的药品稀缺促进了阿片类药物的使用,这进而 在美国引起阿片类药物危机。鉴定出赋予免疫细胞强有力的镇痛属性的关键分子途径可能会导致人们开发更有效和更安全的疼痛治疗策略。
在一项新的研究中,来自美国、西班牙、巴西和日本的研究人员研究了白细胞内在的IRE1α–XBP1信号转导是否控制参与炎症和疼痛产生的转录和代谢程序。相关研究结果发表在2019年7月19 日的Science期刊上,论文标题为“IRE1α–XBP1 signaling in leukocytes controls prostaglandin biosynthesis and pain”。对由模式识别受体激活的小鼠骨髓来源的树突细胞进行的 转录组学分析揭示出IRE1α对于参与类花生酸(eicosanoid)代谢的基因网络的最佳表达是必需的。IRE1α缺乏减弱了对激活的骨髓细胞中的前列腺素-内过氧化物合酶2(Ptgs2/Cox-2)和前 列腺素E合酶(Ptges/mPGES-1)的正常诱导。这反过来降低了骨髓细胞产生包括促疼痛脂质介质PGE2在内的多种前列腺素的能力。
这些研究人员确定,在通过IRE1α激活后,转录因子XBP1的功能形式与人PTGS2和PTGES基因结合,从而直接诱导它们的表达并实现稳健的PGE2产生。白细胞中IRE1α或XBP1的选择性丧失降低 在遭受促炎性刺激信号攻击时体内的PGE2生物合成,并且降低PGE2依赖性的内脏疼痛模型和术后疼痛模型中的疼痛相关行为。通过使用小分子抑制剂阻断IRE1α激活在所评估的这两种疼痛模 型中引起类似的镇痛作用。
7.Science:N-豆蔻酰化蛋白质量控制机制
doi:10.1126/science.aaw4912
人们早就知道蛋白的稳定性受其N-末端氨基酸残基的影响,并且在过去三十年中大量的研究工作已描述了一系列N-端规则(N-end rule)途径,这些途径通过N-末端的蛋白降解子基序让其所在的蛋白遭受降解。
近期,美国哈佛医学院的Itay Koren、Stephen J. Elledge及其团队开发出全局蛋白稳定性-多肽组(Global Protein Stability- peptidome)技术,并利用它描绘了一组位于蛋白C-末端的蛋白降解子。在一项新的研究中,这些研究人员采用这种方法来探究了人类N-末端组(N terminome)的稳定性,从而允许他们以一种无偏见的方式重新评估他们对蛋白降解子途径的理解。相关研究结果发表在2019年7月5日的Science期刊上,论文标题为“A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation”。

图片来自Science, 2019, doi:10.1126/science.aaw4912。
对人类N-末端组的稳定性分析取得两个主要发现:UBR家族E3连接酶的扩展库包括以在一个完整的起始蛋氨酸之后的精氨酸和赖氨酸开始的底物;更值得注意的是,位于N-末端的甘氨酸能够充当一种强大的蛋白降解子。
这些研究人员建立了人胚胎肾293T报告细胞系,在这种细胞系中,带有一种称为N-末端甘氨酸的蛋白降解子的不稳定肽与绿色荧光蛋白(GFP)融合在一起,随后进行CRISPR筛选以鉴定出所涉及的降解机制。这些筛选鉴定出两种由相关的底物衔接蛋白ZYG11B和ZER1定义的Cul2 Cullin-RING E3连接酶复合物,而且这两种复合物冗余地作用于具有N-末端甘氨酸的目标底物,从而让它们被蛋白酶体降解。此外,通过对作为例子加以说明的底物进行饱和诱变,他们确定了由ZYG11B和ZER1特异性识别的优选N-末端甘氨酸蛋白降解子的组成。
8.Science:内质网自噬让细胞保持健康
doi:10.1126/science.aau9263
内质网自噬(ER-phagy)靶向易聚集蛋白位于内质网中的结构域(即内质网结构域)并将它们押送到自噬体中以便将它们递送至液泡或溶酶体中进行降解。当诱导内质网自噬时,内质网自噬受体将它们的结合伴侣---酵母中的Atg8或哺乳动物中的LC3---招募到内质网的离 散位点上,从而促进自噬体形成。这些位点形成于高度动态的由Lnp1加以稳定的管状内质网网络上,其中Lnp1是一种位于管状内质网连接处的保守蛋白。尽管内质网自噬发生在连续内质网网络的离散位点上,但是将内质网装载到自噬体中的受体分散于这个内质网网络中 。内质网上的特定位点如何成为内质网自噬的靶标尚不清楚。
基于此,在一项新的研究中,来自美国加州大学圣地亚哥分校、匹兹堡大学、挪威奥斯陆大学和荷兰格罗宁根大学的研究人员推断细胞质组分可能与内质网自噬受体一起发挥功能以便确定这些位点。COPII包被亚基是这些因子的候选对象,这是因为已知它们将膜结构域与 剩下的占大部分的内质网结构域分离开来。注定要离开内质网的正确折叠蛋白被COPII包被货物衔接复合物(COPII coat cargo adaptor complex)Sec24-Sec23包装到从内质网出芽并运输到高尔基体的运输囊泡(transport vesicle)中。相关研究结果发表在2019年7月5 日的Science期刊上,论文标题为“A COPII subunit acts with an autophagy receptor to target endoplasmic reticulum for degradation”。
这些研究人员发现了COPII货物衔接复合物Lst1/SEC24C-Sec23在靶向内质网结构域进行自噬方面的非常规功能。Lst1/SEC24C介导的内质网自噬是由营养剥夺或者易聚集蛋白的表达所诱导的。在后一种情况下,内质网自噬阻止内质网中的蛋白聚集。含有Lst1/SEC24C- Sec23的内质网自噬位点(ER-phagy sites, ERPHS)的形成需要Lnp1加以稳定的内质网连接(ER junctions)。ERPHS不同于含有Sec24-Sec23的内质网出口位点(ER exit sites, ERES),其中后者从经典的COPII包被的运输囊泡上出芽。因此,这些研究结果表明COPII货 物衔接复合物将不同的货物(ER结构域或输出的蛋白)包装到膜中,随后被引导到不同的途径:内质网自噬或分泌途径。Lst1/SEC24C-Sec23和Sec24-Sec23货物衔接复合物能够通过与内质网跨膜蛋白---内质网自噬受体或输出的蛋白---的细胞质结构域发生相互作用来分 选不同的货物。这些不同的内质网运输途径受到各自的应激反应途径的调节。内质网自噬依赖于TOR依赖性自噬转录调节因子,而分泌途径中的蛋白稳态受到未折叠蛋白反应的调节。
9.Science:揭示哺乳动物卵母细胞中的非中心体纺锤体组装机制
doi:10.1126/science.aat9557
哺乳动物胚胎经常异常发育,从而导致流产和遗传性疾病,如唐氏综合症。胚胎发育异常的主要原因是卵子减数分裂过程中的染色体分离错误。与体细胞和雄性生殖细胞不同的是,卵子通过一种缺乏中心体的特化微管纺锤体分离染色体。典型的中心体由一对被中心粒周围材料包围的中心粒组成,并且是中心体纺锤体(centrosomal spindle)的主要微管组织中心。人们对哺乳动物卵子中的非中心体纺锤体(acentrosomal spindle)是如何组装的知之甚少。
尽管缺乏中心体,但哺乳动物卵子表达许多中心体蛋白。在一项新的研究中,德国研究人员着重系统性地探究了这些中心体蛋白如何定位到非中心体纺锤体,以便组装哺乳动物卵子中的微管。相关研究结果近期发表在Science期刊上,论文标题为“A liquid-like spindle domain promotes acentrosomal spindle assembly in mammalian oocytes”。

图片来自Science, 2019, doi:10.1126/science.aat9557。

图片来源:Cell。
这些研究人员通过在活的和固定的小鼠卵子中联合使用高分辨率显微镜分析了70种中心体和纺锤体相关蛋白的定位。出乎意料的是,这些蛋白中的19种定位于一种纺锤体结构域(spindle domain),这种结构域渗透到纺锤体的大片区域并形成突出的球形突起。这些突起是动态的,彼此融合在一起,并且向外延伸远远超出纺锤体极。这种结构域包括中心体蛋白(AKAP450,CEP170和KIZ),中心粒卫星蛋白(CEP72,PCM1和LRRC36),负端结合蛋白(CAMSAP3和KANSL3),动力蛋白相关蛋白(HOOK3,NDE1,NDEL1和SPDL1)和控制微管成核和稳定性的蛋白(CHC17,chTOG,GTSE1,HAUS6,MCAK,MYO10和TACC3)。位于这种结构域内的蛋白是动态的,能够在整个纺锤体区域中快速地重新分布。通过开展体外和体内测定,他们发现这种结构域通过相分离形成并且表现类似于液体。因此,他们将它称为液体状减数分裂纺锤体结构域(liquid-like meiotic spindle domain, LISD)。LISD也存在于牛、羊和猪卵子的纺锤体中,因而是广泛保守的。许多LISD蛋白已在有丝分裂中得到广泛研究,但是在体细胞中还没有报道类似的结构,这表明LISD可能是卵母细胞中的非中心体纺锤体所独有的。
LISD的组装由具有调节作用的激酶极光A(kinase aurora A)控制并且依赖于激酶极光A的底物TACC3以及网格蛋白重链CHC17,CHC17与TACC3一起结合到微管上。通过不同方式破坏LISD将这种结构域内的微管调节因子释放到细胞质中并导致严重的纺锤体缺陷。纺锤体变得更小且更不稳定,需要较长时间才能分离染色体。微管生长速率显著下降,它们的总周转率显著增加。与染色体着丝点(着丝粒丝)结合的微管以及在纺锤体中央区(极间微管)中以反平行方式重叠的微管都出现严重的缺失。总之,这些数据证实LISD是微管高效组装和形成稳定的非中心体纺锤体所必需的。
10.两篇Science论文指出新的治疗性食品可促进营养不良儿童的肠道微生物组健康发育
doi:10.1126/science.aau4732; doi:10.1126/science.aau4735
在孟加拉国进行的一项初步临床试验中,一种专为修复营养不良儿童的肠道微生物组而设计的新型治疗性食品优于标准疗法。
来自美国华盛顿大学圣路易斯医学院和孟加拉国腹泻疾病研究国际中心等研究机构的一个跨学科研究团队采取了一种新方法来解决儿童营养不良这一紧迫的全球健康问题。他们的方法着重关注于通过使用负担得起的文化上可接受的食物中存在的成分选择性地促进关键的促生长的肠道微生物的健康发育。他们的研究支持这样一种观念,即婴儿和儿童的健康成长与他们出生后的肠道微生物群落的健康发育密不可分。相关研究结果发表在2019年7月12日的Science期刊上的两篇论文中,论文标题分别为“Effects of microbiota-directed foods in gnotobiotic animals and undernourished children”和“A sparse covarying unit that describes healthy and impaired human gut microbiota development”。
论文通讯作者、华盛顿大学圣路易斯医学院基因组科学与系统生物学中心主任Jeffrey I. Gordon博士说道,“我们发现与健康儿童相比,营养不良的儿童具有不完全形成的肠道微生物群落。因此,我们着手开发治疗性食品来修复这种[肠道微生物群落]不成熟现象,并确定这种修复是否会恢复健康生长。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


