Science:揭示N-豆蔻酰化蛋白质量控制机制
来源:本站原创 2019-07-17 08:36
2019年7月17日讯/生物谷BIOON/---泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞实现选择性蛋白降解的主要途径。E3泛素连接酶是这种系统中特异性的主要决定因素,这种特异性被认为是通过选择性识别底物蛋白中的特定蛋白降解子(degron)基序来实现的。然而,人们识别这些蛋白降解子并将它们与其相关的E3连接酶匹配在一起的能力仍然面临重大挑战。人们
2019年7月17日讯/生物谷BIOON/---泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞实现选择性蛋白降解的主要途径。E3泛素连接酶是这种系统中特异性的主要决定因素,这种特异性被认为是通过选择性识别底物蛋白中的特定蛋白降解子(degron)基序来实现的。然而,人们识别这些蛋白降解子并将它们与其相关的E3连接酶匹配在一起的能力仍然面临重大挑战。
人们早就知道蛋白的稳定性受其N-末端氨基酸残基的影响,并且在过去三十年中大量的研究工作已描述了一系列N-端规则(N-end rule)途径,这些途径通过N-末端的蛋白降解子基序让其所在的蛋白遭受降解。
近期,美国哈佛医学院的Itay Koren、Stephen J. Elledge及其团队开发出全局蛋白稳定性-多肽组(Global Protein Stability- peptidome)技术,并利用它描绘了一组位于蛋白C-末端的蛋白降解子。在一项新的研究中,这些研究人员采用这种方法探究了人类N-末端组(N terminome)的稳定性,从而允许他们以一种无偏见的方式重新评估他们对蛋白降解子途径的理解。相关研究结果发表在2019年7月5日的Science期刊上,论文标题为“A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation”。
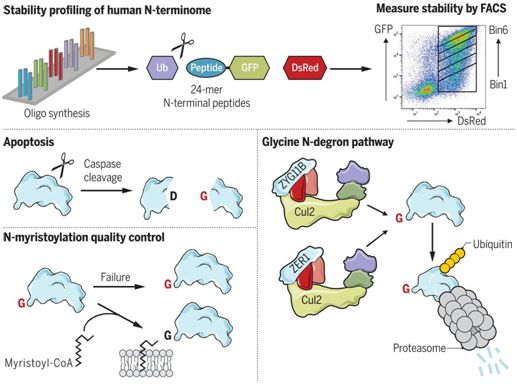
对人类N-末端组的稳定性分析取得两项重大发现:UBR家族E3连接酶的扩展库包括以在一个完整的起始蛋氨酸之后的精氨酸和赖氨酸开始的底物;更值得注意的是,位于N-末端的甘氨酸能够充当一种强大的蛋白降解子。
这些研究人员建立了人胚胎肾293T报告细胞系,在这种细胞系中,带有一种称为N-末端甘氨酸的蛋白降解子的不稳定肽与绿色荧光蛋白(GFP)融合在一起,随后进行CRISPR筛选以鉴定出所涉及的降解机制。这些筛选鉴定出两种由相关的底物衔接蛋白ZYG11B和ZER1定义的Cul2 Cullin-RING E3连接酶复合物,而且这两种复合物冗余地作用于具有N-末端甘氨酸的目标底物,从而让它们被蛋白酶体降解。此外,通过对作为例子加以说明的底物进行饱和诱变,他们确定了由ZYG11B和ZER1特异性识别的优选N-末端甘氨酸蛋白降解子的组成。
这些研究人员发现优选的N-末端甘氨酸蛋白降解子从后生动物蛋白质组的天然N末端移除,这表明蛋白经过进化后避免通过这种途径进行降解,但在经过注释的半胱天冬酶(caspase)切割位点上强烈富集。对位于所有已知的半胱天冬酶切割位点下游的N-末端肽开展的稳定性分析证实了Cul2ZYG11B和Cul2ZER1可在凋亡过程中对蛋白水解切割产物的移除作出重大贡献。
最后,这些研究人员确定了ZYG11B和ZER1在N-豆蔻酰化蛋白(N-myristoylated protein)质量控制中的作用。N-豆蔻酰化是一种重要的翻译后修饰,仅在N-末端甘氨酸上发生。通过在不存在N-肉豆蔻酰基转移酶NMT1和NMT2的情况下分析人N-末端组的稳定性,他们发现未经历N-豆蔻酰化反应的蛋白底物会暴露出它的N末端甘氨酸蛋白降解子,不然这些蛋白降解子会被遮挡住。因此,让甘氨酸蛋白降解子有条件地暴露于ZYG11B和ZER1中,从而可以允许对已逃避N末端豆蔻酰化的异常蛋白进行选择性蛋白酶体降解。
综上所述,这些数据表明另外一种以N-末端甘氨酸为中心的N-末端蛋白降解子途径调节后生动物蛋白质组的稳定性。Cul2ZYG11B和Cul2ZER1介导的通过N-末端甘氨酸蛋白降解子进行的蛋白降解可能在清除细胞凋亡过程中由半胱天冬酶切割产生的蛋白水解片段和N-豆蔻酰化蛋白的质量控制中起着特别重要的作用。(生物谷 Bioon.com)
参考资料:
Richard T. Timms et al. A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation. Science, 2019, doi:10.1126/science.aaw4912.
人们早就知道蛋白的稳定性受其N-末端氨基酸残基的影响,并且在过去三十年中大量的研究工作已描述了一系列N-端规则(N-end rule)途径,这些途径通过N-末端的蛋白降解子基序让其所在的蛋白遭受降解。
近期,美国哈佛医学院的Itay Koren、Stephen J. Elledge及其团队开发出全局蛋白稳定性-多肽组(Global Protein Stability- peptidome)技术,并利用它描绘了一组位于蛋白C-末端的蛋白降解子。在一项新的研究中,这些研究人员采用这种方法探究了人类N-末端组(N terminome)的稳定性,从而允许他们以一种无偏见的方式重新评估他们对蛋白降解子途径的理解。相关研究结果发表在2019年7月5日的Science期刊上,论文标题为“A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation”。

图片来自Science, 2019, doi:10.1126/science.aaw4912。
对人类N-末端组的稳定性分析取得两项重大发现:UBR家族E3连接酶的扩展库包括以在一个完整的起始蛋氨酸之后的精氨酸和赖氨酸开始的底物;更值得注意的是,位于N-末端的甘氨酸能够充当一种强大的蛋白降解子。
这些研究人员建立了人胚胎肾293T报告细胞系,在这种细胞系中,带有一种称为N-末端甘氨酸的蛋白降解子的不稳定肽与绿色荧光蛋白(GFP)融合在一起,随后进行CRISPR筛选以鉴定出所涉及的降解机制。这些筛选鉴定出两种由相关的底物衔接蛋白ZYG11B和ZER1定义的Cul2 Cullin-RING E3连接酶复合物,而且这两种复合物冗余地作用于具有N-末端甘氨酸的目标底物,从而让它们被蛋白酶体降解。此外,通过对作为例子加以说明的底物进行饱和诱变,他们确定了由ZYG11B和ZER1特异性识别的优选N-末端甘氨酸蛋白降解子的组成。
这些研究人员发现优选的N-末端甘氨酸蛋白降解子从后生动物蛋白质组的天然N末端移除,这表明蛋白经过进化后避免通过这种途径进行降解,但在经过注释的半胱天冬酶(caspase)切割位点上强烈富集。对位于所有已知的半胱天冬酶切割位点下游的N-末端肽开展的稳定性分析证实了Cul2ZYG11B和Cul2ZER1可在凋亡过程中对蛋白水解切割产物的移除作出重大贡献。
最后,这些研究人员确定了ZYG11B和ZER1在N-豆蔻酰化蛋白(N-myristoylated protein)质量控制中的作用。N-豆蔻酰化是一种重要的翻译后修饰,仅在N-末端甘氨酸上发生。通过在不存在N-肉豆蔻酰基转移酶NMT1和NMT2的情况下分析人N-末端组的稳定性,他们发现未经历N-豆蔻酰化反应的蛋白底物会暴露出它的N末端甘氨酸蛋白降解子,不然这些蛋白降解子会被遮挡住。因此,让甘氨酸蛋白降解子有条件地暴露于ZYG11B和ZER1中,从而可以允许对已逃避N末端豆蔻酰化的异常蛋白进行选择性蛋白酶体降解。
综上所述,这些数据表明另外一种以N-末端甘氨酸为中心的N-末端蛋白降解子途径调节后生动物蛋白质组的稳定性。Cul2ZYG11B和Cul2ZER1介导的通过N-末端甘氨酸蛋白降解子进行的蛋白降解可能在清除细胞凋亡过程中由半胱天冬酶切割产生的蛋白水解片段和N-豆蔻酰化蛋白的质量控制中起着特别重要的作用。(生物谷 Bioon.com)
参考资料:
Richard T. Timms et al. A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation. Science, 2019, doi:10.1126/science.aaw4912.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


