2021年10月CRISPR/Cas研究进展
来源:本站原创 2021-10-31 23:46
2021年10月31日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。2020年10月,德国马克斯-普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士因在CRISPR-Cas9基因编辑方面
2021年10月31日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。2020年10月,德国马克斯-普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士因在CRISPR-Cas9基因编辑方面做了的贡献荣获2020年诺贝尔化学奖。
CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的10月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Cell:新工具Repair-seq可用于改进CRISPR基因编辑
doi:10.1016/j.cell.2021.10.002
通过改变活细胞内的DNA序列来编辑基因组的能力对于研究来说是非常强大的,并为疾病的治疗带来了巨大的希望。然而,现有的基因组编辑技术经常导致不必要的突变,或者根本无法引入任何变化。这些问题使该领域无法发挥它的全部潜力。
如今,在第一项新的研究中,美国普林斯顿大学研究员Britt Adamson、麻省理工学院生物系教授Jonathan Weissman、之前在Editas Medicine公司工作的Cecilia Cotta-Ramusino及其同事们详细介绍了一种名为Repair-seq的新方法,它详细地揭示了基因组编辑工具如何发挥作用。相关研究结果发表在2021年10月28日的Cell期刊上,论文标题为“Mapping the genetic landscape of DNA double-strand break repair”。
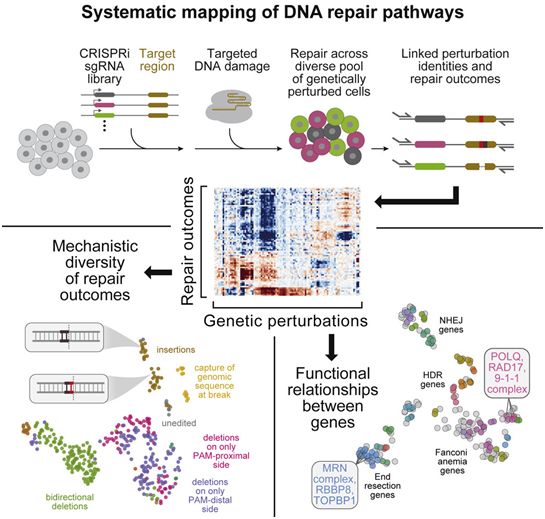
图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.002。
Repair-seq实验产生了大量的数据。由Hussmann领导的对这些数据的分析,产生了不同的DNA修复途径如何与特定类型的Cas9诱导突变相关联的图谱。在该领域丰富的研究历史基础上,Hussmann的分析阐明了已经知道的途径,并确定了新的途径,这些途径共同突出了参与双链断裂修复的巨大复杂性和一系列系统。这项研究中分析的一组深层数据如今被发布在一个在线门户网站(https://seq.repair/)上,其他人可以用这些数据来探究DNA修复基因和途径。
2.CRISPR/Cas9组合筛选揭示了人类乳腺癌中相互作用的肿瘤抑制基因和治疗靶点的上位性网络
doi:10.1158/0008-5472.CAN-21-2555
大多数癌症是由多种基因改变驱动的,但这些改变在肿瘤发生过程中是如何协同作用的仍然是未知数。为了了解肿瘤抑制基因(TSGs)之间促进肿瘤遗传相互作用的机制,作者在人类乳腺上皮细胞中进行了组合CRISPR筛选和单细胞转录组分析。正如预期的那样,乳腺上皮细胞中不同的驱动基因改变影响了能够诱导肿瘤形成的抑癌基因改变库。更令人惊讶的是,TSG相互作用网络由许多由3或4个基因组成的小集团组组成,以至于小集团中的每个TSG都与小集团中的所有其他基因显示出致癌合作。
遗传相互作用分析表明,主要合作的tsg具有重叠的功能,而不是独特的或互补的功能。CRISPR双敲除的单细胞转录组分析显示,协同促进肿瘤发生和生长因子独立的TSGs显示转录上位性,而非协同的TSGs则没有。这些上位性转录变化,既有缓冲作用,也有协同作用,影响了致癌介质和治疗靶点的表达,包括CDK4、SRPK1和DNMT1。重要的是,在该系统中,由PTEN和TP53等双失活的TSGs引起的上位性表达改变也在患者肿瘤中观察到,确立了这些发现与人类乳腺癌的相关性。
在过去的几年里,组合CRISPR筛选方法的发展使得系统分析哺乳动物系统中的遗传相互作用成为可能。然而,组合CRISPR本身并不能解决这些基因相互作用背后的生物学问题。最近,将聚合CRISPR筛选与单细胞转录组读数结合在一起的高含量表型方法已经出现,使得基于生长的表型效应可以与转录组范围的变化并行分析。这些工具和技术为人们提供了一个机会,系统地分析灭活的抑癌基因组合如何改变人类乳腺上皮细胞的生长特性和基因表达谱,以确定驱动基因合作的一般机制。人类乳腺癌基因组数据指导了作者的研究,也被用来作为实验转录组结果的基准。
该研究的一个重要结果是,它证明了任何癌症的驱动基因相互作用可以系统地绘制,使用组合CRISPR筛选肿瘤生长或其他与转录组广泛变化并行的生理相关的生长效应。虽然可以不经筛选就发现上位性表达变化,但可以相信未来的工作是系统性的是很重要的。
3.Genes & Devel:科学家利用基因编辑技术成功将用于储存的脂肪细胞转化成燃烧能量的脂肪细胞
doi:10.1101/gad.348762.121
目前研究人员并不清楚白色脂肪组织内驱动生热的米色脂肪细胞生物合成的全部低温反应细胞类型,近日,一篇发表在国际杂志Genes & Development上题为“Cold-responsive adipocyte progenitors couple adrenergic signaling to immune cell activation to promote beige adipocyte accrual”的研究报告中,来自西南医学中心的科学家们通过研究成功利用CRISPR基因编辑技术将机体用于储存的脂肪细胞转化成了燃烧能量的细胞。

图片来源:http://genesdev.cshlp.org/content/35/19-20/1333
这项研究获得了美国NIH的资助,研究人员认为,驱动这些燃烧能量的脂肪细胞的产生或能作为一种新型疗法来抵御诸如糖尿病等多种人类代谢性疾病。人体中存在两种主要类型的脂肪细胞,白色脂肪细胞能作为能量储存的场所,在肥胖患者机体中能表现为数量和体积扩大;而燃烧能量的棕色和米色脂肪细胞则能燃烧过多的热量从而产热,并增加能量的消耗;有益的棕色脂肪细胞能保护机体抵御糖尿病和心血管疾病的发生,肥胖患者机体中棕色和米色脂肪细胞的数量要少得多。
4.基于CRISPR/Cas9的基因编辑技术在癌症基础研究、诊断和治疗中的应用
doi:10.1186/s12943-021-01431-6
由于癌症是由肿瘤细胞的基因组变化引起的,CRISPR/Cas9可用于癌症研究领域,对基因组进行编辑,探索肿瘤发生发展的机制。近年来,CRISPR/Cas9系统在癌症研究和治疗中得到越来越多的应用,并取得了显著的成果。本文主要介绍了基于CRISPR/ cas9的基因编辑系统的机制和发展,并对该技术在肿瘤基础研究、诊断和治疗中的应用现状进行了综述。此外,还讨论了CRISPR/Cas9在肿瘤研究新热点中的潜在应用,并指出了面临的挑战和未来的方向。
癌症是一种死亡率高且受到全球关注的难治性疾病。恶性肿瘤导致全球六分之一的死亡,从而威胁到成千上万人的生命。尽管在癌症治疗领域,包括手术、放疗、化疗、靶向生物治疗和新型联合治疗等方面取得了许多令人振奋的成果,但高的术后复发率、放疗/化疗耐药性和有害的毒副作用仍然是生存时间和生活质量的障碍。研究表明,癌症是一种潜在的致命疾病,它积累了多个基因,并改变了整个基因组的表观遗传学。癌症中基因的突变通常会推动癌症的进程并影响肿瘤发生的未来。在过去的二十年中,高通量测序技术鉴定了大量与癌症发生和发展相关的基因。基于这些进展,基因编辑技术有望通过调节基因表达和纠正基因突变来治疗癌症,这可能导致精准肿瘤领域的进一步突破。
包括锌指核酸内切酶 (ZFN)、转录激活因子样效应核酸酶 (TALEN) 和成簇规则间隔短回文重复序列/CRISPR 相关核酸酶 (CRISPR/Cas) 系统在内的多种技术被应用于实现基因编辑。CRISPR/Cas系统具有设计简单、实施迅速、成本低、可扩展性强等优点,研究者认为它是一个革命性的基因编辑工具箱,已扩展到几乎所有基因组目标。特别是,该系统已广泛应用于癌症研究,并已成为一种潜在的癌症诊断和治疗方法。获得2020年诺贝尔化学奖是CRISPR基因编辑优势的有力证明。
在本文中,作者重点介绍了CRISPR/Cas基因编辑技术如何为癌症基础研究、诊断和治疗开辟新途径。作者还讨论了CRISPR/Cas技术目前的局限性,并展望了未来CRISPR/Cas技术在癌症生物学中的发展方向。
5.Science:重大进展!发现一种新型的切割RNA的III型CRISPR-Cas系统
doi:10.1126/science.abk2718
在一项新的研究中,荷兰代尔夫特理工大学的Stan Brouns博士及其研究团队发现了一种新型的可以切割RNA的III型CRISPR-Cas系统。这一发现预计将为基因研究和生物技术的新应用开发提供许多机会。相关研究结果于2021年8月26日在线发表在Science期刊上,论文标题
为“The gRAMP CRISPR-Cas effector is an RNA endonuclease complexed with a caspase-like peptidase”。
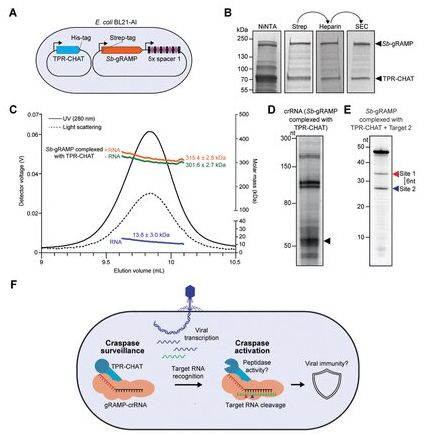
图片来自Science, 2021, doi:10.1126/science.abk2718。
Brouns说,“自2006年以来,我们一直试图了解CRISPR-Cas系统,并且不断发现CRISPR-Cas的新变体,可以用于重要的应用。例如,CRISPR-Cas9允许对细胞中的DNA进行非常精确的编辑。这在研究界掀起了一场真正的革命,例如在研究遗传性疾病方面。CRISPR-Cas系统 也被证明是众所周知的PCR检测冠状病毒的一种令人关注的替代选择。我们如今发现的这种新的III型CRISPR-Cas系统不是在DNA上起作用,而是在RNA上起作用,这提供了一系列新的可能性。”
6.Cell:开发出一种新的基因递送载体---MyoAAV,有潜力使基因疗法更安全和更有效地肌肉疾病
doi:10.1016/j.cell.2021.08.028
遗传性肌肉疾病导致渐进性肌肉萎缩,经常导致早期死亡,治疗选择很少,也无法治愈。一些基因疗法使用无害的病毒载体将致病基因的功能性拷贝递送给细胞,在临床试验中显示出对一部分肌肉营养不良症的治疗前景,但也面临挑战。携带功能性基因拷贝的病毒载体需要高剂量才能到达整个身体的肌肉,而这些临床试验中使用的病毒载体往往最终地更多地进入肝脏而不是肌肉。这导致肝脏中的病毒载体含量过高,出现严重的不良副作用,甚至导致一些临床试验参与者的死亡。
在一项新的研究中,来自美国布罗德研究所和哈佛大学等研究机构的研究人员开发出一个新的腺相关病毒(AAV)家族---基因治疗中的基因递送主力,它们改善了对肌肉组织的靶向性,这对肌肉疾病患者可能更安全、更有效。这组病毒载体(他们称之为MyoAAV)到达肌肉的效率比目前临床试验中使用的病毒载体高10倍以上,并且在很大程度上避开了肝脏。他们发现,由于这种效率的提高,MyoAAV可用于递送治疗性基因,其剂量比其他研究和临床试验中使用的病毒载体低约100至250倍,有可能减少肝脏损伤和其他严重副作用的风险。相关研究结果于2021年9月9日在线发表在Cell期刊上,论文标题为“Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species”。论文通讯作者为哈佛大学教授、布罗德研究所成员Pardis C. Sabeti、Sabeti实验室的Mohammadsharif Tabebordbar和哈佛大学干细胞与再生生物学系教授Amy Wagers。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.08.028。
利用MyoAAV,这些作者将治疗性基因或CRISPR-Cas9基因编辑系统专门递送给肌肉细胞。他们改善了杜兴氏肌营养不良症小鼠模型和X连锁肌管性肌病小鼠模型的肌肉功能,其中杜兴氏肌营养不良症是最常见的遗传性肌肉疾病,而X连锁肌管性肌病是一种更罕见的遗传性肌肉疾病。他们还发现,MyoAAV可以有效地将基因疗法传递给非人类灵长类动物的肌肉和人类肌肉细胞。
7.Science:重大进展!CRISPR大牛张锋教授发现一类极具应用潜力的新型基因编辑系统---转座子编码的RNA引导的DNA内切酶
doi:10.1126/science.abj6856
在过去十年内,科学家们已经将来自微生物的CRISPR系统改造成了基因编辑技术,这是一种精确的、可编程的修改DNA的系统。如今,在一项新的研究中,来自美国麻省理工学院麦戈文研究所和布罗德研究所的研究人员发现了一类新的可编程的DNA修改系统,称为OMEGA(Obligate Mobile Element Guided Activity),它们可能天然地参与了在整个细菌基因组中重排小片段 DNA的工作。相关研究结果于2021年9月9日在线发表在Science期刊上,论文标题为“The widespread IS200/605 transposon family encodes diverse programmable RNA-guided endonucleases”。
这些古老的DNA切割酶由小片段RNA引导到它们的靶标。虽然它们起源于细菌,但它们如今已被设计成能在人体细胞中起作用,这表明它们在开发基因编辑疗法方面可能是有用的,特别是因为它们很小(大约为Cas9的30%),使它们比体积较大的DNA切割酶更容易被递送到细胞中。这一发现提供了证据表明,天然RNA引导的酶是地球上最丰富的蛋白质之一的,并指出了一个巨大的生物学新领域,该领域有望推动基因组编辑技术的下一次革命。
OMEGA蛋白可能由RNA引导的第一个暗示来自于称为IscB的蛋白编码基因。IscB不参与CRISPR免疫反应,也不知道是否与RNA结合,但它们看起来像小型的DNA切割酶。Zhang团队发现,每个IscB附近都有一个小RNA,它指导IscB酶切割特定的DNA序列。他们将这些RNA命名为“ωRNA”。Zhang团队的实验表明,另外两类称为IsrB和TnpB的小蛋白(细菌中最丰富的基因之一)也使用ωRNA作为向导来指导DNA切割。IscB、IsrB和TnpB存在于称为转座子的可动遗传因子中,具体而言存在IS200/IS605转座子家族中。论文共同第一作者Han Altae-Tran解释说,每次这些转座子移动时,它们都会产生一个新的gRNA,使它们编码的酶能够在基因组的其他地方进行切割。
8.Nature:重大进展!发现一种精确切割RNA的CRISPR系统---Cas7-11
doi:10.1038/s41586-021-03886-5
在一项新的研究中,来自美国麻省理工学院麦戈文研究所的研究人员发现了一种细菌酶,他们说这种酶可以扩大科学家们使用的CRISPR工具箱,使其能够轻松地切割和编辑RNA,而在此之前,这种精确性只适用于DNA编辑。这种他们最终命名为Cas7-11的细菌酶在不伤害细胞的情况下修改RNA靶标,这表明除了是一种有价值的研究工具外,它还为治疗应用提供了一个肥沃的平台。相关研究结果于2021年9月6日在线发表在Nature期刊上,论文标题为“Programmable RNA targeting with the single-protein CRISPR effector Cas7-11”。
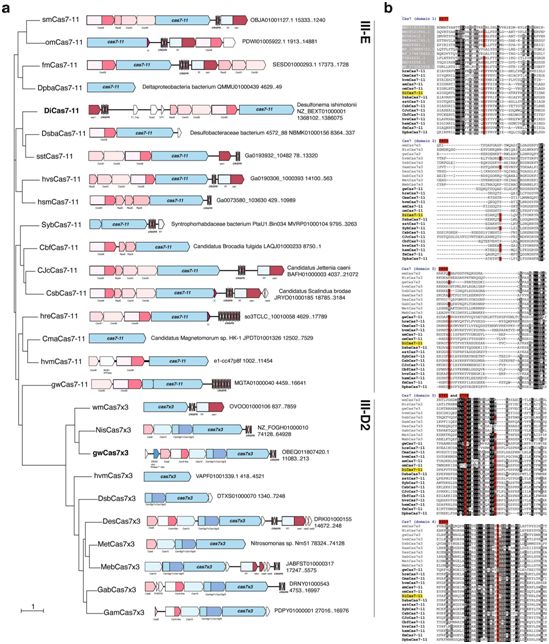
额外的III-E型家族成员和新颖的III-D2型位点结构和具有代表性的同源物的多重比对。图片来自Nature, 2021, doi:10.1038/s41586-021-03886-5。
Cas7-11从工程的角度来看是很有吸引力的,因为单一的蛋白质更容易被递送到细胞中,并且比复杂的多蛋白复合物更容易成为编辑工具。但是它的组成也标志着一个意想不到的进化史。这些作者发现有证据表明,通过进化,更复杂的Cas机器的组件融合在一起,形成了Cas7-11蛋白。Gootenberg将此等同于当你之前认为鸟类是唯一会飞的动物时发现了蝙蝠,从而认识到有多种进化路径来实现飞行。他说,“这完全改变了人们对CRISPR系统的思考方式,无论是在功能上还是在进化上。”
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



