早期肺癌里程碑!美国FDA批准罗氏Tecentriq(泰圣奇):第一个辅助治疗NSCLC的癌症免疫疗法!
来源:本站原创 2021-10-17 03:12
这是首次,一种癌症免疫疗法可延长许多可切除早期肺癌患者的生命,而不会复发。
2021年10月16日讯 /生物谷BIOON/ --罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已批准抗PD-L1疗法Tecentriq(泰圣奇,通用名:atezolizumab,阿替利珠单抗):用于肿瘤表达PD-L1≥1%的II-IIIA期非小细胞肺癌(NSCLC)成人患者,作为手术和铂类化疗后的辅助治疗。该批准基于3期IMpower010研究的结果,数据显示,与最佳支持护理(BSC)相比,Tecentriq辅助治疗可将PD-L1阳性II-IIIA期NSCLC患者的无病生存期(DFS)提高三分之一以上。
辅助治疗的目的是降低复发的风险,并提供最佳的治愈机会。尽管如此,大约一半的早期(I-II期)或局部晚期(III期)NSCLC患者在接受治愈为目的治疗后最终会出现疾病复发。辅助铂类化疗是目前用于完全切除后有高疾病复发风险的早期NSCLC(IB-IIIA期)患者的标准护理方案。与观察相比,辅助铂类化疗使5年生存率适度提高4-5%。因此,该领域对新的辅助治疗方案存在着重大未满足医疗需求。
值得一提的是,Tecentriq是第一个也是唯一一个被批准用于辅助治疗NSCLC的癌症免疫疗法,将开创一个新的时代:确诊为早期肺癌的患者,将有机会接受癌症免疫疗法来提高治愈机会。今天的里程碑式批准,将为医生和患者提供了一种治疗早期肺癌的新方法,这种新方法有潜力显著降低癌症复发的风险,而十年多来,早期肺癌方面的治疗进展很有限。
Tecentriq辅助治疗PD-L1阳性早期NSCLC通过美国FDA实时肿瘤学审查(RTOR)试点项目和Orbis项目获得审批。RTOR项目旨在探索更有效的审查流程,以确保尽早为患者提供安全有效的治疗。Orbis项目旨在为美国FDA及其国际合作的监管机构提供一个针对肿瘤产品的共同提交和审批协作框架,加快审评流程,实现不同国家同步批准癌症用药申请。
GO2基金会联合创始人兼主席Bonnie Addario表示:“太多的早期肺癌患者在手术后经历疾病复发。现在,手术和化疗后进行免疫治疗,将为许多患者提供新的希望和一个强有力的新工具来降低癌症复发的风险。有了这项批准,早期筛查肺癌并在诊断时检测PD-L1比以往任何时候都更加重要,以帮助将这一进展带给能够受益的人群。”
IMpower010临床数据(点击图片,查看大图)
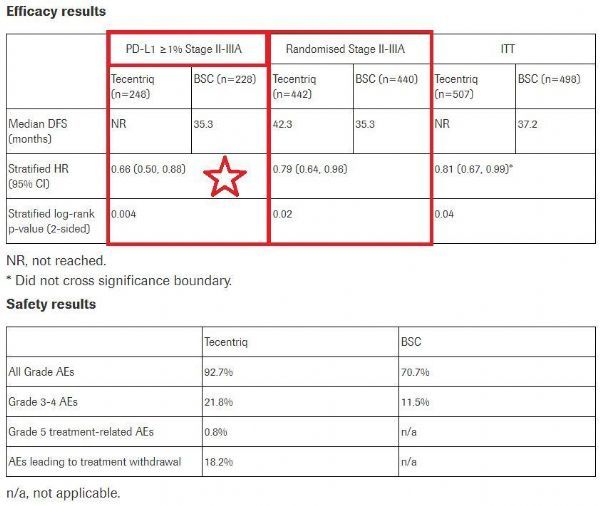
IMpower010是一项全球性、多中心、开放标签、随机3期研究,评估IB-IIIA期NSCLC(UICC第7版)患者在进行外科手术切除和最多4个疗程以顺铂为基础的辅助化疗之后,将Tecentriq、BSC用于辅助治疗的疗效和安全性。该研究中,1005例患者以1:1的比例随机分配,最多接受16个疗程的Tecentriq或BSC。主要终点:PD-L1阳性II-IIIA期患者群体、所有随机化II-IIIA期患者群体、意向性治疗(ITT)IB-IIIA期患者群体中,由研究调查员确定的无病生存期(ivDFS)。关键次要终点包括:整个研究群体、ITT IB-IIIA期NSCLC患者群体中的总生存期(OS)。结果显示:
——在肿瘤表达PD-L1≥1%的II-IIIA期NSCLC患者中:在手术和化疗之后,将Tecentriq用于辅助治疗时,与BSC相比,将疾病复发或死亡风险显著降低了34%(HR=0.66;95%CI:0.50-0.88;p=0.004)。在该患者群体中,Tecentriq治疗组中位DFS尚未达到,BSC组中位DFS为35.3个月。
——在所有随机化II-IIIA期NSCLC患者中:中位随访32.2个月后,与BSC相比,Tecentriq将疾病复发或死亡风险降低了21%(HR=0.79;95%CI:0.64-0.96;p=0.02)。在该患者群体中,与BSC组相比,Tecentriq组中位DFS延长了7个月(42.3个月 vs 35.3个月)。
该研究中,Tecentriq的安全数据与其已知的安全概况一致,未发现新的安全信号。在整个研究群体中,Tecentriq组有92.7%、BSC组有70.7%的患者发生不良事件(AE);Tecentriq组有21.8%、BSC组有11.5%的患者发生3级或4级AE。Tecentriq组有0.8%的患者发生5级AE。正如预期的那样,在化疗后进行长达一年的辅助治疗时,与BSC相比,Tecentriq导致了更多的不良事件。
该研究将继续对患者进行随访,以便对整个意向性治疗(ITT)患者群体中的DFS进行计划性分析,包括IB期患者,这些患者在此次分析时数据未超过阈值;在中期分析时,总体生存期(OS)数据还不成熟。
肺癌是全球癌症死亡的首要原因。每年有180万人死于该疾病;这意味着全世界每天有4900多人死亡。肺癌可大致分为两大类:非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。NSCLC是最常见的类型,约占所有病例的85%。约50%的NSCLC被诊断为早期(I-II期)或局部晚期(III期)疾病。目前,约50%的早期肺癌患者在手术后仍然会经历癌症复发。在肺癌扩散之前及早治疗,可能帮助防止疾病复发,并为患者提供最佳的治愈机会。
此前,Tecentriq已在各种类型的肺癌中显示出有临床意义的益处,目前在美国有6个肺癌治疗适应症获得批准。除了成为第一个辅助治疗NSCLC的癌症免疫疗法之外,Tecentriq还是第一个被批准用于一线治疗广泛期小细胞肺癌(ES-SCLC)成人患者的癌症免疫疗法(与化疗[卡铂+依托泊苷]联合用药)。Tecentriq在晚期NSCLC方面已获批4个治疗适应症:作为单药疗法、或与靶向疗法和/或化疗联合治疗。Tecentriq有3种给药方案,可灵活选择每2周、3周、4周给药一次。
Tecentriq属于PD-(L)1肿瘤免疫疗法,靶向结合肿瘤细胞和肿瘤浸润免疫细胞上表达的一种名为PD-L1的蛋白,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,Tecentriq可以激活T细胞,该药有潜力作为癌症免疫疗法、靶向药物和各种癌症化疗方案的基础配伍疗法。
截至目前,Tecentriq在美国、欧盟及世界其他国家批准,作为单药疗法、以及联合靶向疗法和/或化疗,治疗多种类型的非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)、某些类型的转移性尿路上皮癌(mUC)、PD-L1阳性转移性三阴性乳腺癌(mTNBC)、肝细胞癌(HCC)。在美国,Tecentriq还被批准联合Cotellic(cobimetinib)和Zelboraf(vemurafenib)治疗BRAF V600突变阳性的晚期黑色素瘤。
罗氏为Tecentriq制定了广泛的开发计划,包括多项正在进行和计划进行的III期研究,涉及多种类型的肺癌、泌尿生殖系统癌、皮肤癌、乳腺癌、胃肠道癌、妇科癌和头颈癌。这包括Tecentriq单独用药或与其他药物联合治疗的研究。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->