解决疾病根源!Alnylam第三款RNAi疗法lumasiran美欧进入审查,治疗原发性高草酸尿症1型(PH1)
来源:本站原创 2020-05-27 15:01
目前,肝移植是唯一解决PN1疾病根源的治疗方法,lumasiran可解决PH1内在的病理生理学根源,是第一种显著减少尿草酸排泄量的疗法。

2020年05月27日讯 /生物谷BIOON/ --Alnylam制药公司是RNAi疗法开发领域的全球领导者,其药物Onpattro(patisiran,静脉制剂)于2018年8月获批,成为RNAi现象被发现整整20年以来获准上市的首款RNAi药物。2019年11月,其药物Givlaari(givosiran,皮下制剂)获批,成为全球获批的第二款RNAi药物,同时也是GalNAc偶联RNA疗法的全球首次批准,标志着精密基因药物开发的一个重大里程碑。
近日,Alnylam公司宣布,美国食品和药物管理局(FDA)已受理另一款RNAi药物lumasiran治疗原发性高草酸尿症1型(PH1)的新药申请(NDA),同时授予了优先审查资格。优先审查授予能够在治疗、预防或诊断严重疾病方面提供重大改进的药物。优先审查意味着,FDA将在6个月内作出审查决定,而标准审查时间是10个月。FDA已指定《处方药用户收费法(PDUFA)》目标日期为2020年12月3日,并且FDA还表示目前没有计划召开咨询委员会会议作为NDA审查的一部分。
此外,欧洲药品管理局(EMA)也受理了lumasiran的营销授权申请(MAA)。此前,EMA已授予lumasiran加速评估资格。加速评估授予被认为具有重大公共卫生利益和治疗创新的药物。一旦MAA提交和受理,加速评估可提供从210天缩短至150天的审查时间表。
原发性高草尿酸症1型(PH1)是一种进行性、毁灭性的疾病,而肝移植是目前唯一解决疾病根源的治疗方法。在美国,lumasiran已被FDA授予治疗PH1的儿科罕见病资格、孤儿药资格(ODD)、突破性药物资格(BTD)。在欧盟,lumasiran已被授予孤儿药资格(ODD)、优先药物资格(PRIME)。这些资格认定,共同强调了lumasiran解决PH1潜在病理生理学问题的潜力。
PH1是一种非常罕见的、危及生命的疾病,影响肾脏和其他重要器官,该病影响婴儿、儿童和成人,患者面临着反复和痛苦的结石事件,以及肾功能进行性和不可预测的下降,最终导致终末期肾病,需要进行强化透析,作为肝/肾双重移植的桥梁。
lumasiran是第一种显示出显著减少尿草酸排泄量的潜在疗法。来自III期ILLUMINATE-A研究(NCT03681184)的结果表明,lumasiran显著减少了肝脏中草酸的生成,可能解决PH1的内在病理生理学问题。如果获批上市,lumasiran将对PH1患者产生有意义的临床影响。
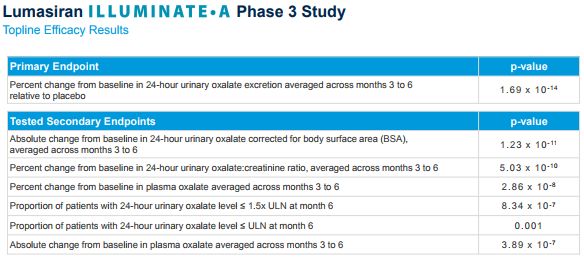
ILLUMINATE-A是一项随机、双盲、安慰剂对照试验,在全球八个国家16个临床中心入组了30例年龄≥6岁的PH1患者,这是在PH1群体中开展的最大规模的介入研究。研究中,患者以2:1的比例被随机分配,接受lumasiran或安慰剂治疗。lumasiran按3mg/kg剂量给药,每月一次治疗3个月,然后按每季度一次维持剂量。主要终点是,与安慰剂组相比,lumasiran治疗组在第3至6个月期间24小时尿草酸排泄量与基线相比的百分比变化。
结果显示,研究达到了主要终点(p<0.0001)。此外,该研究在全部6个分层测试的次要终点方面也取得了统计学上显著的结果(p<或=0.001),包括与安慰剂组相比lumasiran治疗组患者达到尿草酸水平接近正常化或达到正常化的患者比例。研究中,没有发生严重的不良事件,lumasiran显示出令人鼓舞的安全性和耐受性,总体情况与I/II期和开放标签扩展研究中观察到的一致。研究的完整结果计划在目前定于2020年6月16日在阿姆斯特丹举行的OxalEurope国际会议上公布。

PH1是一种超级罕见病,由过量的草酸生成导致肾衰竭,具有显著的发病率和死亡率,目前尚无批准的治疗方法。PH1通常在儿童期发病,需要立即进行有效的干预,晚期患者除了透析之外别无选择。
lumasiran是一种靶向羟基酸氧化酶1(HAO1)的皮下注射RNAi药物,开发用于原发性高草酸尿症1型(PH1)的治疗。HAO1编码乙醇酸氧化酶(GO)。因此,通过沉默HAO1和消耗GO酶,lumasiran可抑制肝脏中草酸(直接参与PH1病理生理学的代谢物)的产生并使其正常化,从而潜在地阻止PH1疾病的进展。
lumasiran采用了Alnylam公司最新的增强稳定化学ESC-GalNAc共轭技术开发,该技术可使皮下给药具有更强的效力和持久性,并具有一个宽泛的治疗指数。目前,Alnylam公司正在开展另外两项全球性III期研究:(1)ILLUMINATE-B,评估lumasiran治疗年龄<6岁的PH1患者,预计2020年年中获得结果;(2)ILLUMINATE-C,评估lumasiran治疗伴有晚期肾脏病的所有年龄段PH1患者,预计2021年获得结果。(生物谷Bioon.com)
原文出处:Alnylam Announces U.S. Food and Drug Administration Has Granted Priority Review of the Lumasiran New Drug application for the Treatment of Primary Hyperoxaluria Type 1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


