2022年终盘点:阿尔兹海默病研究领域重磅级成果!
来源:生物谷原创 2022-12-27 23:39
本文中,小编对本年度科学家们在阿尔兹海默病研究领域取得的重磅级研究成果进行整理,分享给大家!
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在人类阿尔兹海默病研究领域取得了多项重磅级研究成果,本文中,小编就对本年度科学家们在该研究领域取得的相关研究成果进行整理,分享给大家!
【1】Cell:小胶质细胞利用蛋白SYK清除大脑中的碎片 有助预防阿尔兹海默病等神经退行性疾病
Hannah Ennerfelt,Elizabeth L. Frost,Daniel A. Shapiro, et al. SYK coordinates neuroprotective microglial responses in neurodegenerative disease,Cell (2022) doi:10.1016/j.cell.2022.09.030
许多神经退行性疾病,即由脑细胞功能丧失或死亡导致的疾病,在很大程度上仍然无法治疗。大多数现有的治疗方法仅靶向可能导致神经退行性疾病的多种过程中的一种,这可能无法有效地完全解决疾病症状或进展,如果有的话。但是,如果科学家们利用大脑内在的自我清洁和自我愈合的能力会怎样?大脑自身的免疫系统可能是治疗神经退行性疾病的关键。近日,一篇发表在国际杂志Cell上题为“SYK coordinates neuroprotective microglial responses in neurodegenerative disease“的研究报告中,来自美国弗吉尼亚大学等机构的科学家们通过研究发现了一种可能被利用来帮助大脑的免疫细胞 小胶质细胞或能抵御阿尔茨海默病的蛋白。
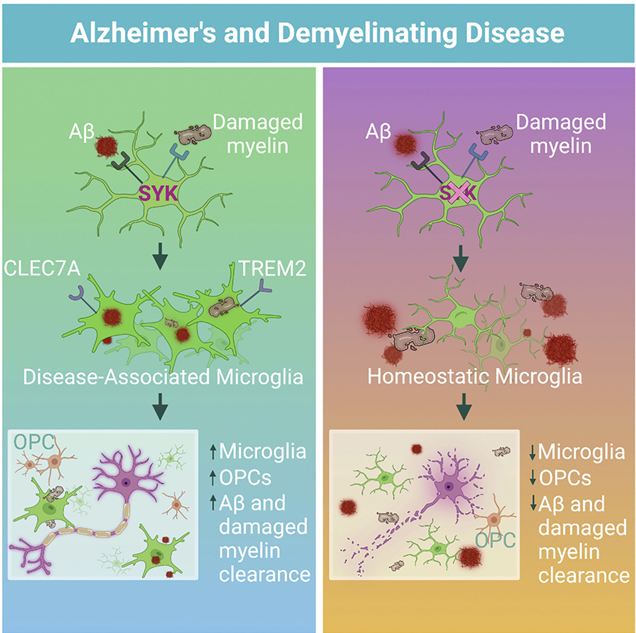
图片来源:Cell, 2022, doi:10.1016/j.cell.2022.09.030。
没有任何可用的针对神经退行性疾病的治疗方法可以阻止正在进行的神经退行性疾病,同时也帮助身体中的受影响区域愈合和恢复。就失败的治疗而言,阿尔茨海默病也许是最臭名昭著的神经退行性疾病。每9名65岁及以上的美国成年人中就有1人受到影响,阿尔茨海默病是由于大脑萎缩、神经元死亡和它们之间的连接丧失造成的。这些伤亡导致了记忆和认知能力的下降。已有数十亿美元被用于研究阿尔茨海默病的治疗方法,但迄今为止,几乎所有测试的药物都在临床试验中失败。
另一种需要改进治疗方案的常见神经退行性疾病是多发性硬化症。这种自身免疫性疾病是由免疫细胞攻击神经元上的保护层(称为髓鞘)引起的。髓鞘的退化导致神经元之间的沟通困难,以及它们与身体其他部分的连接出现缺陷。目前的治疗方法抑制了免疫系统,并可能产生潜在的削弱性副作用。许多这些治疗方案未能解决积累在神经系统中可能会杀死细胞的髓鞘碎片的毒性作用。
【2】Nat Med:识别出能帮助开发新型阿尔兹海默病疗法的最佳血液检测手段
Nicholas J Ashton,Shorena Janelidze,Niklas Mattsson-Carlgren,et al. Differential roles of Aβ42/40,p-tau231 and p-tau217 for Alzheimer's trial selection and disease monitoring,Nature Medicine (2022). DOI: 10.1038/s41591-022-02074-w
阿尔兹海默病病理学表现的血液生物标志物在临床前和疾病的症状期都会发生改变,独特的生物标志物或许是识别阿尔兹海默病病理学或监测疾病进展的最佳手段;在疾病发生过程中,与认知和大脑萎缩变化相关的血液生物标志物或许能在临床试验中被使用从而来识别成功的干预措施,并加速科学家们开发有效的疗法,当疾病修饰疗法被批准进行使用时,基于血液的有效生物标志物或许就能帮助指导疗法的实施并在临床实践中进一步管理。
近日,一篇发表在国际杂志Nature Medicine上题为“Differential roles of Aβ42/40, p-tau231 and p-tau217 for Alzheimer's trial selection and disease monitoring”的研究报告中,来自瑞典隆德大学等机构的科学家们通过研究识别出了哪些血液检测手段能在疾病最早期阶段最佳地帮助检测阿尔兹海默病,以及哪种血液检测手段最能检测相应的治疗效果,相关研究结果或能帮助加速开发新型疗法来减缓人类阿尔兹海默病的进展。
文章中,研究人员对来自BioFINDER队列研究中的575名个体进行研究,分析了检测阿尔兹海默病病理学表现和神经变性的多种新开发的血液检测技术,在242名参与者中,研究人员进行了长达6年的血浆测试,同时还进行了认知测试以及磁共振成像分析。研究人员揭示了名为磷酸-tau231和Aβ42/40的多种血液生物标志物,其足以帮助识别阿尔兹海默病的病理学表现,即使在没有疾病症状的参与者中,其或许也能作为一种策略来选择正确的个体进行这种新型的疾病修饰试验,而这项测试目前需要昂贵的分子成像技术或腰椎穿刺来完成。
【3】Nat Genet:对全球3万多名个体进行研究识别出人类新型阿尔兹海默病致病基因
Henne Holstege,Marc Hulsman,Camille Charbonnier,et al. Exome sequencing identifies rare damaging variants in ATP8B4 and ABCA1 as risk factors for Alzheimer's disease,Nature Genetics (2022). DOI:10.1038/s41588-022-01208-7
阿尔兹海默病是诱发人类痴呆症的主要原因,其遗传率能达到70%左右,阿尔兹海默病的遗传组分能利用全基因组关联性研究进行评估,但这并不能捕捉到因罕见突变所促进的疾病风险。近日,一篇发表在国际杂志Nature Genetics上题为“Exome sequencing identifies rare damaging variants in ATP8B4 and ABCA1 as risk factors for Alzheimer's disease”的研究报告中,来自卡迪夫大学等机构的科学家们通过研究发现了两个新型基因或许会增加个体患痴呆症的风险。
文章中,研究人员比较了来自阿尔兹海默病患者和健康个体机体中3.2万个遗传代码,结果在这些基因中发现了多个新型基因和特定突变或许会导致阿尔兹海默病的发生,此外他们还在这些基因中发现了名为ATP8B4和ABCA1的罕见损伤性遗传性位点,其或许会导致机体患阿尔兹海默病的风险增加,同时研究人员在另外一个名为ADAM10的基因中发现了遗传突变的相关证据。
研究者Julie Williams教授说道,本文研究结果或能帮助我们指向大脑中非常特殊的处理过程,其中包括大脑免疫系统的差异以及大脑如何加工处理机体胆固醇,这些差异或许会影响大脑的功能并导致机体阿尔兹海默病的发生。阿尔兹海默病是英国最常见的一种痴呆症形式,据估计,有60%-80%的阿尔兹海默病风险都能通过遗传因素来解释,对于早发性阿尔兹海默病(低于65岁)患者而言,这一比例或许会增加90%以上。
【4】Cell:女性为何更易患阿尔兹海默病?人类的发病风险或与X染色体密切相关!
Yan Yan,Xinming Wang,Dale Chaput,et al. X-linked ubiquitin-specific peptidase 11 increases tauopathy vulnerability in women, Cell (2022). DOI:10.1016/j.cell.2022.09.002
对小鼠和人类大脑组织进行研究表明,或许存在一种特殊机制能解释阿尔兹海默病基于性别的差异,包括为何女性更易于患阿尔兹海默病。近日,一篇发表在国际杂志Cell上题为“X-linked ubiquitin-specific peptidase 11 increases tauopathy vulnerability in women”的研究报告中,来自凯斯西储大学等机构的科学家们通过研究表明,相比男性而言,女性大脑中名为泛素-特异性肽酶11(USP11,ubiquitin-specific peptidase 11)的X染色体连锁酶类的表达水平会更高,这或许就会导致tau蛋白在大脑中的积累水平更高。
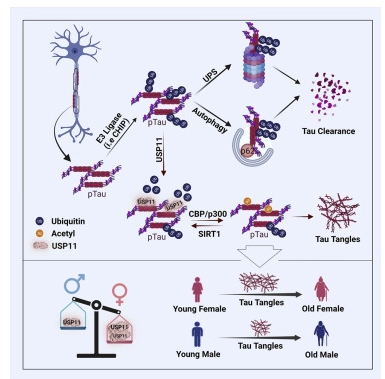
女性为何更易患阿尔兹海默病?人类的发病风险或与X染色体密切相关。
图片来源:Cell (2022). DOI:10.1016/j.cell.2022.09.002
本文研究中,研究人员建立了一种框架来识别能增加女性对tau蛋白病(tauopathy)易感性的其它X连锁因子。研究者表示,女性患阿尔兹海默病的频率大约是男性的两倍,这种易感性增加背后的机制,目前研究人员尚不清楚,一种潜在的解释就是女性大脑中会表现出高水平的tau蛋白积累。
消除过多tau蛋白的过程始于向tau蛋白添加上一种名为泛素的化学标签,由于这一过程的功能异常会导致tau蛋白的异常积累,因此研究者Kang等人就想研究寻找,通过增加或移除泛素化标签是否能增加这种酶系统的活性。研究者发现,雌性小鼠和人类在大脑中会天然表达高水平的USP11,而且USP11水平也与雌性(并非雄性)大脑的tau病变存在着强相关性,此外,当研究人员从大脑tau病变的小鼠模型机体中遗传性地剔除USP11后,雌性动物就会优先受到保护而免于tau病变以及大脑的认知损伤;雄性动物也能被保护抵御大脑中的tau病变,但几乎并未达到雌性的程度。
【5】Mol Psych:新型治疗性靶点或能帮助监测阿尔兹海默病患者的疾病进展
Urayama, A.,Moreno-Gonzalez, I.,Morales-Scheihing,D. et al. Preventive and therapeutic reduction of amyloid deposition and behavioral impairments in a model of Alzheimer’s disease by whole blood exchange. Mol Psychiatry (2022). doi:10.1038/s41380-022-01679-4
阿尔兹海默病是老年人群痴呆症的主要形式,阿尔兹海默病患者机体的主要神经病理学改变就是神经元的死亡、突触改变、大脑炎症以及淀粉样斑块形式和神经原纤维缠结形式的大脑蛋白聚集物的存在,有令人信服的研究证据表明,β淀粉样蛋白(Aβ)的错误折叠、聚集和大脑沉积或许在阿尔兹海默病发病过程中扮演着重要角色,因此,预防和移除错误折叠的蛋白质沉积物或许被认为是一种有望治疗该病的潜在策略。
近日,一篇发表在国际杂志Molecular Psychiatry上题为“Preventive and therapeutic reduction of amyloid deposition and behavioral impairments in a model of Alzheimer's disease by whole blood exchange”的研究报告中,来自德克萨斯大学健康科学中心等机构的科学家们通过研究识别出了一种潜在的非侵入性疗法来检测阿尔兹海默病患者疾病的进展。在临床前模型中,研究人员设法减少患者大脑中毒性蛋白质的水平,其在大脑中的沉积是导致阿尔兹海默病患者神经元死亡的主要原因。
据研究者介绍,这些蛋白质也存在于患者的血液中,血液中该蛋白质的水平能与大脑处于平衡状态,如果其在大脑中的水平上升的话,其在血液中的水平也会上升,反之亦然。基于本文研究结果,研究人员提出,移除这些毒性蛋白沉积物或许能作为开发新型阿尔兹海默病疗法的潜在靶点。研究者Moreno说道,从大脑中移除这种毒性蛋白或许是科学家们开发治疗阿尔兹海默病的主要靶点。
【6】Nat Aging:揭示RNA剪接缺陷诱发人类阿尔兹海默病的分子机制
Chen, PC.,Han, X., Shaw,T.I. et al. Alzheimer’s disease-associated U1 snRNP splicing dysfunction causes neuronal hyperexcitability and cognitive impairment. Nat Aging (2022). doi:10.1038/s43587-022-00290-0
几十年来,科学家们一直对人类神经变性疾病阿尔兹海默病的发病机制感到困惑,但目前仍然无法开发出有效阻断或逆转这种疾病对大脑影响效应的新型疗法。
近日,一篇发表在国际杂志Nature Aging上题为“Alzheimer's disease-associated U1 snRNP splicing dysfunction causes neuronal hyperexcitability and cognitive impairment”的研究报告中,来自美国圣犹大儿童研究医院等机构的科学家们通过研究开发了一种新型小鼠模型,相比此前模型而言其或能更能模拟出人类的阿尔兹海默病,相关研究或有望帮助揭示诱发阿尔兹海默病的发病机制。文章中,研究人员利用这种新型模型进行研究发现,RNA剪接的缺陷或许会导致阿尔兹海默病的神经变性,RNA剪接是一种特殊过程,其能移除非编码的基因序列并将编码蛋白质的序列连接起来。
研究者Junmin Peng说道,RNA剪接是机体转录和翻译的必要过程,其对于大脑健康尤为重要,因为我们都知道,大脑中拥有比机体中其它器官更多的细胞多样性,而且剪接也被认为是机体产生蛋白质多样性的重要过程。此前研究结果表明,RNA剪接机器中的特殊组分—U1小核内核糖核蛋白(snRNP,U1 small nuclear ribonucleoprotein)或能在阿尔兹海默病个体大脑中产生聚集物,U1 snRNP复合体在RNA剪接过程中是非常必要的。如今,研究人员通过研究发现,U1 snRNP的功能异常或会促进神经变性发生,这或许就为研究阿尔兹海默病的发生提供了新的思路,此外研究者还发现,因U1 snRNP病理变化所导致的RNA剪接功能的异常或许能帮助引发机体的神经变性过程。
【7】Nat Commun:科学家识别出一种特殊的小分子 或能分解引发人类阿尔兹海默病的淀粉样缠结物
Seidler, P.M.,Murray,K.A.,Boyer,D.R. et al. Structure-based discovery of small molecules that disaggregate Alzheimer’s disease tissue derived tau fibrils in vitro. Nat Commun 13, 5451 (2022). doi:10.1038/s41467-022-32951-4
阿尔兹海默病是神经元死亡和大脑萎缩的结果,其与蛋白质tau聚集成为纤维有关;近日,一篇发表在国际杂志Nature Communications上题为“Structure-based discovery of small molecules that disaggregate Alzheimer's disease tissue derived tau fibrils in vitro”的研究报告中,来自加州大学洛杉矶分校等机构的科学家们通过研究使用绿茶中的一种分子识别出了一种其它的分子,或能分解被认为会诱发阿尔兹海默病和类似疾病的大脑中的蛋白缠结。这种名为EGCG的绿茶分子能分解tau纤维,即形成缠结能攻击神经元致其死亡的长条状多层纤维丝。
这篇研究报告中,研究人员描述了EGCG是如何将tau纤维一层一层卡住的,同时他们还揭示了他们如何发现其它能以同样方式发挥作用的分子,这些分子或许能比EGCG更好地成为潜在的候选药物,因为EGCG无法轻易穿过大脑,这一研究发现或有望帮助研究人员开发新型药物来靶向作用tau纤维和其它淀粉样纤维的结构,从而治疗阿尔兹海默病、帕金森疾病和相关的疾病等。
数以千计的J形tau蛋白分子层能结合在一起构成被称之为缠结的淀粉样纤维,这是一个世纪前德国科学家Alois Alzheimer在一个痴呆症患者死亡后的大脑中首次观察到的结构,这些纤维能够生长并在大脑中扩散,同时还会杀死神经元并诱导大脑萎缩,很多科学家都认为移除或破坏tau纤维或能减缓痴呆症的进展。研究者David Eisenberg说道,如果我们能分解这些纤维,我们或许就能阻断神经元的死亡,工业界在这一方面通常是失败的,因为其主要会使用难以进入大脑的大分子抗体,几十年来,科学家们都知道,绿茶中名为EGCG的分子能分解淀粉样纤维,这就是我们的工作与其它工作的不同之处。
【8】Science:新研究揭示阿尔茨海默病和进行性核上性麻痹的多个新风险基因
YONATAN A. COOPER,NOAM TEYSSIER,NINA M. DRAGER,et al. Functional regulatory variants implicate distinct transcriptional networks in dementia. Science,2022,doi:10.1126/science.abi8654.
近日,一篇发表在国际杂志Science上题为“Functional regulatory variants implicate distinct transcriptional networks in dementia“的研究报告中,来自美国加州大学洛杉矶分校等机构的科学家们通过使用允许组合使用在一种实验中大规模筛选基因变异的新测试方法,确定了阿尔茨海默病和一种罕见的相关大脑疾病---进行性核上性麻痹(progressive supranuclear palsy, PSP)---的多个新风险基因。这项新的研究还提出了一种修订后的新模型,显示常见的基因变异虽然单独对疾病的影响很小,但一起可能通过破坏整个基因组的特定转录程序而提高疾病的风险。
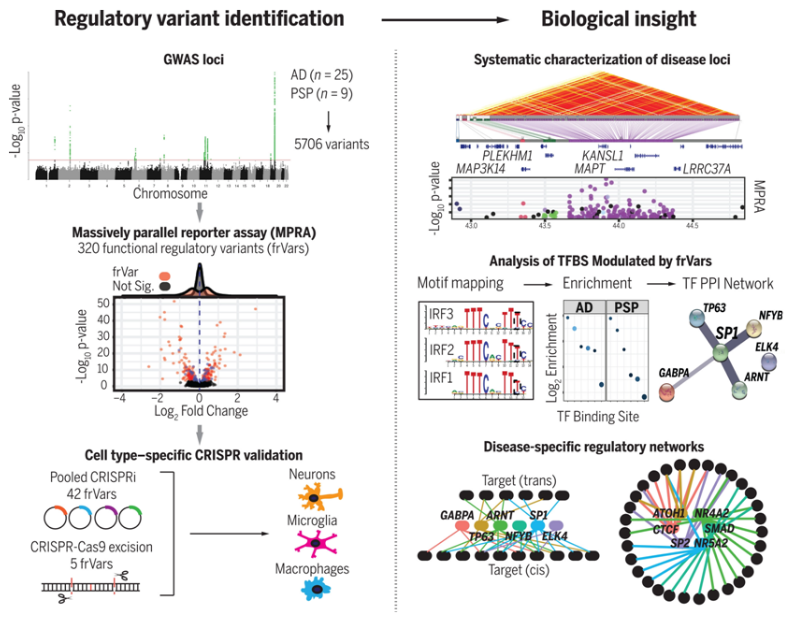
大规模并行的功能基因组学确定了痴呆症中的基因和机制。
图片来源:Science, 2022, doi:10.1126/science.abi8654。
通常情况下,科学家们凭借全基因组关联研究(GWAS)调查一大群人的基因组,以确定增加疾病风险的基因变异。这是通过测试与疾病相关的染色体或基因座上的标记来完成的。每个基因座平均有几十个---有时是几百个或几千个---共同的遗传标记,这些标记是共同遗传的,与疾病有关,这就使得人们很难确定哪些是真正导致疾病的功能性变异。确定因果变异及其影响的基因是现代遗传学和生物医学的一个主要挑战。这项新的研究为解决这一问题提供了一个有效的路线图。
在这项新的研究中,这些作者进行了已知最早用来研究神经退行性疾病的高通量测试方法之一。他们进行了大规模并行报告基因检测(massively parallel reporter assay, MPRA),同时测试了与阿尔茨海默病相关的25个位点和与PSP相关的9个位点的5706个基因变异。PSP是一种比阿尔茨海默病更罕见的神经系统疾病,但有类似的病理特征。
【9】Alzhe & Demen:科学家开发出一种利用血液分析来诊断阿尔兹海默病的新方法
Jijing Wang,Cong Guo,Zhaowei Meng,et al. Testing the link between isoaspartate and Alzheimer's disease etiology,Alzheimer's & Dementia (2022). DOI:10.1002/alz.12735
异天冬氨酸(isoAsp,Isoaspartate)是机体蛋白质中由于自发脱酰胺作用而形成的一种损伤性的氨基酸残基,其能破坏蛋白质的结构使其更易于聚集。
近日,一篇发表在国际杂志Alzheimer's & Dementia上题为“Testing the link between isoaspartate and Alzheimer's disease etiology”的研究报告中,来自瑞典卡罗琳学院等机构的科学家们通过研究,利用蛋白质组学和其它先进的分子生物学工具发现了一种能通过血液分析从而诊断阿尔兹海默病的新方法,其或能帮助揭开疾病发生的潜在原因并预防疾病的发生。
当我们变老时,机体内的蛋白质也会衰老,包括机体中诸如白蛋白(albumin)等长寿蛋白,蛋白质衰老的主要表现之一就是氨(ammonia)的缺失,即所谓的脱酰胺基作用(deamidation),随着脱酰胺基产物的积累,蛋白质分子就会失去其结构、功能和溶解度并开始聚集。
【10】Nat Neurosci:通过重编程大脑中的小胶质细胞来实现治疗阿尔兹海默病的目的
Drager,N.M.,Sattler,S.M.,Huang,C.TL. et al. A CRISPRi/a platform in human iPSC-derived microglia uncovers regulators of disease states. Nat Neurosci (2022). doi:10.1038/s41593-022-01131-4
如今研究人员越来越发现,小胶质细胞正在成为引起人类神经性疾病的关键驱动因素,然而,科学家们却缺乏对其背后分子机制的系统性理解。近日,一篇发表在国际杂志Nature Neuroscience上题为“A CRISPRi/a platform in human iPSC-derived microglia uncovers regulators of disease states”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,揭示如何将受损的大脑细胞从疾病状态转变为健康状态或许有望帮助研究人员开发治疗阿尔兹海默病和其它形式痴呆症的新型疗法。
这篇研究报告中,研究人员重点对小胶质细胞进行了研究,其能够通过清除受损的神经元以及与痴呆症和其它大脑疾病通常相关的蛋白质斑块来稳定大脑功能。研究者Martin Kampmann博士说道,尽管小胶质细胞的变化在阿尔兹海默病和其它大脑疾病中扮演着重要角色,但对这些细胞的理解仍然不够充分。如今,研究人员利用一种开发的新型CRISPR技术就能揭示如何真正控制这些小胶质细胞,让其停止进行有毒性的活动并回归到发挥其关键的清洁作用的角色上,这种能力或许就能提供一定的机会来帮助研究人员开发新型的疾病疗法。
大多数已知会增加阿尔兹海默病风险的基因都能通过小胶质细胞发挥作用,因此,这些细胞对于此类神经变性疾病的发展或许有着重大的影响。小胶质细胞能充当大脑的免疫系统,普通的免疫细胞并不能跨越血脑屏障,因此健康的小胶质细胞的任务就是清除废物和毒物,并保持神经元的最佳功能,当小胶质细胞开始迷失方向时,其结果可能是大脑的炎症和对神经元及其所形成的网络的损害。
比如,在某些情况下,小胶质细胞就会开始移除神经元之间的突触,虽然这在一个人的童年和青少年时期是大脑发育的正常部分,但其或许会对成年人的大脑产生灾难性的影响。在过去5年左右的时间里,许多研究都观察并分析了这些不同的小胶质细胞状态,但还没有确定其背后的遗传学特征。于是研究人员就想通过研究识别出到底是哪个基因主要参与了小胶质细胞活动的特殊状态,以及每种状态都是如何被调节的,基于这些知识,他们就能打开或关闭基因,并让一些不听话的细胞回归到正常轨道上去。
【11】Nat Med:新型药物或有望治疗阿尔兹海默病且并不会引起炎性副作用
Jung, H., Lee, S.Y., Lim, S. et al. Anti-inflammatory clearance of amyloid-β by a chimeric Gas6 fusion protein. Nat Med (2022). doi:10.1038/s41591-022-01926-9
Aduhelm是一种能靶向作用β淀粉样蛋白(Aβ)的单克隆抗体,尽管其成为了FDA批准的首个用于治疗阿尔兹海默病的药物,因为其能帮助减少阿尔兹海默病患者大脑中的Aβ负担,然而目前科学家们在其改善机体认知功能的效应上仍然存在一定的争议。此外,大约40%利用这种单克隆抗体治疗的患者都会经历严重的副作用,包括脑水肿(ARIA-E)和出血(ARIA-H)等,这或许和Aβ抗体结合免疫细胞(诸如小胶质细胞和巨噬细胞)的Fc受体时大脑中所产生的炎性反应有关,这些炎性副作用或能通过激活小胶质细胞来引发神经元细胞死亡和突触的消除,甚至还可能会加剧阿尔兹海默病患者的大脑认知损伤,因此,目前基因Aβ的免疫疗法或许会因其产生炎性副作用而存在着弊大于利的内在风险。
为了克服这些困难,近日,一篇发表在国际杂志Nature Medicine上题为“Anti-inflammatory clearance of amyloid-β by a chimeric Gas6 fusion protein”的研究报告中,来自韩国科学技术院等机构的科学家们通过研究开发出了一种名为αAβ-Gas6的新型融合蛋白药物,其或能通过与基于Aβ抗体的免疫疗法完全不同的机制来消除Aβ,在阿尔兹海默病小鼠模型中,αAβ-Gas6不仅能高效移除Aβ,而且还能规避与常规抗体疗法相关的神经毒性炎症副作用。
科学家揭示人类阿尔兹海默病发生的新型关键机制。
图片来源:Cell Stem Cell (2022). DOI:10.1016/j.stem.2022.06.007
研究者Chan Hyuk Kim说道,通过Aβ靶向性抗体所实现的FcR激活或许会诱导小胶质细胞介导的Aβ吞噬作用,但其也会产生一定的炎性信号,从而不可避免地损伤大脑组织。因此,研究人员利用到了吞噬作用,其是一种细胞过程,即死亡的细胞会被吞噬细胞清除从而作为清除大脑中Aβ的可替代途径,吞噬作用会伴随着抗炎性反应从而维持机体组织的平衡,为了利用这一过程,研究人员对Gas6进行工程化改造,其是一种特殊的可溶性适配蛋白,其能通过TAM吞噬受体来介导吞噬作用,其目标特异性会从死亡细胞重新定向到Aβ斑块。
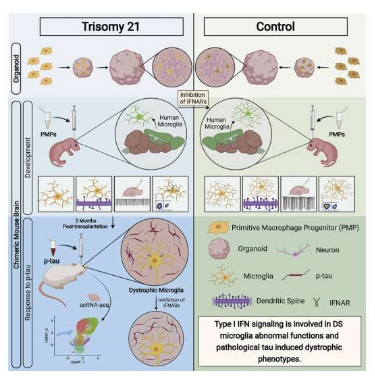
【12】Cell Stem Cell:科学家揭示人类阿尔兹海默病发生的新型关键机制
Mengmeng Jin,Ranjie Xu,Le Wang,et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease,Cell Stem Cell (2022). DOI: 10.1016/j.stem.2022.06.007
小胶质细胞对于大脑的发育和阿尔兹海默病的发病至关重要。近日,一篇发表在国际杂志Cell Stem Cell上题为“Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease”的研究报告中,来自美国罗格斯大学等机构的科学家们通过研究揭示了与阿尔兹海默病相关的破坏性蛋白是如何攻击人类大脑细胞并破坏周围组织的。
在对小鼠大脑中生长的人类脑细胞进行首个此类研究中,研究人员发现了一种关键的机制,其或能作为一种潜在的疾病治疗性靶点,目前这类疾病困扰着全球数百万人的健康,且没有治愈手段。这项研究中,研究人员进行了相关实验,即将人类大脑免疫细胞注射到培育的免疫缺陷小鼠的大脑中,随后创建了人鼠嵌合体,随后他们详细描述了被称之为小胶质细胞的特殊大脑免疫细胞在接触tau蛋白时所发生的情况,这些破坏性的物质被认为参与到了阿尔兹海默病和其它多种人类大脑疾病中。
研究者Peng Jiang说道,这项研究中,我们利用新开发的嵌合体小鼠大脑模型进行研究,其中人类细胞被注射到小鼠大脑中并能生长、发育且能成熟并具有适当的功能,这或许就位调查人类大脑中的小胶质细胞的作用以及阿尔兹海默病和人类唐氏综合征患者所出现的认知损伤提供了新的线索,唐氏综合征是一种具有高风险阿尔兹海默病的人类遗传性疾病。通过研究人鼠大脑嵌合体的过程,科学家们就能见证并分析(通过对不同阶段所提取的样本)截止到目前为止在很大程度上难以捉摸的细胞大脑攻击。
【13】Cell:科学家破解阿尔茨海默病风险基因APOE4之谜
Julia TCW,Lu Qian,Nina H. Pipalia,et al. Cholesterol and matrisome pathways dysregulated in astrocytes and microglia,Cell (2022) doi:10.1016/j.cell.2022.05.017
阿尔茨海默病(AD)是一种进行性神经退行性疾病,也是痴呆的最常见原因,影响着美国580多万人。科学家们已经发现了一些增加AD发病风险的基因变体;其中对65岁以上的人来说最著名的是APOEε4等位基因。尽管APOE4和AD风险增加之间的关联已经确立,但是在此之前,人类脑细胞类型中导致这种潜在风险的机制还不清楚。近日,一篇发表在国际杂志Cell上题为“Cholesterol and matrisome pathways dysregulated in astrocytes and microglia”的研究报告中,来自波士顿大学等机构的科学家们通过研究发现了该基因的两个重要的新方面:1)APOE4的人类基因背景对APOE4患者来说是独一无二的;2)APOE4导致的机制缺陷对人类细胞来说是独一无二的。
研究者Julia TCW博士表示,我们的研究通过比较人类和小鼠模型,证实了APOE4基因的作用以及人类中哪些脑细胞受到的影响最大。这些发现很重要,因为如果我们了解这种风险基因如何以及在哪里破坏我们的大脑,我们就能找到治疗方法。
为了研究APOE4对脑细胞类型的影响,这些作者使用了三种模型:人类诱导性多能干细胞(hiPSC)、死后人脑和实验模型。他们使用第一种hiPSC模型,比较了AD患者和正常人的APOE4(突变)与APOE4(无突变)。对于第二种模型,他们将AD患者的大脑与具有不同APOE基因型的对照大脑进行比较。对于第三种模型,他们使用了一种携带人类APOE基因的实验模型。有了所有这些模型,他们使用了基因筛选和RNA测序来确定APOE4导致的人类细胞类型的特定缺陷。
【14】Sci Transl Med:烟酸有望延缓阿尔茨海默病进展
MIGUEL MOUTINHO,SHWETA S. PUNTAMBEKAR,ANDY P. TSAI,et al. The niacin receptor HCAR2 modulates microglial response and limits disease progression in a mouse model of Alzheimer's disease. Science Translational Medicine,2022,doi:10.1126/scitranslmed.abl7634
近日,一篇发表在国际杂志Science Translational Medicine上题为“The niacin receptor HCAR2 modulates microglial response and limits disease progression in a mouse model of Alzheimer’s disease”的研究报告中,来自美国印第安纳大学医学院等机构的科学家们通过研究分析了烟酸(niacin)如何在阿尔茨海默病动物模型中调节小胶质细胞对淀粉样蛋白斑(amyloid plaque)的反应。他们发现当在实验室模型中使用时,烟酸限制了阿尔茨海默病进展,这一发现有可能为开发治疗这种疾病的方法铺平道路。
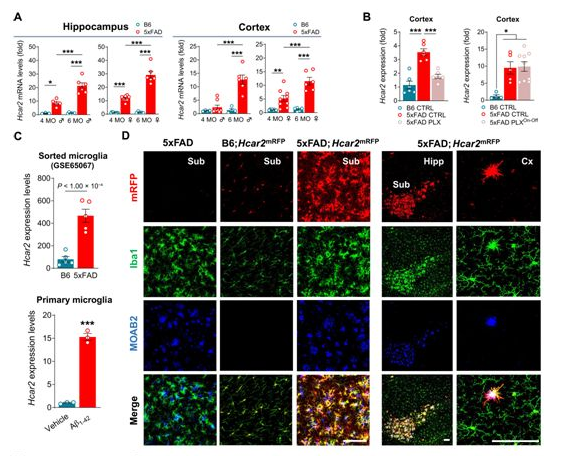
诱导阿尔茨海默病中的小胶质细胞表达HCAR2。
图片来源:Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abl7634。
研究者表示,这项研究为阿尔茨海默病确定了一种潜在的新治疗靶标,它可以通过美国食品药品管理局(FDA)批准的药物进行调节。维持整个身体代谢的烟酸主要通过典型的饮食获得;它也可以作为补充剂和降胆固醇药物服用。然而,Moutinho发现,大脑以一种不同的方式使用烟酸。在大脑中,烟酸与一种高度选择性的受体---HCAR2---相互作用,该受体存在于与淀粉样蛋白斑物理的小胶质细胞中。Landreth说,当烟酸---在这个项目中用作FDA批准的Niaspan药物--激活该受体时,它刺激小胶质细胞的有益行动。
研究者指出,在阿尔茨海默病动物模型接受了烟酸后,它们最终出现了较少的淀粉样蛋白斑,而且它们的认知能力得到了改善。我们直接证实这些行动是由于烟酸作用于HCAR2受体。过去对烟酸和阿尔茨海默病的流行病学研究已表明,饮食中烟酸含量较高的人患这种疾病的风险减少了。烟酸目前也被用于针对帕金森病和胶质母细胞瘤的临床试验中。为了进一步研究烟酸和大脑,Landreth和Moutinho正在与印第安纳大学医学院临床神经病学副教授Jared Brosch博士合作,后者正在申请一项临床试验,旨在研究烟酸和人类大脑的影响。
【15】Sci Rep:鼻腔中存在的特殊细菌或会增加个体患阿尔兹海默病的风险
Chacko, A.,Delbaz, A.,Walkden,H. et al. Chlamydia pneumoniae can infect the central nervous system via the olfactory and trigeminal nerves and contributes to Alzheimer’s disease risk. Sci Rep 12,2759 (2022). doi:10.1038/s41598-022-06749-9
肺炎衣原体(Chlamydia pneumoniae)是一种呼吸道病原体,但其也能感染中枢神经系统,最近研究人员发现,肺炎衣原体中枢神经系统感染和晚发性痴呆症之间的关联变得越来越明显,在小鼠机体中,中枢神经系统感染已经被证明能在鼻腔内接种后数周至数月内发生;近日,一篇发表在国际杂志Scientific Reports上题为“Chlamydia pneumoniae can infect the central nervous system via the olfactory and trigeminal nerves and contributes to Alzheimer’s disease risk”的研究报告中,来自格里菲斯大学等机构的科学家们通过研究发现,一种普遍存在于鼻腔中的细菌(肺炎衣原体)或能潜入大脑中并引发一系列导致阿尔兹海默病的事件。文章中,研究人员发现,肺炎衣原体或能通过鼻腔中的神经来侵入大脑中。
尽管肺炎衣原体经常会引起呼吸道感染,但其在大脑中也会被发现,这或许就提出了问题,即是否其也会引发宿主机体中枢神经系统的损伤。随后研究人员在动物模型中进行了一系列广泛的研究,不仅揭示了肺炎衣原体是如何进入宿主大脑的,也阐明了其如何导致阿尔兹海默病病理学表现。研究者Ekberg教授说道,此前我们通过研究发现,多种不同种类的细菌能在24小时内迅速通过延伸到鼻腔和大脑之间的外周神经进入中枢神经系统中。
有了这些背景知识,研究人员就能追踪肺炎衣原体是如何偷偷穿过血脑屏障并迅速进入大脑的。最新研究显示,一旦细菌进入了中枢神经系统中,大脑中的细胞就会在几天内通过沉积β淀粉样多肽来做出反应,而β淀粉样多肽是阿尔兹海默病的标志性斑块;几周后,多个已知参与阿尔兹海默病发生的基因通路或许就会被极大地激活。
研究结果指出,当细菌入侵到嗅觉神经时,周围的神经细胞(胶质细胞)就会被感染,这些细胞很有可能是细菌在神经系统内持续存在的原因;这些细胞通常是抵御细菌的重要卫士,但在这种情况下其会被感染并能帮助细菌扩散;长期以来研究人员怀疑,细菌(甚至病毒)会导致机体的神经性炎症并促进阿尔兹海默病的启动,然而,仅仅是细菌或许还并不足以导致某些个体患病,或许其需要遗传易感性外加细菌的组合才能够导致阿尔兹海默病的发生。(生物谷Bioon.com)
生物谷2022年终盘点正在进行!更多精彩盘点敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


