2021年终盘点:阿尔兹海默病研究领域重磅级成果!
来源:本站原创 2021-01-02 18:07
时至岁末,转眼间2021年已经接近尾声,迎接我们的将是崭新的2022年,在即将过去的2021年里,科学家们在人类阿尔兹海默病研究领域获得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理回顾。
时至岁末,转眼间2021年已经接近尾声,迎接我们的将是崭新的2022年,在即将过去的2021年里,科学家们在人类阿尔兹海默病研究领域获得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!

功能异常的脑细胞或能作为开发新型阿尔兹海默病疗法的潜在靶点。
图片来源:Wake Forest School of Medicine
【1】Nat Aging:功能异常的脑细胞或能作为开发新型阿尔兹海默病疗法的潜在靶点!
doi:10.1038/s43587-021-00142-3
在动物模型中,衰老细胞会导致病理学和机体功能异常,其稀疏地分布和异质性表型给其在人类组织中的检测带来了一定的挑战。近日,一篇发表在国际杂志Nature Aging上题为“Profiling senescent cells in human brains reveals neurons with CDKN2D/p19 and tau neuropathology”的研究报告中,来自德克萨斯大学圣安东尼奥分校等机构的科学家们通过研究在人类大脑中识别出了一类罕见的潜在毒性衰老细胞群,其或能作为一种新型靶点来帮助开发新型阿尔兹海默病疗法。
衰老细胞是一类老弱病残的细胞类型,其无法正确地进行自我修复,也并不会在该死亡的时候死亡;相反,其表现出了一定的功能异常,并能释放特殊物质来杀灭周围健康的细胞及引发炎症;随着时间延续,衰老细胞就会在机体的组织中堆积,并导致衰老过程、神经认知能力下降及癌症发生等。2018年研究人员就发现,衰老细胞会在阿尔兹海默病小鼠模型机体中积累,并诱发小鼠发生大脑细胞缺失、炎症和记忆损伤等;当研究人员利用一种疗法来清除衰老细胞时就会抑制疾病的进展和细胞死亡。
研究者Orr说道,然而直到现在,我们并不知道衰老细胞在人类大脑中到底会积累到什么程度,以及其实际上是什么样子;这就有点像大海捞针了,只是哦们不确定针到底长什么样儿。利用复杂的统计学分析工具,研究人员就能评估大量的数据;他们共从因阿尔兹海默病身故的患者的大脑中分析了数以万计的细胞,首先研究人员确定了患者的大脑中是否存在衰老细胞,以及衰老细胞的数量到底有多少,其都是什么类型的细胞等。
【2】Cell:科学家成功设计出一种新型的毒蕈碱M1受体激动剂 有望潜在治疗阿尔兹海默病
doi:10.1016/j.cell.2021.11.001
目前治疗阿尔兹海默病的方法是通过抑制乙酰胆碱酯酶来预防乙酰胆碱的分解,从而有效纠正有缺陷的胆碱能的传递,然而这些方法的临床疗效非常有限;另一种方法就是直接激活负责学习和记忆的胆碱能受体,M1-毒蕈碱乙酰胆碱(M1,M1-muscarinic acetylcholine)受体就是首选的靶点,但其应用一直受到了不良负面作用的阻碍。近日,一篇发表在国际杂志Cell上题为“From structure to clinic: Design of a muscarinic M1 receptor agonist with potential to treatment of Alzheimer’s disease”的研究报告中,来自格拉斯哥大学等机构的科学家们通过研究取得了从实验室到床边的突破性发现,他们希望相关研究结果能推动开发治疗阿尔兹海默病患者的新型疗法。
这篇研究报告中,研究人员首次描述了设计一种新型分子的过程,在实验室临床前和人类临床研究中,这种分子能选择性地靶向作用大脑中的特殊受体蛋白,这种新方法或许展现出了在开发新型药物来改善阿尔兹海默病患者大脑认知功能方面的潜力。目前并没有任何药物能组织或减缓阿尔兹海默病的进展,然而有一些药物却能恢复早期痴呆症患者的记忆缺失并改善其认知功能,但这些药物通常并不有效,而且还会产生一定的副作用,这或许就限制了其在临床实践中的应用。
研究人员重点关注的这种分子能选择性靶向作用大脑中名为M1-毒蕈碱乙酰胆碱受体(M1受体)的受体分子,其在机体记忆和认知功能发挥过程中扮演着重要角色,随后的转化医学研究检测了一种假设,即诸如此类分子是否能保留认知效益并缺乏剂量限制的副作用。通过密切合作后,研究人员表示,尽管M1受体与其它类型的毒蕈碱受体非常相似,但利用对M1受体3D结构的详细理解,他们有望成功设计出一种选择性极强的调节自,这种方法称之为基于结构的药物设计或SBDD。
【3】Sci Adv:剔除ABI3基因或会增加个体患阿尔兹海默病的风险
doi:10.1126/sciadv.abe3954
当机体免疫细胞在整个大脑中移动时,其能作为第一道防线来抵御病毒、毒性物质和受损的神经元,并将其从体内清除。近日,一篇发表在国际杂志Science Advances上题为“Deletion of Abi3 gene locus exacerbates neuropathological features of Alzheimer's disease in a mouse model of Aβ amyloidosis”的研究报告中,来自印第安纳大学医学院等机构的科学家们通过研究揭示了大脑中名为小胶质细胞的免疫细胞如何与最近在阿尔兹海默病患者体内发现的基因突变相关联的,文章中,研究者发现,剔除名为ABI3的基因或能明显增加大脑中β淀粉样斑块的积累,并减少斑块周围小胶质细胞的水平。
研究者Karahan表示,本文研究或能帮助科学家们进一步理解促进疾病发生的小胶质细胞的关键功能,同时还能帮助识别新型治疗靶点;本文中研究人员对超过8.5万名携带ABI3基因突变的个体(其中不到一半的个体为阿尔兹海默病患者)进行了一项人类遗传学研究,这种突变会增加个体患晚期阿尔兹海默病的风险。目前研究人员并没有在大脑中调查ABI3基因的功能或者该基因如何影响小胶质细胞的功能,这项研究中,研究人员从阿尔兹海默病小鼠模型中剔除了ABI3基因,并在细胞培养物中检测了该基因在小胶质细胞中的功能;在小鼠模型中,他们观察到大脑中斑块和炎症水平的增加以及突触功能异常的迹象,这些特征与该疾病患者的学习和记忆功能缺陷相关。
此外,研究者表示,该基因的剔除会损伤小胶质细胞的移动,免疫细胞无法靠近斑块从而来尝试清除蛋白,淀粉样斑块通常存在于阿尔兹海默病患者的大脑中,而β淀粉样蛋白则会聚集并形成斑块,从而就能破坏神经细胞的连接。研究者指出,本文研究提供了首次功能性证据表明,ABI3基因功能的缺失或会通过影响β淀粉样蛋白的积累和神经炎症的发生从而就会增加个体患阿尔兹海默病的风险。在过去几十年里,研究者Karahan一直从事阿尔兹海默病的研究,他们获得了多项基金用于开展相关的研究;其中有一项基金就是帮助研究人员开发新型小鼠模型,从而就能使得他们实现在机体中的任何细胞类型中剔除ABI3基因,比如大脑小胶质细胞和外周免疫细胞等;一旦研究者证实了这种新型模型,他们就会将这种模型分享给其他研究人员进行其它类型的研究。
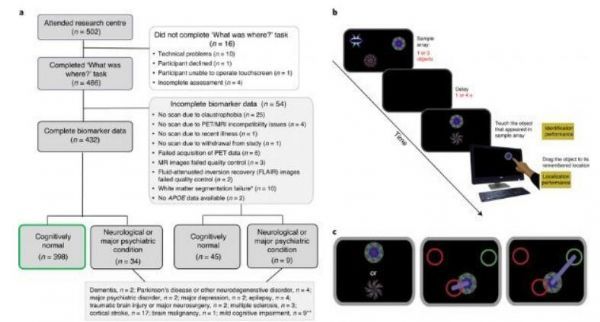
研究设计,数据采集流程图和缺失数据的原因。
图片来源:Lu, K., et al. Nat Aging (2021).doi:10.1038/s43587-021-00117-4
【4】Nat Aging:主要的阿尔兹海默病风险基因APOE4或与老年人群更好的视觉工作记忆密切相关!
doi:10.1038/s43587-021-00117-4
尽管APOE ε4携带者患阿尔兹海默病的风险远远高于非携带者,但有争议的证据显示,APOE ε4或许会赋予携带者一些优势,这或许就能解释这一基因的生存特性,即拮抗基因多效性(antagonistic pleiotropy),近日,一篇发表在国际杂志Nature Aging上题为“Dissociable effects of APOE ε4 and β-amyloid pathology on visual working memory”的研究报告中,来自伦敦大学学院等机构的科学家们通过研究发现,一种众所周知能增加机体患阿尔兹海默病风险的基因APOE4或与老年人更好的视觉工作记忆之间存在一定关联。
文章中,研究人员对在1946年同一周出生的一组志愿者进行了相关研究,研究者Jonathan Schott说道,长期以来我们就知道,APOE4风险基因会增加机体患阿尔兹海默病的风险,但其背后的分子机制科学家们并不清楚。这篇研究报告中,我们对这组特殊的志愿者进行研究,结果发现,携带APOE4基因或与机体更好的视觉记忆有关,这或许就为阐明为何该基因突变体如此普遍提供了新的线索;理解为何APOE4会导致机体更好的记忆或许能帮助研究人员理解其增加机体患阿尔兹海默病风险的机制。
机体的DNA代码是机体生物学特性的蓝图,其拥有制造特定蛋白所需要的信息,这些蛋白质能帮助机体正常发挥功能;有时DNA代码中或会含有增加机体患某种疾病可能性的改变;然而迄今为止,科学家们发现了至少30个不同的基因或与机体患阿尔兹海默病风险的改变有关,阿尔兹海默病是一种最常见的痴呆症。而对阿尔兹海默病风险影响最大的被研究的基因名为APOE,每个人都拥有两个APOE基因拷贝,而每个拷贝可以有三种形式,即E2、E3和E4,遗传了一个APOE E4拷贝(大约为四分之一的人群)的个体与没有改基因版本的个体相比,患阿尔兹海默病的风险要高出三倍左右,而有两个该基因拷贝的个体的患病风险则可能会超过八倍。
【5】Sci Adv:科学家开发出一种有望对阿尔兹海默病实现可靠诊断的新型血液检测技术
doi:10.1126/sciadv.abj2137
量化血液中涉及阿尔兹海默病(AD)的蛋白质聚集物的物理性差异或能为提示疾病阶段提供关键的信息;如果一个人怀疑自己身患阿尔兹海默病,那么其就必须为漫长而复杂的治疗性步骤做好准备,直至病情变得明朗;近日,一篇发表在国际杂志Science Advances上题为“Spatial organization of protein aggregates on red blood cells as physical biomarkers of Alzheimer's disease pathology”的研究报告中,来自瑞士联邦材料科学与技术研究所等机构的科学家们通过研究开发了一种新型血液检测技术,其或能利用原子力显微镜(AFM)对疾病进行可靠的诊断。
一开始,物理学家Peter Nirmalraj就想通过研究来理解阿尔兹海默病发生的分子病理学表现,从而开发新型诊断技术和治疗性策略;随后研究者将进一步解析与神经变性疾病相关的β淀粉样蛋白和tau蛋白所扮演的确切性角色,因此,研究者Peter Nirmalraj不仅要检测到可疑蛋白质的存在,而且还要确定其可变的形状、形式以及水平。
目前的方法能帮助研究者确定体液中两种蛋白质的总体水平,然而,这些技术并不允许可视化分析蛋白质聚集物的形状和状况差异;因此,本文研究人员就通过研究开发了这项能在血液中进行纳米级别的观察分析,且不会破坏蛋白质的结构和形态的新型技术。文章中,研究人员联合完成了初步的研究,在其试点研究中,他们分析了来自50名患者和16名健康受试者机体的血液样本,利用AFM技术,研究者在不了解其机体健康状况的情况下,分析了每个人机体大约1000个红细胞的表面,这是确保对数据的解释保持客观性的唯一方法。
【6】Nat Med:大脑组织的炎症或许是阿尔兹海默病进展的关键因素!
doi:10.1038/s41591-021-01456-w
目前有令人信服的研究证据表明,小胶质细胞的激活参与了阿尔兹海默病中tau蛋白缠结在新大脑皮层中的扩散。近日,一篇发表在国际杂志Nature Medicine上题为“Microglial activation and tau propagate jointly across Braak stages”的研究报告中,来自匹兹堡大学医学院等机构的科学家们通过研究发现,神经炎症或许是大脑中病理性错误折叠的蛋白扩散的关键驱动因素,其会导致阿尔兹海默病患者的认知功能障碍发生。
这篇研究中,研究人员有史以来首次在活体患者机体中进行研究,神经炎症,即大脑中常驻的免疫细胞—小胶质细胞的过度激活,其不仅仅是疾病进展的结果,相反,其还是一种关键的上游机制,对于疾病的发展不可或缺。医学博士Tharick Pascoal说道,如今我们注意到许多阿尔兹海默病患者会被忽视,这样其就无法得到适当的护理;而本文研究表明,旨在减少淀粉样斑块形成和限制神经炎症的组合性疗法或许要比单独解决每种病理现象更加有效。
阿尔兹海默病的特点是淀粉样斑块的积累(停留在大脑中神经细胞之间的蛋白质聚集物)和称之为tau缠结的无序蛋白质纤维聚集物在神经细胞内的形成。尽管在培养中的细胞核实验室动物研究中积累了充分的证据来表明,小胶质细胞的激活会驱动阿尔兹海默病tau纤维的扩散,但这一过程目前尚未在人类机体中得到证实。本文研究结果表明,靶向作用神经炎症或许有益于早期阶段的阿尔兹海默病患者,而且还能有助于逆转或至少减缓大脑中病理性tau蛋白的积累并避免痴呆症的发生。
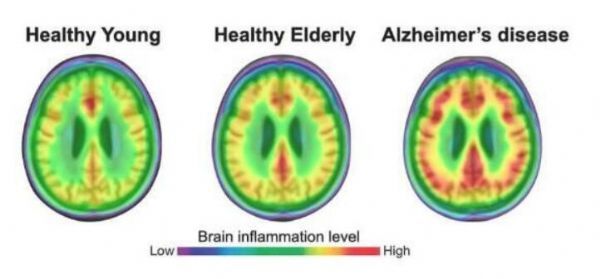
相比阿尔兹海默病患者而言,年轻和老年人群机体中的神经炎性程度较低(红色)。
图片来源:Adapted from Pascoal et al., Nature Medicine.
【7】Nature:恢复“伴侣”蛋白的功能或能预防诸如阿尔兹海默病等神经变性疾病患者机体中毒性斑块的积累
doi:10.1038/s41586-021-03824-5
蛋白质质量控制系统对细胞功能和有机体的健康至关重要,目前大多数已知的蛋白质控制系统都是多组分的机器,其能通过ATP调节的与非原生蛋白质之间的相互作用来发挥作用并防止蛋白质聚集和促进其折叠,很少有系统能通过不同的机制来广泛地促进蛋白质的这些,此外,含有广泛带电的poly-Asp/Glu (聚D/E)区域的蛋白质在真核生物的蛋白质组中很常见,但其生化活性研究人员并不清楚。近日,一篇发表在国际杂志Nature上题为“DAXX represents a new type of protein-folding enabler”的研究报告中,来自宾夕法尼亚大学Perelman医学院等机构的科学家们通过研究首次揭示了恢复蛋白质DAXX和一大群类似蛋白质的水平如何防止已知的能驱动阿尔兹海默病和其它神经变性疾病的“恶劣”蛋白质的错误折叠以及引发癌症的特定突变,相关研究结果或有望帮助开发新型靶向性策略来恢复旨在保持关键蛋白质控制和预防疾病的生物系统的功能和平衡。
本文研究中,研究人员重点对DAXX蛋白进行了研究,其是一种死亡结构域相关蛋白,也是人类蛋白大家族中的一员,每种蛋白质都具有异常高的两个特定氨基酸残疾,即天冬氨酸和谷氨酸,其被称为聚D/E蛋白,DAXX和大约50种其它的聚D/E蛋白质在细胞过程所扮演的多种角色随着时间推移逐渐会被研究人员阐明,但其在蛋白质质量控制系统中的角色(即指导蛋白质折叠的伴侣分子)却是研究人员意料之外的。
研究者Xiaolu Yang教授说道,我们解决了一个长达数十年的研究难题,表明,这组蛋白实际上构成了细胞中一种主要的蛋白质质量控制系统,同时也是一种从未见过的促进多种蛋白质正确折叠的关键因素,包括与多种疾病相关的易折叠蛋白质。正常情况下,蛋白质质量控制系统能保持蛋白质家族的正常运转,但“恶劣”蛋白质的缠结或许就会降低或完全阻断蛋白质家族正常运转的能力。
蛋白质是细胞正常工作的关键组分,为了确保正常的细胞功能并防止与疾病相关的蛋白质发生错误折叠,有机体会进化出一种精心设计的蛋白质质量控制系统来确保蛋白质的有效折叠;然而,这些系统(尤其是在人类机体中)目前并没有被深入研究,这或许就限制了科学家们开发有效疗法的能力。研究者指出,DAXX和其它聚D/E蛋白能促进蛋白质的折叠,逆转蛋白质的聚集,并能展开错误折叠的蛋白质;同时其还能预防神经变性相关的蛋白质发生错误折叠、缠结以及形成细胞外的斑块和胞内包裹体,比如β淀粉样蛋白和α-突触核蛋白等。研究人员在阿尔兹海默病患者的大脑中观察到了神经细胞之间的β淀粉样蛋白聚集现象,同时其还能作为开发多种新型疗法的靶点,而且还在帕金森疾病患者大脑中观察到了α-突触核蛋白的胞内包裹体。
【8】Nat Biomed Eng:重磅!科学家成功开发出了一种有望治疗阿尔兹海默病的新型全脑基因组编辑技术!
doi:10.1038/s41551-021-00759-0
家族性阿尔兹海默病是由编码淀粉样β前体蛋白(app)的基因以及编码早老蛋白1(presenilin 1)和早老蛋白2(presenilin 2)的基因发生显性突变所引发,其病理学特征是在多个大脑区域中出现细胞外淀粉样斑块和细胞内的神经纤维缠结。近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Brain-wide Cas9-mediated cleavage of a gene causing familial Alzheimer’s disease alleviates amyloid-related pathologies in mice”的研究报告中,来自中国香港科技大学等机构的科学家们通过研究利用全脑基因组编辑技术开发出了一种新技术,其或能减少遗传修饰的阿尔兹海默病小鼠模型机体的阿尔兹海默病病理学表现,这项先进的技术或许还具有巨大的潜力,来转化为一种新型的长效策略来治疗阿尔兹海默病患者。
仅在中国,估计就有超过50万名患者患有遗传性阿尔兹海默病,其是一种家族性的阿尔兹海默病,即一种与家族史高度相关的先天性阿尔兹海默病形式,尽管家族性的阿尔兹海默病有着明确的遗传原因,并且能在患者认知问题发生之前被诊断出来,但目前并没有有效的治疗性手段。使用基因组编辑技术作为治疗因遗传性突变所引起的疾病(比如家族性阿尔兹海默病等)的策略有着巨大的应用前景,其对于疾病症状出现之前纠正致病性基因突变非常有用,对于这种情况,这种策略就被认为是一种一劳永逸的治疗性手段,因为其所产生的效果可以持续一生。然而,目前往往存在多个障碍阻碍了这一技术的临床应用和前景,最主要的就是缺乏有效、高效和非侵入性的手段来将基因编辑制剂运输到机体大脑中;此外,当前的基因组编辑技术也无法在整个大脑中产生有益的治疗结果。
这篇研究报告中,研究人员开发了一种新型的基因组编辑技术,其不仅能够跨越血脑品章,还能将优化的基因组编辑工具运输到整个大脑中,利用这种新设计的基因组编辑运输工具,这种新技术就能通过单一无创的静脉注射从而实现高效的全脑基因组编辑,而且这还能有效地破坏阿尔兹海默病小鼠模型中引起家族性阿尔兹海默病的突变,并能够改善整个大脑中阿尔兹海默病的疾病症状,同时还能为后期开发新型治疗性策略提供思路。
【9】Nature:科学家识别出能帮助预防和治疗阿尔兹海默病的特殊信号分子
doi:10.1038/s41586-021-03734-6
胶质细胞生态系统内的交流沟通对于神经元和大脑健康至关重要,目前研究人员并不清楚胶质细胞对阿尔兹海默病个体机体大脑中β-淀粉样蛋白和神经纤维性tau蛋白的积累和清除的影响,尽管这些都是具有治疗意义的相互作用。近日,一篇发表在国际杂志Nature上题为“Astrocytic interleukin-3 programs microglia and limits Alzheimer’s disease”的研究报告中,来自麻省总医院和哈佛医学院等机构的科学家们通过对人类和小鼠进行研究识别出了一种特殊的信号分子,其或能帮助改善机体的炎症和免疫系统功能,从而保护机体抵御阿尔兹海默病。
当神经元开始死亡时,与阿尔兹海默病相关的机体认知功能就会下降,研究者Filip Swirski博士说道,神经元的死亡往往是由不合适的免疫反应和过度的神经性炎症(或大脑炎症)所引发,而这些炎症则是由高水平的β淀粉样蛋白沉积物和tau缠结物所引起,这两种是阿尔兹海默病的主要标志物。一旦神经元开始死亡的越来越多时,被称为小胶质细胞和星形胶质细胞的脑细胞(这两种细胞在正常情况下能帮助清理大脑中的碎片)就会被激活从而引发神经性炎症,从而就会设法保护大脑;这些细胞在进化过程中会被编程为消灭大脑中过度神经元细胞死亡的其余,因为这可能是由感染所引起的,而且必须阻断其蔓延。
在阿尔兹海默病的情况下,由β淀粉样蛋白和tau缠结所引发的神经元细胞死亡会激活这种反应,而随着神经性炎症的发生,细胞死亡的水平至少要比β淀粉样蛋白和tau缠结引发的细胞死亡高10倍;实际上,如果没有神经性炎症的诱导就不会出现痴呆症的症状;研究者表示,他们从“可塑性”大脑中知道了这一点,在这种情况下,个体大脑中就会有很多β淀粉样蛋白和tau缠结,但其在死亡时却没有任何症状,因为其机体的神经性炎症很少或没有。研究者指出,β淀粉样蛋白是点燃tau缠结蔓延的“引子”,但只有通过小胶质细胞和星形胶质细胞所激活的神经性炎症,才会导致越来越多的“森林火灾”,此时机体才会失去足够的神经元并经历认知功能下降和痴呆症的发生。
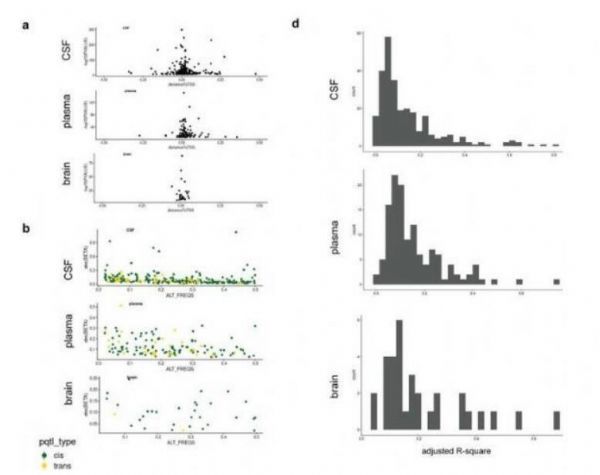
pQTLs的特性。
图片来源:Yang, C., et al. Nat Neurosci (2021). doi:10.1038/s41593-021-00886-6
【10】Nat Neurosci:科学家识别出治疗阿尔兹海默病的新型疗法靶点!
doi:10.1038/s41593-021-00886-6
理解蛋白质水平的组织特异性遗传控制机制对于揭示基因调节的后转录机制非常重要;近日,一篇发表在国际杂志Nature Neuroscience上题为“Genomic atlas of the proteome from brain, CSF and plasma prioritizes proteins implicated in neurological disorders”的研究报告中,来自华盛顿大学医学院等机构的科学家们通过研究识别出了阿尔兹海默病的潜在新型疗法靶点,同时还发现了当前的药物或能有效攻击这些靶点来治疗疾病。
这些潜在的靶点是导致大脑中淀粉样蛋白积累的缺陷蛋白质,其会导致患者出现记忆问题和思考问题,而这些问题均是阿尔兹海默病发病的特征。目前研究人员已经发现了15种被FDA批准的药物能用于其它治疗目的,这就为临床试验提供了一定的可能,或许还要比通常情况下更早地开展临床试验。此外,研究人员通过实验还得到了7种药物,其或有望治疗与帕金森疾病相关的错误蛋白质,其中6种用于中风,1种用于治疗ALS。几十年来,科学家们一直努力研究,通过靶向作用疾病过程中的关键基因来开发新型阿尔兹海默病疗法,但收效甚微。这种方法往往会产生死胡同,因为很多基因并没有从根本上改变大脑中发挥作用的蛋白质。而本文中,研究人员通过重点关注大脑和其它组织中的蛋白质,采用了一种新方法进行研究。
研究者Carlos Cruchaga说道,我们利用人类样本和最新技术来更好对理解阿尔兹海默病的生物学特性;而利用阿尔兹海默病样本,我们就能够识别新型基因、可药用的靶点以及FDA批准的化合物,其能与靶点潜在作用并可能减缓或逆转阿尔兹海默病的进展。科学家们重点研究了阿尔兹海默病患者和非患者大脑、脑脊液和血浆中的蛋白质水平,其中一些基因所编码的蛋白质与该疾病风险有关,当识别出这些蛋白后,研究人员将相关研究结果与影响这些蛋白质的现有药物的几个数据库进行了比较。这些药物是FDA批准且所有关于这些药物的安全数据能够得到,有了对这些药物的安全性的了解,所以我们能直接跳到临床试验。
【11】Mol Psych:开发出一种有望治疗阿尔兹海默病的新型潜在的非侵入性技术
doi:10.1038/s41380-021-01129-7
进行性的生理性老化与机体的认知性能受损及无法诱导长时程增强作用(LTP)有关,而LTP是机体记忆的一种电生理相关因素。近日,一篇发表在国际杂志Molecular Psychiatry上题为“Low-intensity ultrasound restores long-term potentiation and memory in senescent mice through pleiotropic mechanisms including NMDAR signaling”的研究报告中,来自昆士兰大学等机构的科学家们通过研究发现,超声波或能克服机体衰老和痴呆症所产生的一些不利影响,而这种操作并不需要跨越血脑屏障。研究者指出,低强度的超声波能有效回复小鼠模型机体的认知功能,而这无需打开其血脑屏障。
本文研究结果或为开发新型无创技术提供了新的途径,同时还能帮助临床医生定制个性化的疗法来考虑每位患者机体的疾病进展和认知功能下降情况。研究者Gotz教授说道,从历史上来讲,我们一直在使用超声波和充满气体的小气泡来打开几乎无法穿透的血脑屏障,从而将治疗性药物通过血液递送到大脑中。而这项最新研究中,研究人员指定了一个对照组,即该组研究对象接受了没有能打开屏障的微气泡的超声波。
整个研究小组对于小鼠模型大脑认知功能的恢复都感到非常惊讶;他们得出结论,这种治疗性超声波或能作为一种非侵入性的技术来增强老年人机体的认知功能;机体衰老与认知功能受损直接相关,同时机体学习诱导的神经元之间的信号传递的可塑性也会减少,这一过程称之为长时程增强作用。研究者认为,这项新的研究旨在利用超声波来恢复LTP并改善老年小鼠机体的空间学习能力。
doi:10.1073/pnas.2017225118
近日,一篇刊登在国际杂志Proceedings of the National Academy of Sciences上题为“Hydrogen sulfide is neuroprotective in Alzheimer's disease by sulfhydrating GSK3β and inhibiting Tau hyperphosphorylation”的研究报告中,来自英国埃克塞特大学等机构的科学家们通过研究发现,硫化氢(hydrogen sulfide)或能帮助有效预防阿尔兹海默病的发生。
硫化氢的典型特征是有毒、具有腐蚀性且散发着臭鸡蛋的气味,其“臭名”可能很快就会得到改善了,在对小鼠进行研究后,研究人员发现,硫化氢的恶臭气味或有助于保护机体大脑细胞,从而使个体免于阿尔兹海默病的发生,这种生化反应的发现或有望帮助研究人员开发新型药物来抵御神经变性疾病的发生。
研究者Bindu Paul说道,我们的最新研究结果利用硫化氢和细胞内的其它气体分子,将机体衰老、神经退化好细胞信号牢牢联系在了一起;正常情况下人体会产生少量的硫化氢来帮助调节机体中从细胞代谢到扩张血管等多种全身性功能,气体是主要的细胞信使分子,其对于大脑健康尤为重要,然而,与传统神经递质不同的是,气体并不会在囊泡中进行储存,其会通过不同的机制快速促进细胞的信号传递来发挥作用。以硫化氢为例,其需要通过一种化学硫化的作用来修饰靶向蛋白质,从而调节其活性。
(生物谷Bioon.com)
生物谷2021年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。