Cell综述深度解读HIV疗法研究进展:从寻求治疗靶点到清除持续性感染
来源:本站原创 2020-04-21 09:14
2020年4月21日 讯 /生物谷BIOON/ --日前,一篇刊登在国际杂志Cell上题为“Curing HIV: Seeking to Target and Clear Persistent Infection”的综述文章中,来自北卡罗来纳大学等机构的科学家们分析了当前研究人员开发靶向并消除HIV感染病毒库新型疗法的进展情况,同时他们也从如何寻找靶点及有效
2020年4月21日 讯 /生物谷BIOON/ --日前,一篇刊登在国际杂志Cell上题为“Curing HIV: Seeking to Target and Clear Persistent Infection”的综述文章中,来自北卡罗来纳大学等机构的科学家们分析了当前研究人员开发靶向并消除HIV感染病毒库新型疗法的进展情况,同时他们也从如何寻找靶点及有效清除病毒持续性感染进行了分析讨论。
图片来源:David M. Margolis, et al. Cell, doi:10.1016/j.cell.2020.03.005
人类免疫缺陷病毒1型(HIV-1)如今已经在全球导致了大约5000万人死亡,而且在全球范围内造成了巨大的影响,随着这种传染病的出现,临床医生和研究人员等人员都应该参与到抗逆转录病毒疗法(ART)的开发和实施过程中去,这对于阻断疾病的发生、减少新发感染人数至关重要,如今抗逆转病毒疗法的开发还在继续进行中,而且长效抗病毒药物和工程化抗体也正在进行高级别的临床试验,这些疗法有望取代患者每日服用的预防性或治疗性药物,而且每年患者仅需要几个疗程,尽管最近随着HVTN 702试验及复制RV144努力的失败,后期研究人员还会继续研究加速bnAbs(广谱中和性抗体,broadly neutralizing antibodies)的研究,从而降低全球HIV的新发感染数和发生率。
HIV治疗研究的现状
目前研究最多的消除持续性感染的策略时将诱导潜伏HIV表达的疗法与持续性ART疗法相结合,以防止新细胞被感染,同时这还能增强对受感染细胞的清除;如今研究人员已经开发出了HIV潜伏期的逆转剂(LRAs,latency reversal agents),其能够诱导病毒库中的病毒在宿主体内的表达,由于病毒的潜伏是由宿主细胞编程所驱动的,因此LRAs就必须针对宿主的进程,这就类似于很多用于肿瘤学研究的制剂一样。
尽管迄今为止所测试的LRAs都能在体内和体外诱导潜在病毒基因组中的RNA或病毒蛋白进行表达,但并没有令人信服的证据表明,在治疗中断后,病毒库被剔除或患者的缓解期被延长。因此研究人员就需要很好地选择LRAs来避免不可接受的脱靶毒性,在理想情况下,LRAs还能增强病毒的清除机制,从而促进病毒库的减少。尽管潜伏期逆转活动似乎可以理解为循环淋巴细胞中HIV的RNA表达水平的增加,但研究者并不清楚是否这种反应会转化为足够强大和持久性的HIV-1蛋白表达,从而使得感染的细胞被免疫清除。
目前所测试的免疫疗法所产生的机体免疫反应或许并不足以识别并清除一些具有挑战性的靶点,研究人员还需要开发新型工具和方法,而最近对HIV潜伏期的研究或许就能为后期开发有效的病毒清除策略提供新的思路。

潜在的及已经证明的HIV病毒库位点
图片来源:David M. Margolis, et al. Cell, doi:10.1016/j.cell.2020.03.005
多种机制会导致前病毒潜伏和持续性HIV感染
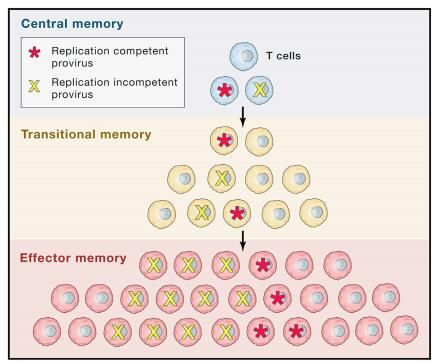
最初,研究人员只知道HIV感染会在AIDS出现之前存在一个临床潜伏期,RNA-PCR的开发就使研究者认识到了病毒血症在HIV感染过程中始终存在,直到1995年,研究人员才明确认识到了整合后病毒潜伏期的状态。当被激活的CD4+ T细胞被有效感染病恢复到静息G0状态时(即病毒基因转录最低水平时),就被认为会存在持续性和潜伏期感染;基于这一概念,在静息状态的CD4+ T细胞中,多种宿主转录因子对于驱动HIV转录被隔离方面就变得非常重要了,比如NF-kB、NFAT、P-TEFb等,然而,前病毒潜伏期如今已经被证明会被静息细胞环境中转录因子的缺乏所驱动。
潜伏病毒库中的多种细胞
我们所知道的促进HIV病毒库产生的不同细胞群都是通过外周血来确定的,然而,近来有研究更好地描述了这些组织储存库的特性;表达趋化因子受体CCR6的记忆CD4+ T细胞是肠道组织中HIV持续性感染的来源,这在非CD4+ T细胞中也是一样的;T滤泡辅助细胞(Tfh细胞)位于次级淋巴器官的B细胞滤泡内,有研究报道,即使在ART疗法的情况下,其也是HIV病毒的病毒库,鉴于免疫效应细胞进入B细胞区域的途径有限,清除持续性感染Tfh细胞或许就是研究人员所要面对的另一个挑战。
尽管在ART存在,骨髓系细胞仍然是HIV持续感染的潜在来源,随着研究人员开始寻找逆转持续性感染的方法,他们就需要考虑相关的干预措施对其它人群机体中前病毒的影响,潜在感染的中央记忆T细胞库产量的减少或许会导致其它更为分化的细胞类型感染的减少,或者就需要其它的干预措施。
实验性的医学研究
考虑到HIV治疗研究尚处于初级阶段,目前对潜伏期逆转、免疫治疗和联合疗法的研究都还非常有限,除了免疫学和病毒学方面清除HIV所面临的挑战外,临床研究已经启动了关于风险和收益之间平衡的讨论;尽管在ART疗法使用的情况下,病毒仍然会复制,许多关于ART强化的研究都没有证据表明HIV病毒库或HIV表达会发生减少;尽管仍有少数研究人员存在争议,但总的来说,有研究表明,在现有ART疗法的前提下,HIV持续的病毒复制并不会有助于维持患者体内的HIV病毒库。
如今,治疗性的疫苗已经能作为一种方法来改善ART抑制的患者体内HIV感染细胞中病毒的清除,起终点是能够诱导宿主机体的T细胞反应,尽管临床研究表明,治疗性的HIV疫苗能够对HIV特异性的T细胞免疫力产生影响,但其总体反应并不尽如人意,迄今为止,治疗性的疫苗策略并未对宿主机体的病毒产生持续性的抑制反应。
免疫检查点抑制剂(ICIs,Immune checkpoint inhibitors)能通过逆转与特定恶性肿瘤相关的癌症相关免疫功能异常来彻底改变癌症的治疗,即使使用了有效的ART疗法,HIV特异性的T细胞耗竭依然存在,这或许是目前HIV治疗所面临的一个障碍,此外,表达免疫检查点标志物的CD4+ T细胞也能被用来检测潜伏性的HIV;因此,ICIs能提供一种特殊策略来逆转HIV相关的免疫障碍,并靶向作用携带潜伏HIV-1的细胞,在一项对感染者的ICIs临床研究中,研究人员发现,单一低剂量输注抗PD-L1 mAb(BMS-936559)似乎能够增强6名受试者中2名机体中HIV-1特殊的免疫反应。
除此之外,研究人员还开展了联合研究开发治疗HIV感染的新型疗法,多项HIV临床研究都展现出了增强宿主机体HIV特殊免疫反应的能力,同时在不进行ART的情况下也并不会对病毒库或病毒的控制产生一定效应;研究人员需要使用潜在的LRAs来重新有效激活潜伏期的HIV,当前能够使用的免疫疗法策略,不管是单独使用还是联合使用都会大量消灭携带潜伏病毒的感染细胞。(生物谷Bioon.com)
参考资料:
David M. Margolis, Nancie M. Archin, Myron S. Cohen, et al. Curing HIV: Seeking to Target and Clear Persistent Infection, Cell, 2 April 2020, Pages 189-206 doi:10.1016/j.cell.2020.03.005
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


