BCMA-CD3双特异性抗体!辉瑞PF-06863135每周一次皮下注射治疗多发性骨髓瘤:总缓解率83%!
来源:本站原创 2020-12-09 16:31
PF-06863135对BCMA和CD3的结合亲和力得到了优化,使T细胞介导的抗肿瘤活性更强。

2020年12月09日讯 /生物谷BIOON/ --辉瑞(Pfizer)近日在第62届美国血液学会(ASH)年会上公布了PF-06863135治疗复发或难治性多发性骨髓瘤(R/R MM)I期研究(NCT03269136)的安全性和临床应答结果。PF-06863135是一款在研的、靶向BCMA和CD3的双特异性抗体。来自30例R/R MM患者的数据显示,PF-06863135在所有皮下注射剂量水平的安全性都是可控的,没有观察到剂量限制性毒性。在最高剂量水平下,有83%的患者实现临床应答。
PF-06863135是一种BCMAxCD3双特异性抗体,旨在结合多发性骨髓瘤细胞表面高度表达的B细胞成熟抗原(BCMA)和抗癌T细胞表面的CD3受体,将它们连接在一起以激活免疫反应。PF-06863135对BCMA和CD3的结合亲和力得到了优化,使T细胞介导的抗骨髓瘤活性更强。皮下注射PF-06863135的目的是允许比静脉注射更高的剂量,而不会增加不良事件。
这项I期研究(NCT03269136)是一项开放标签、多剂量、多中心、剂量递增、安全性、药代动力学(PK)和药效学研究,入组的是接受标准疗法后复发或对标准疗法难治的MM成人患者。该研究由2部分组成,第1部分评估了PF-06863135递增剂量水平的安全性和耐受性。该研究入组了80例患者,并评估了经静脉或皮下注射PF-06863135。静脉给药的初步结果于2019年在ASH年会上报告。
今年ASH年会上公布的这部分研究的主要目标是评估皮下注射PF-06863135的安全性和耐受性,确定最大耐受剂量,并选择推荐的2期剂量。研究中,在剂量递增过程中,未观察到任何皮下剂量水平(每周80-1000μg/kg)的剂量限制性毒性。73.3%的患者出现细胞因子释放综合征(CRS),仅限于1级(56.7%)或2级(16.7%)。发生在>10%患者中的≥3级不良事件包括淋巴细胞减少症(53.3%)、中性粒细胞减少症(26.7%)、血小板减少症(16.7%)和贫血(16.7%)。
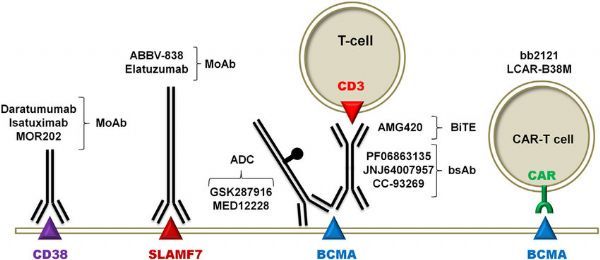
多发性骨髓瘤细胞表面的有效生物治疗靶点(图片来源于文献:PMID:30545798)
在有效剂量范围为每周一次215-1000μg/kg治疗的20例患者中,总缓解率(ORR)为80%。在这20例患者中,6例获得严格完全缓解(sCR)或完全缓解(CR)、3例获得非常好的部分缓解(VGPR)、6例获得部分缓解(PR)。3例有治疗应答的患者,曾接受过至少一种BCMA靶向疗法。在最高剂量为1000μg/kg时,ORR为83%(n=5/6)。根据这些数据,推荐的2期剂量为每周一次1000μg/kg。
辉瑞肿瘤研发部高级副总裁兼首席科学官Jeff Settleman表示:“尽管治疗取得了进展,但多发性骨髓瘤(MM)仍然无法治愈,对患者来说,迫切需要治疗方面的重大突破。PF-06863135治疗观察到的非常高缓解率,加上可管理的安全性和皮下给药的便利性,强调了这种药物可能对患有这种毁灭性疾病的患者群体带来的潜在影响。这些发现支持了PF-06863135在多发性骨髓瘤治疗中的持续开发,既可以作为单一疗法,也可以与标准疗法或新疗法相结合。”(生物谷Bioon.com)
原文出处:PFIZER REPORTS POSITIVE CLINICAL DATA FOR BCMA-CD3 BISPECIFIC ANTIBODY (PF-06863135) IN MULTIPLE MYELOMA
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->