全球1型神经纤维瘤病(PN1)药物!阿斯利康Koselugo在日本获孤儿药资格,已在美国上市!
来源:本站原创 2020-06-30 19:53
NF1是一种常常导致毁容的、罕见的遗传病,导致肿瘤在神经上生长,Koselugo是一种口服、强效、选择性MEK1/2激酶抑制剂。

2020年06月30日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,其靶向抗癌药Koselugo(selumetinib)在日本被授予孤儿药资格(ODD),用于治疗1型神经纤维瘤病(NF1)。
NF1是一种使人衰弱的、进行性、常常导致毁容的、罕见的遗传性疾病,导致肿瘤在神经上生长,这些肿瘤可以生长在身体的任何地方,包括面部、四肢、脊柱周围、身体深处可能影响器官的区域。这种疾病通常始于生命早期,由特定基因的突变或缺陷引起。
NF1通常在儿童早期确诊,大约3000个婴儿中就有一个出现NF1,其特征是肤色(色素沉着)变化、神经和骨骼损伤、一生中发生良性和恶性肿瘤的风险。30%到50%的NF1患者出现一处或多处PN。
阿斯利康肿瘤研发执行副总裁José Baselga表示:“1型神经纤维瘤病(NF1)会对儿童产生毁灭性的影响,急需新的药物来帮助治疗由此产生的丛状神经纤维瘤(PN)和相关的临床问题。大多数国家目前的选择非常有限,此次孤儿药资格认定是在日本向儿科患者提供第一种NF1药物方面迈出的重要一步。”
默沙东研究实验室高级副总裁兼全球临床开发主管、首席医学官Roy Baynes表示:“丛状神经纤维瘤(PN)是NF1的主要表现之一,会导致疼痛和毁容。在II期SPRINT试验中,selumetinib被证明可以减少儿童肿瘤的大小。我们希望我们能够将这种治疗方法带到日本这一服务不足的儿科患者群体。”
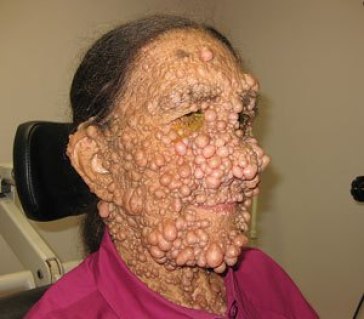
丛状神经纤维瘤(PN)(图片来源:cancerworld.info)
NF1是一种罕见、不可治愈、使人衰弱的遗传病,在婴儿中的发病率大约为三千至四千分之一。该病是由NF1基因中的一个自发突变或遗传突变引起,与许多症状相关,包括皮肤表面和皮肤内的软团块(皮下神经纤维瘤)、皮肤色素沉着(咖啡牛乳色斑块)。约30-50%的NF1患者经历丛状神经纤维瘤(PN),这是一种沿着神经鞘生长的肿瘤。这些PN可导致临床问题,如外形缺陷、运动功能障碍、疼痛、气道功能障碍、视觉障碍、肠/膀胱功能障碍。PN始于儿童早期,严重程度变化很大,可将预期寿命缩短8-15年。
selumetinib是一种口服、强效、选择性MEK1/2激酶抑制剂。MEK1/2蛋白是细胞外信号相关激酶(ERK)通路的上游调节因子。MEK和ERK都是RAS调节的RAF-MEK-ERK通路的重要组成部分,而RAF-MEK-ERK通路在不同类型的癌症中经常被激活。
NF1基因编码神经纤维瘤蛋白(neurofibromin),该蛋白对RAS/MEK通路进行负调控,帮助控制细胞生长、分化和存活。NF1基因突变可能导致RAS-RAF-MEK-ERK信号通路失调,而这可能导致细胞以不受控制的方式生长、分裂和复制,并可能导致肿瘤生长。selumetinib通过抑制这条通路中的MEK酶,潜在地抑制肿瘤生长。目前,selumetinib正在临床研究中被评估,作为单药疗法以及联合其他疗法治疗多种类型肿瘤。
今年4月,selumetinib获得美国FDA批准,以品牌名Koselugo上市销售,用于年龄≥2岁的NF1儿科患者,具体适用于:治疗NF1相关的症状性、不能手术的丛状神经纤维瘤(PN)。
值得一提的是,Koselugo是第一个被批准治疗NF1的药物。今年早些时候,selumetinib用于NF1患者治疗PN的营销授权申请(MAA)获得欧洲药品管理局(EMA)受理,进一步的全球监管申请正在进行中。此前,在美国、欧盟、瑞士,selumetinib均被授予了孤儿药资格,在美国还被授予罕见儿科疾病资格(RPDD)和突破性药物资格(BTD)。
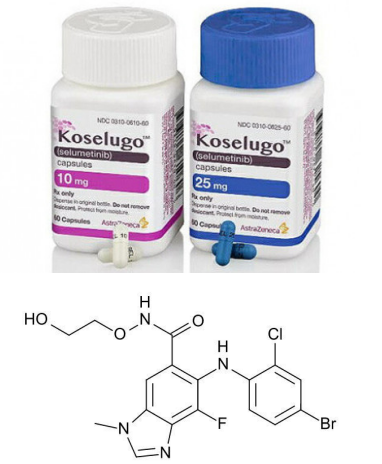
selumetinib分子结构式(图片来源:Wikipedia)
Koselugo获得美国FDA批准,基于美国国家癌症研究所(NCI)癌症治疗评估项目(CTEP)赞助的SPRINT II期Stratum 1试验的阳性结果。该试验入组的儿科患者患有NF1和不能手术的PN(定义为不能完全切除但不会对患者造成严重发病风险的PN)。疗效结果来自50例接受推荐剂量的患者,试验期间对这些患者肿瘤大小的变化和肿瘤相关疾病进行了常规评估。试验期间,患者每天2次口服25 mg/m2的Koselugo,直到病情恶化或出现不可接受的不良反应。该临床试验测定了总缓解率(ORR),定义为:3-6个月通过MRI证实有完全缓解或部分缓解(PN肿瘤体积减少≥20%)的患者比例。
数据显示,Koselugo作为每日二次口服单药治疗的总缓解率(ORR)为66%(n=33/50),所有患者均为部分缓解(PR)。在这些患者中,82%的患者经历了持续12个月或更长时间的缓解。Koselugo治疗期间患者的其他临床结果,包括PN相关缺陷、症状和功能损害的变化。尽管评估每个PN相关发病率(如缺陷、疼痛、力量和活动性问题、气道压迫、视力损害和膀胱或肠功能障碍)的患者样本量很小,但治疗期间PN相关症状或功能缺陷似乎有改善的趋势。
服用Koselogo的患者中,常见副作用是呕吐、皮疹、腹痛、腹泻、恶心、皮肤干燥、疲劳、肌肉骨骼疼痛(身体疼痛影响骨骼、肌肉、韧带、肌腱和神经)、发热、痤疮样皮疹(痤疮)、口炎(口唇发炎)、头痛,甲沟炎(脚趾甲或指甲周围皮肤的感染)和瘙痒(瘙痒)。
Koselugo还可引起严重的副作用,包括心力衰竭(表现为射血分数降低,或心脏左心室肌肉没有正常跳动)和眼毒性(眼睛的急性和慢性损伤),包括视网膜静脉阻塞、视网膜色素上皮脱离及视力损害。患者应在开始Koselugo治疗前和治疗期间定期进行心脏和眼科评估。Koselugo还可导致肌酐磷酸激酶(CPK)升高,这是一种存在于心脏的酶。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


