A型血友病重磅新药!中外制药双特异性抗体药物Hemlibra在中国台湾上市!
来源:本站原创 2019-11-21 17:37
2019年11月21日讯 /生物谷BIOON/ --罗氏(Roche)控股的日本药企中外制药(Chugai)近日宣布,其在中国台湾的全资子公司已向市场推出A型血友病新药Hemlibra(emicizumab)。Hemlibra于今年10月底获得台湾食品药品监督管理局(TFDA)批准,可每周、每2周、每4周皮下注射一次,用于体内未产生凝血因子VIII抑制剂的A型血友病患者,预防出血发作。此外,TFD

2019年11月21日讯 /生物谷BIOON/ --罗氏(Roche)控股的日本药企中外制药(Chugai)近日宣布,其在中国台湾的全资子公司已向市场推出A型血友病新药Hemlibra(emicizumab)。
Hemlibra于今年10月底获得台湾食品药品监督管理局(TFDA)批准,可每周、每2周、每4周皮下注射一次,用于体内未产生凝血因子VIII抑制剂的A型血友病患者,预防出血发作。此外,TFDA还批准Hemlibra每2周、每4周一次给药方案,用于体内已产生凝血因子VIII抑制剂的A型血友病患者。
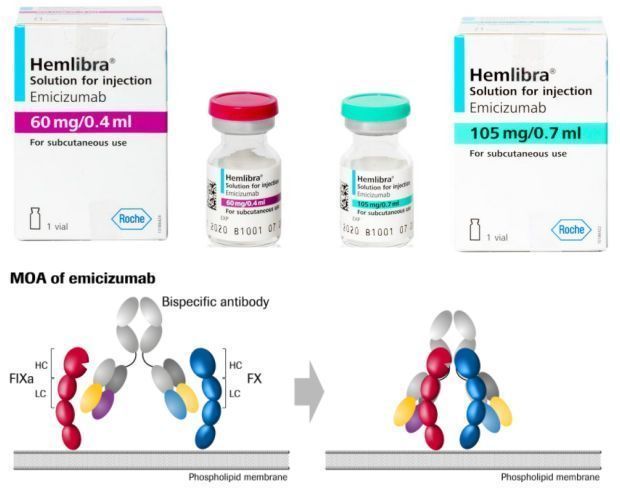
Hemlibra是一种双特异性单克隆抗体,能将激活天然凝血级联反应和恢复天然凝血过程所必需的2种蛋白质——凝血因子IXa和X聚集在一起,恢复A型血友病患者的凝血过程。在临床研究中,Hemlibra已被证明能够显著减少出血事件并改善机体功能。
Hemlibra由中外制药研制,目前由中外制药、罗氏及旗下基因泰克合作开发。该药的开发,旨在帮助克服A型血友病群体当前面临的临床挑战:现有药物药效持续时间短、VIII抑制剂的产生、频繁的静脉输注需求。
Hemlibra于2017年11月率先获美国FDA批准,作为一种常规预防性药物,用于体内已产生凝血因子VIII抑制剂的A型血友病成人及儿童患者,预防或降低出血事件发生频率。
截至目前,Hemlibra分别获90多个国家用于体内存在因子VIII抑制剂(基于HAVEN 1和HAVEN 2研究)、获全球60多个国家批准用于体内不存在(基于HAVEN 3和HAVEN 4研究)因子VIII抑制剂的A型血友病患者,预防或降低出血事件的发生频率。该药的开发,旨在帮助克服A型血友病群体当前面临的临床挑战:现有药物药效持续时间短、VIII抑制剂的产生、频繁的静脉输注需求。
值得一提的是,Hemlibra是近20年来获批治疗体内未产生凝血因子VIII抑制剂的重度A型血友病患者的首个新一类药物,该药同时也是唯一一个可用于体内已产生或未产生因子VIII抑制剂A型血友病患者进行自我皮下注射并具有多种给药方案(每周一次、每2周一次、每4周一次皮下注射)的预防性治疗药物。
根据罗氏发布的2019年业绩报告,Hemlibra在今年前9个月的销售额达到了9.21亿瑞士法郎。而随着适用人群的扩展和市场的扩大,Hemlibra的商业销售预计将大幅增加。之前,科睿唯安预测Hemlibra在2022年的销售额将达到40亿美元。(生物谷Bioon.com)
原文出处:Chugai’s Hemlibra Launched for Hemophiia A with Inhibitors in Taiwan
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


