Science:基因编辑大牛张锋开发出RESCUE技术,可扩大RNA编辑能力
- ADAR2
- ApoE2
- APOE4
- Cas12
- Cas13
- Cas9
- CRISPR
- REPAIR
- RESCUE
- RNA
- RNA编辑
- β-连环蛋白
- 基因突变
- 基因编辑
- 尿苷
- 磷酸化
- 肌苷
- 胞嘧啶
- 腺嘌呤
来源:本站原创 2019-07-13 12:20
2019年7月13日讯/生物谷BIOON/---基于CRISPR的工具彻底改变了我们靶向与疾病相关的基因突变的能力。CRISPR技术包括一系列不断增长的能够操纵基因及其表达的工具,包括利用酶Cas9和Cas12靶向DNA,利用酶Cas13靶向RNA。这一系列工具提供了处理突变的不同策略。鉴于RNA寿命相对较短,靶向RNA中与疾病相关的突变可避免基因组发生永久性变化。此外,使用CRISPR/Cas9
2019年7月13日讯/生物谷BIOON/---基于CRISPR的工具彻底改变了我们靶向与疾病相关的基因突变的能力。CRISPR技术包括一系列不断增长的能够操纵基因及其表达的工具,包括利用酶Cas9和Cas12靶向DNA,利用酶Cas13靶向RNA。这一系列工具提供了处理突变的不同策略。鉴于RNA寿命相对较短,靶向RNA中与疾病相关的突变可避免基因组发生永久性变化。此外,使用CRISPR/Cas9介导的编辑难以对诸如神经元之类的某些细胞类型进行编辑,因而需要开发新策略来治疗影响大脑的破坏性疾病。
在一项新的研究中,美国麻省理工学院麦戈文脑科学硏究所研究员、布罗德研究所核心成员张锋(Feng Zhang)及其团队如今开发出一种称为RESCUE(RNA Editing for Specific C to U Exchange, C→U交换特异性的RNA编辑)的策略。相关研究结果于2019年7月11日在线发表在Science期刊上,论文标题为“A cytosine deaminase for programmable single-base RNA editing”。
张锋和他的团队,包括论文共同第一作者Omar Abudayyeh和Jonathan Gootenberg(如今都是麦戈文脑科学硏究所研究员),利用一种失活的Cas13将RESCUE引导到RNA转录本中的目标胞嘧啶碱基上,并使用一种新的、经过进化的、可编程的酶将不想要的胞嘧啶(C)转化为尿苷(U),从而指导RNA指令发生变化。RESCUE建立在REPAIR技术的基础之上,其中REPAIR也是由张锋团队开发的,可将碱基腺嘌呤转化为RNA中的肌苷(Science, 2017, doi:10.1126/science.aaq0180,详细新闻报道参见生物谷报道: 重磅!Nature和Science同日打擂台发表新型DNA/RNA碱基编辑器,可校正点突变)。
RESCUE显著地扩展了CRISPR工具能够靶向的范围,包括蛋白中可修饰的位点,比如磷酸化位点。这些位点充当蛋白活性的开启/关闭开关,而且主要存在于信号分子和癌症相关通路中。
张锋说道,“为了应对导致疾病的遗传变化的多样性,我们需要有一系列精确技术可供选择。通过这种新的酶并将它与CRISPR的可编程性和精确性相结合,我们能够填补工具箱中的关键空白。”
将RNA编辑的范围扩大到新的靶标
之前开发的REPAIR平台使用靶向RNA的 CRISPR/Cas13将一种称为ADAR2的RNA编辑器的活性结构域引导至特定的RNA转录物,在那里它能够将腺嘌呤(A)转换为肌苷(I),即A→I。由于不存在具有替代活性的天然编辑器,张锋和他的同事们进行了REPAIR融合,并在实验室中让它进行进化,直到它能够将胞嘧啶转换为尿苷,即C→U。
RESCUE能够被引导至任何选择的RNA,然后通过这种平台中经过进化的ADAR2组分执行C→U编辑。张锋团队将这种新平台导入到人细胞中,结果表明这能够靶向人细胞中的天然RNA以及合成RNA中的24种临床相关突变。然后,他们进一步优化了RESCUE以减少脱靶编辑,同时最小程度地降低对在靶编辑的干扰。
新靶标即将到来
利用RESCUE扩展靶向能力意味着通过磷酸化、糖基化和甲基化等翻译后修饰调节许多蛋白的活性和功能的位点如今都可作为编辑的靶标。
RNA编辑的一个主要优点是它的可逆性,相比之下,DNA水平上的变化是永久性的。因此,在需要暂时而非永久进行修饰的情况下,就可临时部署RESCUE。为了证实这一点,张锋团队发现在人细胞中,RESCUE能够靶向编码β-连环蛋白的RNA中的特定位点,从而导致β-连环蛋白活化和细胞生长的暂时增加,其中已知β-连环蛋白可发生磷酸化。如果永久性地发生这种修饰,那么这可能让细胞易于发生不受控制的细胞生长和癌变,但是在急性损伤时,暂时的细胞生长可能会刺激伤口愈合。
这些研究人员还靶向一种致病性的基因变体,即APOE4。 APOE4等位基因一直是晚发性阿尔茨海默病产生的一种遗传风险因素。基因亚型APOE4与不是遗传风险因素的APOE2仅存在两个碱基的差别(在APOE4中,这两个碱基都是C,而在APOE2中,这两个碱基都是U)。张锋和他的同事们将风险相关的APOE4 RNA导入细胞中,结果发现RESCUE能够将它的特征性的两个碱基C都转化为U,因而将它转化为APOE2序列,从而将风险相关的变体APOE4 转化为非风险因素的变体APOE2。
就像张锋实验室之前开发的CRISPR工具一样,他们计划广泛地分享RESCUE平台,以便促进更多的人使用这种平台,从而有助于将RESCUE 推向临床,并且能够让人们使用这种平台作为一种更好地理解致病突变的工具。这种平台将通过非营利性质粒库Addgene免费提供给人们用于开展学术研究。想要了解更多信息,请访问张锋实验室的网页:https://zlab.bio/。(生物谷 Bioon.com)
参考资料:
Omar O. Abudayyeh et al. A cytosine deaminase for programmable single-base RNA editing. Science, 2019, doi:10.1126/science.aax7063.
New CRISPR platform expands RNA editing capabilities
在一项新的研究中,美国麻省理工学院麦戈文脑科学硏究所研究员、布罗德研究所核心成员张锋(Feng Zhang)及其团队如今开发出一种称为RESCUE(RNA Editing for Specific C to U Exchange, C→U交换特异性的RNA编辑)的策略。相关研究结果于2019年7月11日在线发表在Science期刊上,论文标题为“A cytosine deaminase for programmable single-base RNA editing”。

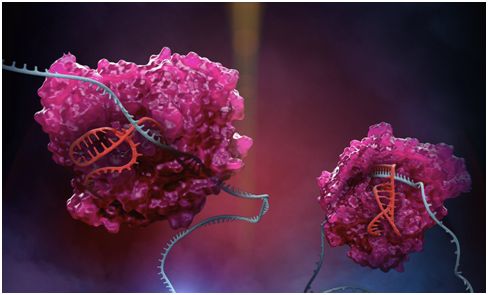
CRISPR家族酶Cas13在发挥作用。Cas13(粉红色)是RESCUE平台的核心,它使用特定的向导分子(红色)靶向细胞中的RNA(蓝色)。图片来自Stephen Dixon。
张锋和他的团队,包括论文共同第一作者Omar Abudayyeh和Jonathan Gootenberg(如今都是麦戈文脑科学硏究所研究员),利用一种失活的Cas13将RESCUE引导到RNA转录本中的目标胞嘧啶碱基上,并使用一种新的、经过进化的、可编程的酶将不想要的胞嘧啶(C)转化为尿苷(U),从而指导RNA指令发生变化。RESCUE建立在REPAIR技术的基础之上,其中REPAIR也是由张锋团队开发的,可将碱基腺嘌呤转化为RNA中的肌苷(Science, 2017, doi:10.1126/science.aaq0180,详细新闻报道参见生物谷报道: 重磅!Nature和Science同日打擂台发表新型DNA/RNA碱基编辑器,可校正点突变)。
RESCUE显著地扩展了CRISPR工具能够靶向的范围,包括蛋白中可修饰的位点,比如磷酸化位点。这些位点充当蛋白活性的开启/关闭开关,而且主要存在于信号分子和癌症相关通路中。
张锋说道,“为了应对导致疾病的遗传变化的多样性,我们需要有一系列精确技术可供选择。通过这种新的酶并将它与CRISPR的可编程性和精确性相结合,我们能够填补工具箱中的关键空白。”
将RNA编辑的范围扩大到新的靶标
之前开发的REPAIR平台使用靶向RNA的 CRISPR/Cas13将一种称为ADAR2的RNA编辑器的活性结构域引导至特定的RNA转录物,在那里它能够将腺嘌呤(A)转换为肌苷(I),即A→I。由于不存在具有替代活性的天然编辑器,张锋和他的同事们进行了REPAIR融合,并在实验室中让它进行进化,直到它能够将胞嘧啶转换为尿苷,即C→U。
RESCUE能够被引导至任何选择的RNA,然后通过这种平台中经过进化的ADAR2组分执行C→U编辑。张锋团队将这种新平台导入到人细胞中,结果表明这能够靶向人细胞中的天然RNA以及合成RNA中的24种临床相关突变。然后,他们进一步优化了RESCUE以减少脱靶编辑,同时最小程度地降低对在靶编辑的干扰。
新靶标即将到来
利用RESCUE扩展靶向能力意味着通过磷酸化、糖基化和甲基化等翻译后修饰调节许多蛋白的活性和功能的位点如今都可作为编辑的靶标。
RNA编辑的一个主要优点是它的可逆性,相比之下,DNA水平上的变化是永久性的。因此,在需要暂时而非永久进行修饰的情况下,就可临时部署RESCUE。为了证实这一点,张锋团队发现在人细胞中,RESCUE能够靶向编码β-连环蛋白的RNA中的特定位点,从而导致β-连环蛋白活化和细胞生长的暂时增加,其中已知β-连环蛋白可发生磷酸化。如果永久性地发生这种修饰,那么这可能让细胞易于发生不受控制的细胞生长和癌变,但是在急性损伤时,暂时的细胞生长可能会刺激伤口愈合。
这些研究人员还靶向一种致病性的基因变体,即APOE4。 APOE4等位基因一直是晚发性阿尔茨海默病产生的一种遗传风险因素。基因亚型APOE4与不是遗传风险因素的APOE2仅存在两个碱基的差别(在APOE4中,这两个碱基都是C,而在APOE2中,这两个碱基都是U)。张锋和他的同事们将风险相关的APOE4 RNA导入细胞中,结果发现RESCUE能够将它的特征性的两个碱基C都转化为U,因而将它转化为APOE2序列,从而将风险相关的变体APOE4 转化为非风险因素的变体APOE2。
就像张锋实验室之前开发的CRISPR工具一样,他们计划广泛地分享RESCUE平台,以便促进更多的人使用这种平台,从而有助于将RESCUE 推向临床,并且能够让人们使用这种平台作为一种更好地理解致病突变的工具。这种平台将通过非营利性质粒库Addgene免费提供给人们用于开展学术研究。想要了解更多信息,请访问张锋实验室的网页:https://zlab.bio/。(生物谷 Bioon.com)
参考资料:
Omar O. Abudayyeh et al. A cytosine deaminase for programmable single-base RNA editing. Science, 2019, doi:10.1126/science.aax7063.
New CRISPR platform expands RNA editing capabilities
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


