聚焦单克隆抗体药物产品研发新进展
来源:本站原创 2019-05-22 19:24
抗体是由机体效应B细胞分泌产生的一种免疫球蛋白,其能协助免疫系统鉴别、中和抗原或其它外来物质。1975年,Kohler和Milstein首先建立了杂交瘤技术,该技术能通过体外持续培养骨髓瘤细胞,融合可分泌抗体的B淋巴细胞,再次经黄嘌呤氨基蝶呤胸苷筛选及克隆化得到大量单克隆细胞株,这一技术为后期治疗性单克隆抗体药物研发奠定了重要基础。图片来源: mrgscience.com自从1986年全球第一个鼠
抗体是由机体效应B细胞分泌产生的一种免疫球蛋白,其能协助免疫系统鉴别、中和抗原或其它外来物质。1975年,Kohler和Milstein首先建立了杂交瘤技术,该技术能通过体外持续培养骨髓瘤细胞,融合可分泌抗体的B淋巴细胞,再次经黄嘌呤氨基蝶呤胸苷筛选及克隆化得到大量单克隆细胞株,这一技术为后期治疗性单克隆抗体药物研发奠定了重要基础。
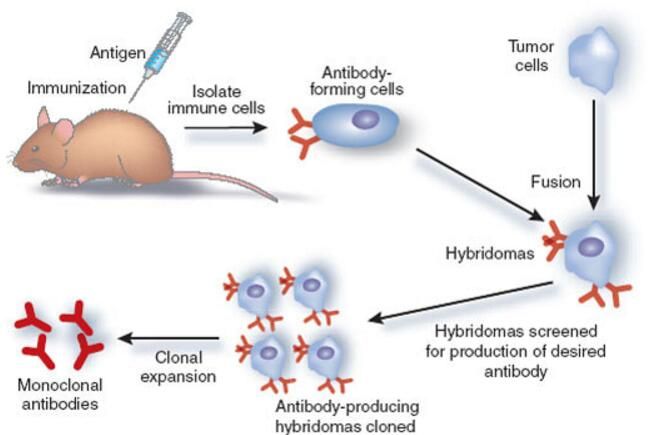
图片来源: mrgscience.com
自从1986年全球第一个鼠源性单抗药物Muromonab OKT3问世以来,如今全球将近有80个单抗药物上市。单抗药物的发展经历了四个阶段,分别为鼠源性单克隆抗体、嵌合性单克隆抗体、人源化单克隆抗体和全人源单克隆抗体。由人源化和全人源抗体制备的人源化和全人源抗体药物因其具有高亲和力、高特异性、毒副作用小的特点,克服了动物源抗体及嵌合抗体的各种缺点,如今其已经成为了治疗性抗体药物发展的必然趋势。
如今单抗药物已经被广泛用于癌症治疗、自身免疫性疾病、感染性疾病等多种疾病的诊断和治疗,本文中,小编整理了近期单克隆抗体药物(单抗药物)在临床研究方面取得的新进展,分享给大家!
【1】首个生物标志物驱动的肝癌疗法!礼来Cyramza获美国FDA批准,二线治疗高甲胎蛋白肝细胞癌[1]
近日,美国制药公司礼来宣布,FDA已批准Cyramza(ramucirumab,雷莫芦单抗)作为一种单药疗法,二线治疗已接受索拉非尼(sorafenib)治疗的高甲胎蛋白(AFP-High,α-甲胎蛋白[AFP]≥400ng/ml)肝细胞癌(HCC)患者。与此同时,FDA已从Cyramza标签中删除了与出血、胃肠穿孔和伤口愈合受损有关的黑框警告。值得一提的是,此次批准也是Cyramza在美国监管方面获得的第5次FDA批准。现在,Cyramza可用于治疗4种不同类型的癌症,除了HCC之外,之前已批准的癌症类型包括胃癌、非小细胞肺癌、结直肠癌。
此次批准,是基于全球性III期研究REACH-2的数据,该研究是在一个生物标记物选择的患者群体中完成的第一个阳性III期HCC研究,评估了Cyramza治疗高甲胎蛋白HCC患者的疗效和安全性,这些患者对索拉非尼不耐受或在接受索拉非尼治疗期间或之后病情进展。大约一半的晚期HCC患者呈现甲胎蛋白高,与普通HCC患者相比,这些患者的预后最差。
Cyramza是一种血管生成抑制剂,能够阻断肿瘤的血液供应。ramucirumab是一种全人源化IgG1单克隆抗体,是一种受体拮抗剂,靶向结合于血管内皮生长因子(VEGF)受体2的胞外域,从而阻断血管内皮生长因子配体(VEGF-A,-C,-D)的相互作用,并抑制受体激活。研究结果显示:(1)与安慰剂组相比,Cyramza治疗组总生存期(OS)取得了统计学意义的显著改善(中位OS:8.5个月[95%CI:7.0-10.6] vs 7.3个月[95%CI:5.4-9.1],HR=0.71,95%CI:0.53-0.95,p=0.02),达到了研究的主要终点。(2)与安慰剂组相比,Cyramza治疗组无进展生存期(PFS)取得了统计学意义的显著改善(中位PFS:2.8个月[95%CI:2.8-4.1] vs 1.6个月[95%CI:0.34-0.60],HR=0.45,95%CI:0.34-0.60,p<0.0001),达到了研究的次要终点。(3)Cyramza治疗组客观缓解率(ORR)在数值上高于安慰剂组(4.6% vs 1.1%,p=0.1697)。(4)Cyramza治疗组疾病控制率(ORR+稳定病情)高于安慰剂组(59.9% vs 38.9%)。
在对REACH-2研究和另一项III期研究REACH中甲胎蛋白高患者(n=542)的汇总分析显示,与安慰剂相比,Cyramza使总生存期显著延长了3.1个月(中位OS:8.1个月 vs 5.0个月;HR=0.69,95%CI:0.57-0.84,p=0.0002)。在所有预先指定的汇总亚组分析中,OS的HR均有利于Cyramza治疗组。PFS、ORR和疾病控制率与REACH和REACH-2一致,并支持了汇总的OS结果。REACH-2研究中观察到的安全性概况与先前在HCC患者中观察到的Cyramza单药治疗一致,Cyramza治疗组最常见的(发生率≥5%)的3级不良事件为高血压和低钠血症。
【2】Hyleukin-7联合Keytruda(可瑞达)三阴性乳腺癌(TNBC)临床研究治疗首例患者[2]
近日,生物技术公司Genexine与NeoImmuneTech联合宣布,评估T细胞放大器Hyleukin-7(rhIL-7-hyFc, NT-I7)联合默沙东PD-1肿瘤免疫疗法Keytruda(帕博利珠单抗)治疗难治性或复发性三阴性乳腺癌(TNBC)患者的临床研究(NCT03752723)已进行了首例患者治疗。
Genexine公司临床部高级副总裁Jung Won Woo博士表示,“Hyleukin-7和Keytruda联合方案试验非常有意义,该研究尝试治疗的是对标准治疗反应不佳的晚期或转移性TNBC患者。我们相信,通过治疗TNBC患者中常见的淋巴细胞减少症、以及增加肿瘤浸润淋巴细胞(TIL),Hyleukin-7有潜力改善对免疫治疗方案无应答的TNBC患者群体的治疗预后。”Hyleukin-7是一种新型免疫肿瘤学制剂,这是一种T细胞生长因子,由工程化白细胞介素-7(IL-7)分子共价连接的同二聚体组成,并与专有的长效平台hyFc进行融合。IL-7是T细胞稳态的一个重要因子,可以增加T细胞的数量和功能性。Hyleukin-7在癌症和淋巴细胞减少症患者的治疗中,能够增强和恢复持续的T细胞免疫,从而为免疫肿瘤学(IO)组合策略提供独特的机会。
在健康受试者中开展的I期临床研究以及在癌症患者中开展的多剂量递增研究中,Hyleukin-7显示出良好的耐受性、安全特征和CD4+和CD8+T淋巴细胞计数的剂量依赖性增加。Genexine和NeoImmuneTech也正在积极开展和计划多项概念验证临床试验,以开发Hyleukin-7,作为一种“IO enabling”疗法,与其他癌症治疗药物(如免疫检查点抑制剂和化疗/放疗)联合用药。
图片来源: kangantu.com
【3】安进地舒单抗注射液获批国内上市
5月22日,国家药品监督管理局官网宣布,目前已有条件批准安进公司开发的新型RANKL抑制剂地舒单抗注射液(Denosumab Injection)进口注册申请,用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗。
骨巨细胞瘤是一种极为罕见且进展迅速、富含人核因子活化因子受体配体(RANKL)的原发性骨肿瘤,表现为在长骨的干骺端和骺部或脊柱、骶骨的偏心融骨性病变。病变表现为高度血管化和侵袭性融骨性病变,并且边界模糊以及过渡区较宽。表达RANKL的单核基质细胞是骨巨细胞瘤病变的肿瘤组分,基于目前的假说,其作用是募集破骨细胞样巨细胞,引起肿瘤具有侵袭性的溶骨活性。
地舒单抗是由安进公司开发的一种新型RANKL抑制剂,是RANKL的全人化单克隆IgG2抗体,对可溶性、跨膜形式的人RANKL具有高度亲和力和特异性。在骨巨细胞瘤患者中,地舒单抗对肿瘤基质成分所分泌的RANKL的抑制可显著减少或消除破骨细胞样肿瘤相关巨细胞。地舒单抗可作为骨巨细胞瘤的靶向治疗,并有可能成为填补这一疾病未获满足的医学需求的重要治疗选择。
【4】默沙东Keytruda单药治疗三阴性乳腺癌III期试验未达主要终点[3]
5月21日,默沙东公布了Keytruda(pembrolizumab)作为单药疗法的三期KEYNOTE-119试验数据,此次试验的对象是先前接受过治疗的转移性三阴性乳腺癌(TNBC)患者。试验结果显示,与化疗(包括卡培他滨等)相比,试验中的TNBC患者未达到预先指定的主要终点,即优越总生存期(OS)的改善和延长。试验的其它终点未按照研究方案进行正式测试。此外,Keytruda在该试验中的安全性与先前报道的涉及该药单一疗法研究中观察到的一致,没有发现新的安全问题。
Keytruda是一种阻断PD-1受体分子的人源化单克隆抗体,PD-1与配体PD-L1结合后将使T细胞的免疫反应关闭,T细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号。Keytruda的免疫调节功能在抗肿瘤、抗自身免疫性疾病等方面有重要意义,目前该药已经获得多种肿瘤适应症的批准。
默沙东公司首席医疗官高级副总裁Roy Baynes博士表示,“虽然我们对这项单药治疗试验的结果感到失望,但我们仍在继续研究如何应用Keytruda缓解该疾病的早期阶段,并与化学疗法相结合,以解决三阴性乳腺癌患者未满足的医疗需求。”目前Keytruda乳腺癌临床开发计划包括若干内部和外部合作研究,正在进行的三项TNBC注册研究分别是KEYNOTE-355、KEYNOTE-242和KEYNOTE-522。
【5】缺乏生存效益 艾伯维终止肿瘤临床III期试验[4]
近日,艾伯维宣布停止抗体偶联药物depatuxizumab mafodotin(Depatux-M)用于EGFR扩增型新诊断恶性胶质瘤患者治疗的3期临床INTELLANCE-1的继续研究。停止的原因是,一个独立的数据监测委员会IDMC建议停止这项试验,因为与安慰剂相比,接受该药物的患者缺乏生存获益。
这项试验中,研究者们对新诊断为EGFR扩增的GBM患者分别给予Depatux-M或安慰剂治疗,同时与施以替莫唑胺+放射治疗和辅助性替莫唑胺治疗的疗效和安全性进行了比较,主要终点是总生存期(OS),中期分析基于639名患者的数据。艾伯维副总裁Michael Severino表示:“胶质母细胞瘤患者和他们的照看者面临着一种毁灭性的疾病,几乎没有治疗的选择。虽然Depatux-M没有在此次研究中显示生存获益,但我们仍将致力于发现和开发治疗方法,以治疗一些最致命的癌症。”
在做出此次终止临床研究决定前,FDA批准了艾伯维Venclexta(venetoclax)联合Gazyva(Obinutuzumab)治疗以前未经治疗的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤。据美国癌症协会估计,2019年在美国大约有17760人死于脑和脊髓肿瘤。胶质母细胞瘤或多形性胶质母细胞瘤(GBM),通常发现于大脑半球,但可以在大脑任何地方检测到。

图片来源: dxy.cn/bbs
【6】国内第2款CGRP单抗Aimovig递交IND
5月20日,国家药品监督管理局药品审评中心官网显示,诺华新型CGRP靶向疗法Aimovig(erenumab)递交了IND申请,受理号为JXSL1900048。值得注意的是,这是国内第二款递交IND的CGRP单抗药物。Aimovig是同类首款获批的CGRP单克隆抗体药物。
降钙素基因相关肽(calcitoningene-related peptide,CGRP)是一种由三叉神经节初级感觉神经元末端释放的神经肽,由37个氨基酸残基组成,已被证明在偏头痛发作过程中其含量会显着升高,具有启动、调节、传递偏头痛信号和增强敏感性的作用。目前,CGRP已成为治疗偏头痛药物研发的最热门靶点,国际头痛协会主席、梅奥诊所的神经科学家David Dodick认为CGRP是迄今发现的对抗偏头痛的最佳靶点。
Aimovig是通过靶向阻断CGRP受体开发的首个预防偏头痛的药物,由诺华与安进联合开发,双方共同负责该药物在美国市场的商业化,安进保留在日本的独家商业化权利,诺华拥有在欧洲、加拿大及其他地区的独家商业化权利。2018年5月,Aimovig美国获批上市,成为同类首款获批的CGRP单克隆抗体药物。除了Aimovig,在美国和欧盟,还有另外两款抗CGRP疗法获批,分别是:礼来的Emgality(galcanezumab)和梯瓦的Ajovy(fremanezumab)。
在用药方面,Aimovig和Emgality均为每月一次皮下注射,Ajovy则可每月一次(225mg)或每季度一次(675mg)皮下注射。Ajovy是目前首个也是唯一一个可同时每季度一次或每月一次给药的抗CGRP偏头痛药物。
【7】单抗界的板蓝根?继HIV、乳腺癌后,leronlimab向非酒精性脂肪性肝炎发起挑战[5]
近日,生物技术公司CytoDyn宣布与克利夫兰诊所达成合作协议,在人源化小鼠模型中检测leronlimab预防非酒精性脂肪性肝炎(NASH)的能力。
Leronlimab是一种靶向CCR5的人源化IgG4单克隆抗体,该抗体堪称单抗界的“板蓝根”,在治疗多种疾病方面展示出积极疗效,包括HIV和三阴性乳腺癌(TNBC)。此前,FDA已授予leronlimab联合高效抗逆转录病毒疗法治疗HIV感染、联合卡铂治疗CCR5阳性转移性TNBC的快速通道资格,以及治疗急性移植物抗宿主病(aGVHD)的孤儿药资格。
NAFLD是一种由肝细胞脂肪堆积(脂肪变性)引起的炎症性疾病,病情严重的情况下,NAFLD会发展为NASH,若不进行治疗,NASH可能发展为肝细胞癌,预计到2020年NASH将成为肝移植的主要原因。
尽管对NASH的认识正在不断提高,但该病仍难以诊断,目前还没有批准的治疗方法。在多项临床研究和无关的第三方研究中,CCR5信号通路已被证明是NASH的潜在关键靶点。在超过700例患者中,leronlimab没有表现出与其他CCR5拮抗剂相关的肝脏毒性。此外,leronlimab可提供较低的给药频率,具备作为单一疗法或与其他分子化合物协同使用的独特能力。针对其他CCR5药物的多项NASH研究已显示出抗炎和抗纤维化作用。Cytodyn公司总裁兼首席执行官Nader Pourhassan博士表示,如果leronlimab成功完成NASH概念验证研究,将立即向FDA提交II期研究的研究性新药申请和方案。

图片来源:lawyersandsettlements.com
【8】首创新型IL-17C靶向抗炎药!诺华收购的单抗MOR106治疗特应性皮炎进入II期临床[6]
瑞士制药巨头诺华(Novartis)与比利时生物技术公司Galapagos NV及德国生物技术公司MorphoSys AG近日宣布,启动II期临床研究GECKO,评估皮下注射配方MOR106联合局部类固醇用于中度至重度特应性皮炎(atopic dermatitis,AD)患者治疗。该研究将在美国和加拿大招募60例患者,旨在作为与美国FDA之间的调查性新药申请(IND)开启研究。这些患者将随机分配,接受一剂皮下注射MOR106或安慰剂治疗8周,同时接受局部皮质类固醇治疗,之后是16周的随访期。主要终点是到169天治疗出现的不良事件和严重不良的发生率。MOR106皮下注射后的药代动力学(PK)和抗药抗体的出现将作为次要终点。此外,还将探索MOR106的疗效。
MOR106是一种单克隆抗体药物,靶向结合白介素17C(IL-17C)。IL-17C是一个新的靶标,在炎症性皮肤疾病如银屑病和特应性皮炎中被上调。基于临床前模型的发现,IL-17C在这些皮肤病中起着重要的促炎作用。重要的是,IL-17C已被证明在生物学功能方面不同于IL-17细胞因子家族中的其他成员,这是由于IL-17C是由不同的细胞类型产生(主要是上皮细胞)。在啮齿动物炎性皮肤模型中的结果支持了MOR106的临床开发。IL-17C与其受体(由亚单位IL-17RA和IL-17-RE组成)的结合被认为可触发炎症级联反应,在炎症性皮肤病的发生中起到了促进作用。通过与IL-17C特异性结合,MOR106旨在阻断IL-17C与其受体的结合作用,从而中和IL-17C的生物活性。
特应性皮炎(AD)是湿疹的一个特殊类型,这是一种严重的慢性炎症性皮肤病,主要表现为剧烈的瘙痒、明显的湿疹样变和皮肤干燥。MOR106是诺华AD管线资产的延伸,目前该公司已有一款口服药物ZPL389治疗AD处于II期临床。在一项双盲安慰剂对照Ib期研究中,MOR106已显示出初步的疗效迹象,并且安全性和耐受性良好。MOR106有望成为治疗AD及其他炎症性疾病的一种潜在首创的(first-in-class)抗IL-17C单抗。MOR106的授入(in-licensing)体现了诺华致力于免疫性皮肤病学的承诺。目前,诺华已有2款上市皮肤病学产品Cosentyx(secukinumab,IL-17A单抗)和Xolair(omalizumab,抗IgE单抗)。
【9】赫赛汀生物仿制药!台湾台康生计(EirGenix)授权山德士开发EG1204(曲妥珠单抗)独家权利[7]
近日,中国台湾生物技术公司台康生计(EirGenix, Inc)宣布与山德士(Sandoz AG)公司达成一项独家授权协议,授权山德士关于台康生计公司EG12014(曲妥珠单抗生物仿制药)除中国大陆以及台湾地区以外其他市场的独家商业化权利。EG12014是罗氏重磅生物制剂赫赛汀(Herceptin,曲妥珠单抗)的生物仿制药。
目前,EG12014(曲妥珠单抗生物仿制药)已进入全球III期临床试验(研究编号:EGC002)。截至目前,EG1204已获包括美国FDA、台湾TFDA在内的十个监管机构以及俄罗斯、白俄罗斯、乌克兰、南非、格鲁吉亚、韩国、印度和智利当局批准,可以进行该临床研究。该研究将入组800例乳腺癌患者,主要终点分析预计将在2020年下半年完成,以支持产品注册。
根据协议条款,台康生计将获得一笔500万美元的签约金,合计6500万美元的各阶段里程碑金,同时还有权获得产品在授权市场未来销售的利润分成付款。该协议也是台康生计公司自成立以来产品开发业务最重要的成就之一。
图片来源: symbiosisonlinepublishing.com
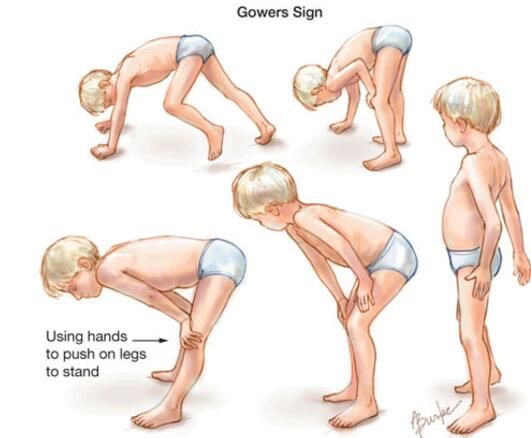
【10】杜氏肌营养不良(DMD)新药!首创结缔组织生长因子单抗pamrevlumab获美国FDA第3个孤儿药资格[8]
近日,美国生物制药公司FibroGen宣布,FDA已授予实验性抗CTGF单克隆抗体pamrevlumab治疗杜氏肌营养不良症(DMD)的孤儿药资格。
DMD是一种罕见的、使人虚弱的神经肌肉疾病,每3500至5000名新生儿中约有1人会受到影响。每年全球约有2万名儿童被诊断患有DMD。这种致命性的疾病是由基因突变引起的,导致肌营养不良蛋白的缺失或缺陷,肌营养不良蛋白是正常肌肉功能所必需的一种蛋白质。肌营养不良蛋白的缺乏导致肌肉无力、肌肉萎缩、纤维化和炎症。DMD患者通常在6-13岁进入卧床(non-ambulatory)状态,出行需要依赖轮椅,其渐进性肌肉无力可能导致与呼吸和心肌相关的严重医学问题。
一旦进入卧床状态,患者关节挛缩和脊柱侧凸会迅速发展,并可能导致心肌病和呼吸衰竭,并在年轻成人中导致死亡。虽然目前多数DMD药物的开发都是针对非卧床(ambulatory)DMD患者,但大多数DMD患者都是卧床的。pamrevlumab的临床开发项目目前针对这类卧床DMD患者中存在的未满足医疗需求。
pamrevlumab是FibroGen开发一种首创(first-in-class)全人抗体,可靶向抑制结缔组织生长因子(CTGF)的活性。CTGF是组织重塑和纤维化的中心介质,涉及广泛的纤维化和增生性疾病,影响全身器官系统。这些疾病的特征是持续的过度瘢痕化,导致器官功能障碍和衰竭,其中许多疾病几乎没有有效的治疗选择,包括特发性肺纤维化(IPF)、胰腺癌、杜氏肌营养不良(DMD)。
目前,FibroGen公司正在开展pamrevlumab治疗DMD的一项II期临床研究,该研究共入组了21例卧床DMD患者,这些患者已经通过了52周治疗。该公司临床开发和药物安全副总裁Elias Kouchakji表示,“目前我们正在评估本研究中的一些临床参数,包括肺功能、心脏功能、上肢肌肉功能和组织纤维化。”
【11】CAR-T对手来了!CD19单抗联合来那度胺治疗 淋巴瘤患者总缓解率可达60%[9]
近日,德国生物制药公司MorphoSys发布了新型人源化Fc结构域优化免疫增强单克隆抗体tafasitamab(MOR208)II期临床研究L-MIND(NCT02399085)的最终分析结果。L-MIND是一项单臂、开放标签、多中心研究,评估tafasitamab联合来那度胺(lenalidomide)治疗复发性/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)成人患者的疗效和安全性,这些患者既往已接受至少一种但不超过3种系统治疗方案,并且不符合高剂量化疗(HDC)和自体干细胞移植(ASCT)条件。
此次数据包括了80例入组研究的患者,这些患者接受了tafasitamab与来那度胺联合治疗,并按照研究方案至少随访了一年。更新的疗效结果基于独立审查委员会对所有患者评估的缓解。
结果显示,研究达到了总缓解率(ORR)主要终点:联合治疗组的ORR为60%(n=48/80)、完全缓解率为43%(n=34/80)。随访17.3个月,中位无进展生存期为12.1个月,中位缓解持续时间为21.7个月。详细数据将在今年6月在瑞士卢加诺举行的恶性淋巴瘤国际会议(ICML)上公布。这些数据确认了2018年12月在美国血液学会(ASH)年会上发布的数据:中位随访8.3个月,总缓解率为49%、完全缓解率为31%。
Tafasitamab是一种靶向CD19的人源化Fc增强单克隆抗体,其Fc结构域进行了修饰(包含2个氨基酸取代S239D和I332E),通过提高对效应细胞上激活型FcγRIIIa的亲和力,显著增强抗体依赖性细胞介导的细胞毒性(ADCC)和抗体依赖性细胞吞噬(ADCP),从而改善肿瘤细胞杀伤的关键机制。临床前模型研究中,tafasitamab已被证实通过结合CD19可诱导癌细胞直接凋亡。tafasitama已被FDA授予治疗R/R DLBCL快速通道资格和突破性药物资格、并被EMA授予治疗DLBCL和CLL/SLL孤儿药资格。
以上列出的仅仅是近期科学家们在单抗药物临床研究的一部分进展情况,相信随着科学家们后期深入的研究,未来有一天将能开发出更多更好治疗癌症、炎症等多种人类疾病的新型单抗药物。
参考资料:
【4】AbbVie halts enrollment after brain cancer trial misses goal, shares fall
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


