创新药物类型!FDA批准新基潜在重磅贫血疗法上市
来源:药明康德 2019-11-09 19:04
今日,美国FDA宣布,批准新基(Celgene)和Acceleron公司联合开发的Reblozyl(luspatercept-aamt)上市,用于治疗输血依赖性β地中海贫血症(beta thalassemia)患者的贫血症状。Reblozyl是一款“first-in-class”血红细胞成熟剂,代表了通过调节后期血红细胞成熟过程降低输血负担的创新药物类型。除了治疗β地中海贫血症以外,它治疗输血依赖
今日,美国FDA宣布,批准新基(Celgene)和Acceleron公司联合开发的Reblozyl(luspatercept-aamt)上市,用于治疗输血依赖性β地中海贫血症(beta thalassemia)患者的贫血症状。Reblozyl是一款“first-in-class”血红细胞成熟剂,代表了通过调节后期血红细胞成熟过程降低输血负担的创新药物类型。除了治疗β地中海贫血症以外,它治疗输血依赖性骨髓增生异常综合征(MDS)的申请也已经被FDA和EMA接受。这款新药有潜力为因为不同原因导致贫血症状的患者造福。
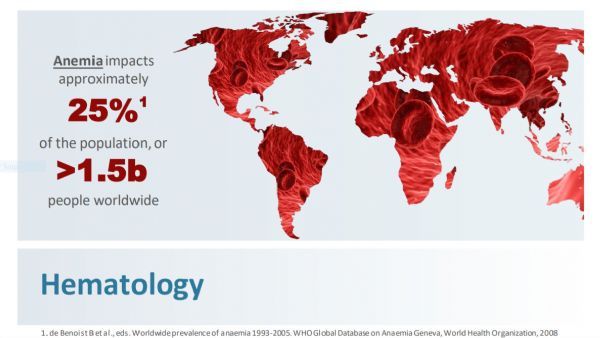
贫血是影响到世界上接近25%人口的常见症状,多数患者的贫血症状是暂时的,但是有些罕见病患者(包括β地中海贫血症,骨髓增生异常综合征,骨髓纤维化患者)会出现长期的慢性贫血。贫血显着影响患者的生活质量,导致疲惫、气短、注意力下降、日常活动水平受限等症状。慢性贫血患者通常需要依赖经常输入血红细胞来缓解他们的症状。
然而经常输血不但给患者带来生活和经济上的负担,而且可能导致铁元素过量、感染、免疫反应等副作用。自1989年合成促红细胞生成素(erythropoietin)获得FDA批准以来,FDA还没有批准一款治疗由于β地中海贫血症、骨髓增生异常综合征、和/或骨髓纤维化造成的贫血的新疗法。
Reblozyl是新基和Accleron公司联合开发的一款“first-in-class”红细胞成熟剂。它是一种可溶性融合蛋白,由人免疫球蛋白G1(IgG1)的Fc结构域与活化素受体IIB(ActRIIB)的细胞外结构域融合而成。Reblozyl能够作为TGF-β的配体陷阱(ligand trap),防止TGF-β激活Smad2/3信号通路,进而促进晚期红细胞的分化和成熟。它曾经被FDA授予孤儿药资格,快速通道资格,治疗β地中海贫血症的新药申请也被授予了优先审评资格。
这一批准是基于包括336名输血依赖性β地中海贫血症患者的3期临床试验结果。在接受Reblozyl治疗的患者中,21%的患者的输血负担与基线相比降低超过33%,显着优于接受安慰剂治疗的对照组(4.5%,p<0.0001)。
除了在治疗输血依赖性β地中海贫血症患者时表现出良好疗效以外,Reblozyl在治疗骨髓增生异常综合征患者的3期临床试验中,让47.1%的患者实现8周无需输血,对照组这一数值只有15.8%。
此外,Reblozyl还在2期临床试验中用于治疗骨髓纤维化患者。新基和Acceleron公司还计划开展其它临床试验,进一步扩展Reblozyl适用的患者群,将它开发成为一款治疗慢性贫血的潜在平台疗法。
我们祝贺这款具有创新机制的贫血疗法获批上市,也期待它能够为更多贫血患者造福。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->